Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции

Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
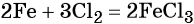
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
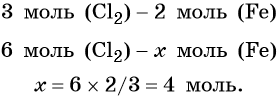
Определяем массу железа:
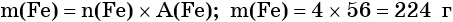
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
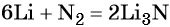
Определяем количество вещества азота, вступившего в реакцию:
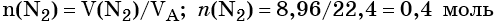
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
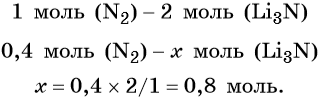
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
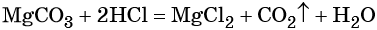
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
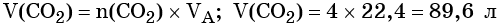
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
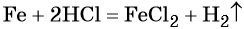
Определим количество вещества железа:
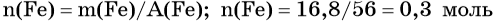
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
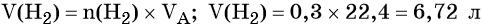
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
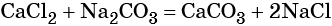
Согласно уравнению химической реакции составим пропорцию и решим её:
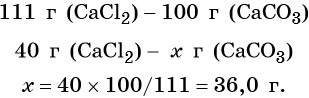
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
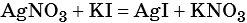
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
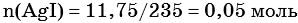
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
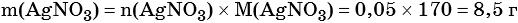
3) Вычислена массовая доля нитрата серебра в исходном растворе:
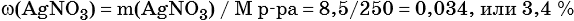
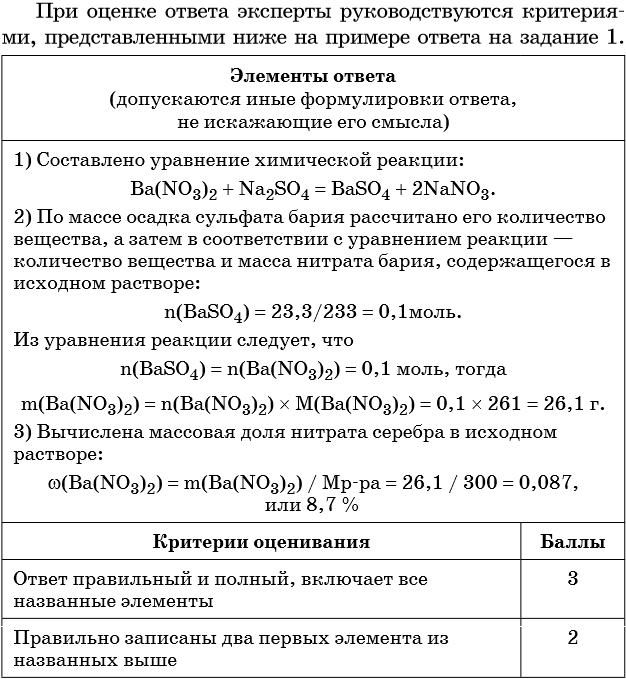
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
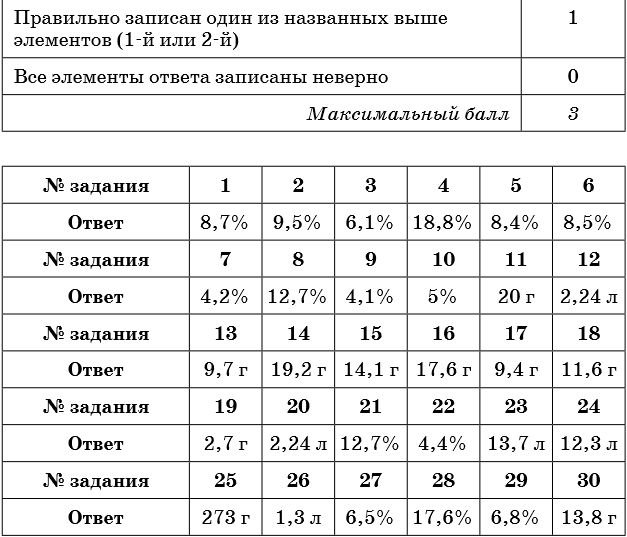
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Выполнение заданий высокого уровня сложности
Задачи с расчетами по уравнениям
реакций,
происходящих в растворах
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
![]() р.в-во
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•![]() р.в-во,
р.в-во,
mр-р = mр.в-во / ![]() р.в-во.
р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•![]() р-р,
р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•![]() р.в-во.
р.в-во.
Количество вещества находят по массе
растворенного вещества:
![]() = mр.в-во
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
![]() изб
изб
= ![]() исх –
исх – ![]() прор.
прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты (![]() = 1,05 г/мл). Найти массовую долю
= 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано:
m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл,
|
Найти: |
Р е ш е н и е
![]()
![]() (Мg) = m / M
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р•![]() = 200 (мл)•1,05 (г/мл) = 210
= 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•![]() р.в-во = 210•0,12 =
р.в-во = 210•0,12 =
25,2 г.
![]() р.в-во(H2SO4)
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
![]() (MgSO4) = 0,2
(MgSO4) = 0,2
моль,
![]() (H2) = 0,2
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M•![]() = 120 (г/моль)•0,2 (моль) = 24 г.
= 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M•![]() = 2 (г/моль)•0,2 (моль) = 0,4 г.
= 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
![]() р.в-во(MgSO4)
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. ![]() р.в-во(MgSO4) = 11,2 %.
р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано:
mр-р(Fe2(SO4)3)
mр-р(NaOH) = 50 г,
|
Найти: |
Р е ш е н и е
![]()
mр.в-во(Fe2(SO4)3) = mр-р•![]() р.в-во = 250
р.в-во = 250
(г)•0,08 = 20 г.
![]() (Fe2(SO4)3)
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•![]() р.в-во = 50 (г)•0,3 = 15 г.
р.в-во = 50 (г)•0,3 = 15 г.
![]() (NaOH) = m/M =
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
![]() (Na2SO4)
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
![]() (Fe(OH)3) = 0,05
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
![]() прор(NaOH) =
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
![]() изб(NaOH) =
изб(NaOH) = ![]() исх –
исх – ![]() прор = 0,375
прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M•![]() =
=
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M•![]() = 142 (г/моль)•0,15 (моль) = 21,3 г.
= 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M•![]() = 107 (г/моль)•0,1 (моль) = 10,7 г.
= 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
![]() р.в-ва(Na2SO4)
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
![]() р.в-ва(NaOH)
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. ![]() р.в-во(Na2SO4) = 7,4 %,
р.в-во(Na2SO4) = 7,4 %, ![]() р.в-во(NaOH) = 1 %.
р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты (![]() = 1,04 г/мл) с массовой долей 9 %.
= 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. ![]() р.в-во(HCl) = 4,2 %.
р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты (![]() = 1,05 г/мл). Вычислить массовую долю
= 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. ![]() р.в-во(HCl) = 2,9 %.
р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты (![]() = 1,05 г/мл) с массовой долей 10 %. Найти
= 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. ![]() р.в-во(FeCl2) = 5,9 %.
р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. ![]() р.в-во(KCl) = 14,8 %.
р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. ![]() р.в-во(Na2SO4) = 3,3 %,
р.в-во(Na2SO4) = 3,3 %, ![]() р.в-во(NaOH) = 0,9 %.
р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (![]() оставш
оставш
= ![]() 1 –
1 – ![]() прор);
прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
![]()
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано:
mр-р1(HNO3)
|
Найти: m(CaCO3). |
Р е ш е н и е
![]()
![]() (СаСО3) = х
(СаСО3) = х
моль; ![]() (HNO3)прор
(HNO3)прор
= 2х моль;
![]() (СО2) = х
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M•![]() = 100 (г/моль)•х (моль) = 100х г;
= 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•![]() р.в-во1 = 600
р.в-во1 = 600
(г)•0,315 = 189 г;
![]() 1(HNO3)
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
![]() оставш(HNO3)
оставш(HNO3)
= ![]() 1 –
1 – ![]() прор = 3 – 2х
прор = 3 – 2х
моль,
mоставш(HNO3) = М•![]() = 63 (г/моль)•(3 – 2х) =
= 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
![]() р.в-во2(HNO3)
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, ![]() (СаСО3)
(СаСО3)
= 0,955 моль,
m(CaCO3) = M•![]() = 100 (г/моль)•0,955 (моль) = 95,5 г.
= 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия (![]() = 1,08 г/мл), чтобы получить раствор, в
= 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано:
Vр-р1(Na2CO3)
|
Найти: m(CaCl2•6H2O). |
Р е ш е н и е
![]()
![]() (СaCl2•6H2O)
(СaCl2•6H2O)
= x моль, ![]() (CaCl2)
(CaCl2)
= x моль,
![]() прор(Na2CO3)
прор(Na2CO3)
= х моль, ![]() (СаСО3)
(СаСО3)
= х моль;
m(CaCl2•6H2O) = M•![]() = 219 (г/моль)•х (моль) = 219х г;
= 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M•![]() = 100x г;
= 100x г;
mр-р1(Na2CO3) = Vр-р1•![]() р-р1 = 47 (мл)• 1,08
р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1•![]() р.в-во1 = 50,76
р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
![]() 1(Na2CO3)
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
![]() оставш(Na2CO3)
оставш(Na2CO3)
= ![]() 1 –
1 – ![]() прор = 0,12 – х,
прор = 0,12 – х,
mоставш(Na2CO3) = M•![]() = 106(0,12 – x) =
= 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
![]() р.в-во2 = mоставш(Na2CO3)
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М•![]() = 219 (г/моль)•0,0646 (моль) = 14,14 г.
= 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака (![]() = 0,892
= 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты (![]() = 1,198 г/мл), чтобы массовая доля
= 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия (![]() = 4,1
= 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты (![]() = 1,05
= 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2![]() ;
;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2![]() .
.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано:
V(SO2) = 11,2 л,
|
Найти: V(H2O). |
Р е ш е н и е
![]()
![]() (SO2) = V / VM
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, ![]() (H2SO3) = 0,5
(H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M•![]() = 82 (г/моль)•0,5 (моль) =
= 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ ![]() р.в-во(H2SO3)
р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M•![]() = 64 (г/моль)•0,5 (моль) = 32 г,
= 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/![]() = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
= 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
![]() р.в-во(продукт)
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано:
V(H2O) = 100 мл,
|
Найти: m(LiH). |
Р е ш е н и е
![]()
Пусть ![]() (LiH) = x
(LiH) = x
моль,
тогда ![]() (LiOH) = x
(LiOH) = x
моль, ![]() (Н2) = х
(Н2) = х
моль.
m(LiH) = M•![]()
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•![]()
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M•![]() = 2 (г/моль)•х = 2х г.
= 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V•![]() = 100 (мл)•1 (г/мл) = 100 г.
= 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
![]() р.в-во(LiOH)
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, ![]() (LiH) =
(LiH) =
0,21 моль.
m(LiH) = M•![]()
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•![]() р.в-во1,
р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
![]() р.в-во2
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано:
mр-р1(H3PO4)
m(P2O5) = 28,4 г. |
Найти: |
Р е ш е н и е
![]()
![]() (P2O5) =
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
![]() прод(Н3РО4)
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М•![]() = 98 (г/моль)•0,4 (моль) =
= 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•![]() р.в-во1 = 200 (г)
р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
![]() р.в-во2(Н3РО4)
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: ![]() (Н3РО4) = 25,92 %.
(Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано:
mр-р1(Н3РО4)
|
Найти: m(P2O5). |
Р е ш е н и е
![]()
Пусть ![]() (Р2О5)
(Р2О5)
= х моль,
тогда ![]() (Н3РО4)
(Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М•![]() = 98 (г/моль)•2х
= 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М•![]() = 142 (г/моль)•х
= 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•![]() р.в-во1 = 70 (г)•
р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
![]() р.в-во2(Н3РО4)
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, ![]() (Р2О5)
(Р2О5)
= 0,15 моль.
m(P2O5) = M•![]() = 142 (г/моль)•0,15 (моль) = 21,3 г.
= 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. ![]() прод = 39,2 %.
прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. ![]() р.в-во2(Н2SО3) = 33,4 %.
р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. ![]() р.в-во2(Н3РО4) = 66,8 %.
р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массовую долю растворенного
вещества.
О т в е т. ![]() (NaOH) = 19,2 %.
(NaOH) = 19,2 %.
Задача 24. К 120 г 8%-го раствора гидроксида
натрия добавили 18,6 г оксида натрия. Вычислите
массовую долю гидроксида натрия в
образовавшемся растворе.
О т в е т. ![]() р.в-во(NaOH) = 24,2 %.
р.в-во(NaOH) = 24,2 %.
Задача 25. Найти массу оксида серы(VI),
которую нужно добавить к 2 л 8%-го раствора серной
кислоты (![]() = 1,06
= 1,06
г/мл), чтобы массовая доля серной кислоты стала
равной 20 %.
О т в е т. m(SO3) = 248,2 г.
Задача 26. Какую массу фосфора необходимо
сжечь в кислороде, чтобы, растворив полученный
оксид в 1000 г раствора ортофосфорной кислоты с
массовой долей 50 %, получить раствор этой
кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо
растворить в 120 мл воды для получения раствора
щелочи с массовой долей 18 %?
О т в е т. m(Na) = 13,8 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:


Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.

Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).

Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.

Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Как вычислить объем продукта реакции
В задачах по химии школьного курса, как правило, требуется вычислить объем для газообразного продукта реакции. Вы можете это сделать, если известно количество молей любого участника химического взаимодействия. Или найдите это количество из других данных задачи.

Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор;
- – таблица Менделеева.
Инструкция
Прежде всего, составьте уравнение реакции. Возьмите для примера реакцию горения аммиака в кислороде с образованием азота и воды. Вам необходимо найти объем выделившегося газа N2.
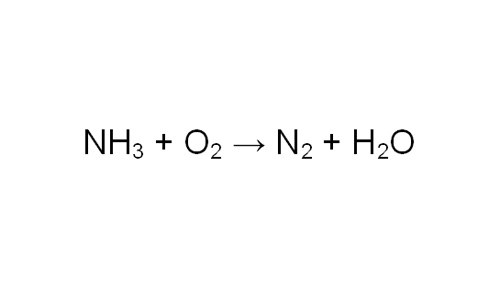
Проставьте коэффициенты в уравнении. Чтобы проверить себя, сосчитайте количество атомов одного элемента в левой и правой части уравнения. Обратите внимание, в каком соотношении химические соединения участвуют в реакции. Теперь, зная количество любого из участников реакции, вы можете определить, сколько молей азота образовалось.
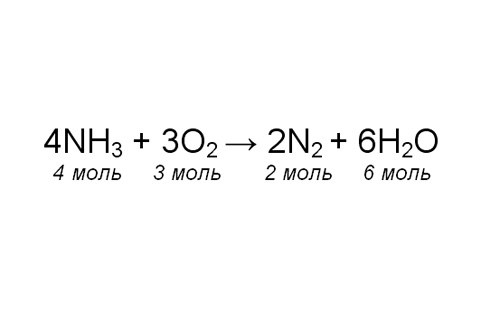
Например, известно, что масса полученной воды, m(H2O), 72 грамма. Рассчитайте молярную массу воды. Для этого найдите в таблице Менделеева значения атомных масс элементов, составляющих молекулу, и сложите их: М(H2O) = 2*1 + 16 = 18 г/моль. Вычислите количество молей образовавшейся воды: v(H2O) = m(H2O)/M(H2O) = 72/18 = 4 моля.
Определите, сколько молей азота получилось, составив пропорцию: 6 моль Н2О – 2 моля N2; 4 моля Н2О – х моль N2. Решите уравнение, найдя х: х = 2*4/6 = 1,33 моль.
Согласно закону Авогадро, один моль любого газа в нормальных условиях, т.е. при температуре 0о и давлении 101325 Па, занимает 22,4 литра. Рассчитайте объем выделившегося 1,33 моля азота: V(N2) = 22,4*1,33 = 29,8 литра.
Если вы знаете, что в реакцию вступило, к примеру, 18 литров кислорода, воспользуйтесь законом объемных отношений Гей-Люссака. Он определяет, что объемы газов, участвующих в реакции, относятся друг к другу, как простые целые числа. То есть из уравнения реакции следует, что из трех литров O2 получается два литра N2. Вы можете сделать вывод, что из 18 литров кислорода образуется 12 литров азота.
Источники:
- вычислите продукт реакции н2 s
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
