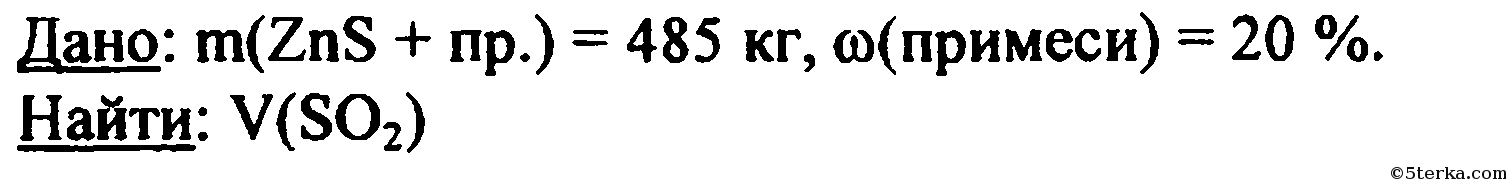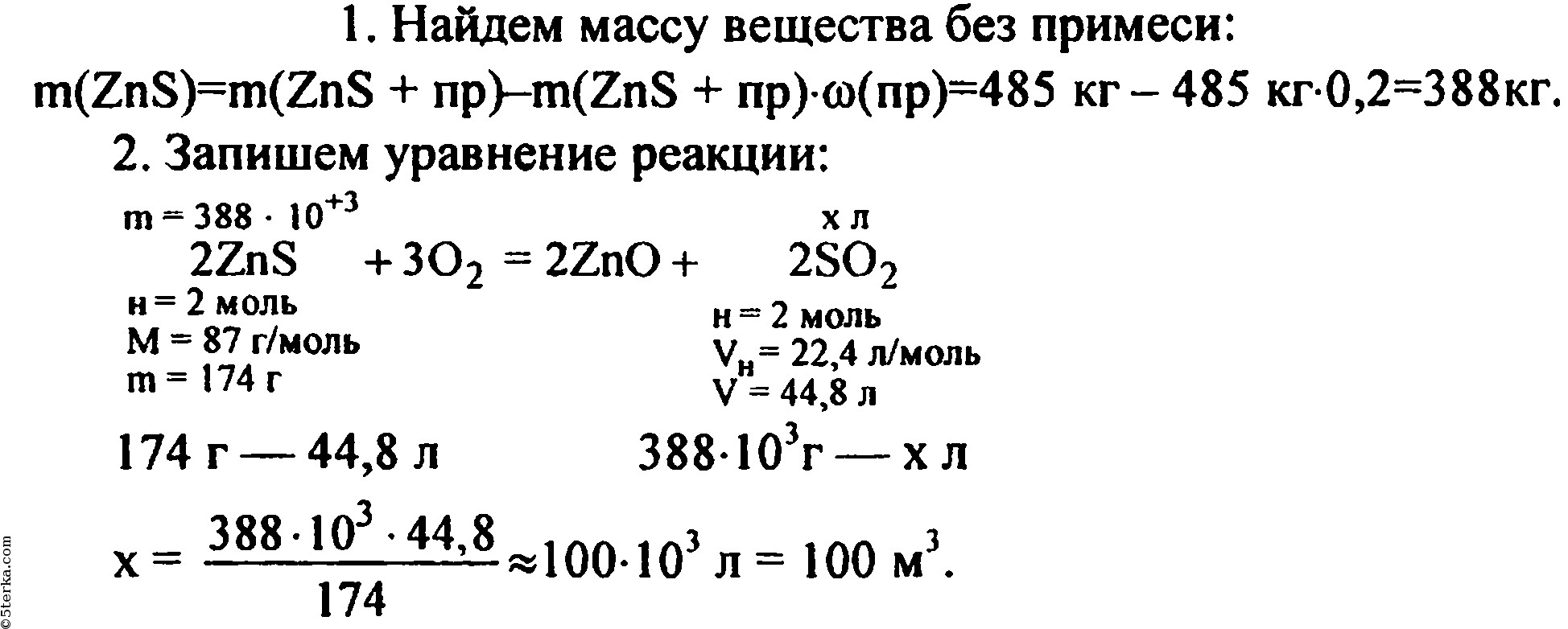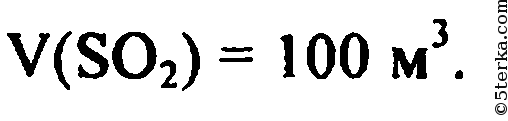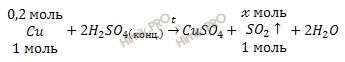Лучший ответ
Маил Мамишев
Гений
(82713)
7 лет назад
V =m/M *22.4л =16/ 64 *22,4 =22,4/4=5,6л
где m -масса газа
М- молекулярная масса газа (М (SO2) =32+2*16=64)
22.4-Молярный объём идеального газа
Остальные ответы
Spider Man
Мастер
(1231)
7 лет назад
16/64=0.25*22.4=5.6
Рина
Мастер
(1054)
6 лет назад
Молярная масса SO2 равна 64, поэтому у нас n = 16/64 = 1/4 моля. При н. у. один моль газа занимает объем 22.4 л, поэтому 1.4 моля будут иметь объем 22.4/4 = 5.6 л.
Ответ
Проверено экспертом
Дано:
m'(ZnS) = 485 кг
ω(SiO₂) = 20% или 0,2
Найти:
V(SO2)-?
Решение.
m(ZnS) = m'(ZnS) – m'(ZnS)*ω(SiO₂)
m(ZnS) = 485 кг – 485 кг*0,2 = 388 кг
М(ZnS) = 97 кг/кмоль
n(ZnS) = m/M = 388 кг/97 кг/кмоль = 4 кмоль
2ZnS + 3O2 = 2ZnO + 2SO2
Из УХР видно, что n(SO2)=n(ZnS)
n(SO2) = 4 кмоль
Vm = 22,4 л/моль
V(SO2) = n(SO2)*Vm = 4 кмоль*22,4 м³/кмоль = 89,6 м³
Ответ: 89,6 м³
Ответы и объяснения
1 Вычислите объем сернистого газа (н.у.), который образуется при обжиге 485 кг цинковой обманки, содержащей в качестве примеси 20% оксида кремния (IV).
Решение:
Ответ:
Сернистый газ (получение)
Рассчитайте объем сернистого газа (SO2), который выделяется при взаимодействии меди (Cu) массой 12,8 грамм с избытком концентрированной серной кислоты (H2SO4).
Решение задачи
Составим уравнения реакции взаимодействия меди с концентрированной серной кислоты (H2SO4):
Найдем химическое количество меди по формуле, устанавливающей связь между химическим количеством вещества и массой:
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль получаем:
n (Cu) = 12,8/63,5 = 0,2 (моль).
По уравнению реакции рассчитаем, сколько моль сернистого газа (SO2) образуется в ходе реакции:
при участии 0,2 моль Cu образуется моль SO2
при участии 1 моль Cu образуется 1 моль SO2
Откуда:
Найдем сколько литров сернистого газа (SO2) образуется при взаимодействии меди (Cu) с избытком концентрированной серной кислоты (H2SO4) по формуле, устанавливающей связь между объемом и химическим количеством вещества:
Получаем:
V (SO2) = 0,2 ∙ 22,4 = 4,48 (л).
Ответ:
объем сернистого газа равен 4,48 литра.
|
Найдите объем сернистого газа который образуется в результате сгорания 15 л сероводорода. Для решения данной задачи необходимо знать газовый закон Авогадро и его четвертое следствие: “Объёмы реагирующих и полученных газообразных веществ относятся как коэффициенты перед соответствующими веществами в уравнении реакции”. Составляем уравнение реакции горения сероводорода: 2H2S +3O2 = 2SO2 + 2H2O. Из уравнения следует, исходя из закона Авогадро, что n(H2S) : n(SO2) = V(H2S) : V(SO2) = 2:2 = 1:1 = 15: 15. Ответ: 15 л сернистого газа. автор вопроса выбрал этот ответ лучшим Знаете ответ? |