Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
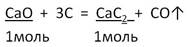 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Загрузить PDF
Загрузить PDF
В химии термин “теоретический выход” используется для описания максимального количества продукта, которое может получиться в результате химической реакции. Сначала следует записать сбалансированное химическое уравнение и определить ключевой компонент реакции. После того как вы измерите количество этого компонента, можно будет рассчитать количество продукта реакции. Это и будет теоретический выход продукта реакции. В реальных экспериментах часть продукта обычно теряется из-за неидеальных условий.
-
1
Начните со сбалансированного уравнения химической реакции. Уравнение реакции подобно рецепту. С левой стороны в нем приведены реагенты, а с правой — продукты реакции. В правильно сбалансированном уравнении химической реакции слева и справа стоит одинаковое число атомов каждого элемента.[1]
-
2
Рассчитайте молярные массы реагентов. С помощью таблицы Менделеева или справочника определите молярные массы атомов всех элементов, которые входят в участвующие в реакции соединения. Сложите их, чтобы определить молярную массу каждого реагента. Проделайте это для одной молекулы соединения. Рассмотрим еще раз реакцию между кислородом и глюкозой с образованием углекислого газа и воды:
→
.[2]
-
3
Переведите количество каждого реагента из граммов в моли. В реальном эксперименте известны массы реагентов в граммах. Чтобы перевести их в количество молей, поделите массу каждого реагента на его молярную массу.[3]
-
4
Определите соотношение реагентов. Моль используется в химии для того, чтобы по массе вещества определить количество его молекул. Определив количество молей кислорода и глюкозы, вы узнаете, сколько молекул каждого вещества вступает в реакцию. Чтобы найти соотношение между двумя реагентами, поделите число молей одного реагента на количество молей другого реагента.[4]
- В рассматриваемом примере в начале реакции имеется 1,25 моля кислорода и 0,139 моля глюкозы. Таким образом, отношение количества молекул кислорода к числу молекул глюкозы составляет 1,25 / 0,139 = 9,0. Это означает, что молекул кислорода в 9 раз больше, чем молекул глюкозы.
-
5
Найдите стехиометрическое соотношение реагентов. Посмотрите на сбалансированное уравнение химической реакции. Коэффициенты перед каждой молекулой показывают относительное количество данного вида молекул, необходимое для протекания реакции. Уравнение химической реакции дает так называемое стехиометрическое соотношение реагентов, при котором они будут расходоваться полностью.[5]
- Для данной реакции имеем
. Коэффициенты указывают на то, что на каждую молекулу глюкозы требуется 6 молекул кислорода. Таким образом, стехиометрическое соотношение для этой реакции составляет 6 молекул кислорода / 1 молекула глюкозы = 6,0.
- Для данной реакции имеем
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В большинстве химических реакций один из реагентов расходуется раньше остальных. Этот реагент называют ключевым компонентом реакции. Он определяет, как долго будет продолжаться данная реакция и каким будет теоретический выход продукта реакции. Сравните два рассчитанных соотношения, чтобы определить ключевой компонент реакции:[6]
- В рассматриваемом примере начальное количество молей кислорода в 9 раз превышает число молей глюкозы. Согласно уравнению, стехиометрическое отношение кислорода к глюкозе составляет 6:1. Следовательно, у нас имеется больше кислорода, чем требуется, поэтому второй реагент, глюкоза, является ключевым компонентом реакции.
Реклама
-
1
Посмотрите на уравнение и определите ожидаемый продукт реакции. Правая часть уравнения содержит продукты реакции. Если уравнение сбалансировано, коэффициенты перед каждым продуктом реакции показывают его относительное количество в молях. Они соответствуют теоретическому выходу продуктов реакции в том случае, если взять стехиометрическое соотношение реагентов.[7]
-
2
Запишите количество молей ключевого компонента реакции. Всегда следует сравнивать число молей реагента с количеством молей продукта реакции. Сравнение их масс не даст правильного результата.[8]
- В рассматриваемом примере ключевым компонентом реакции является глюкоза. Расчеты молярной массы показали, что 25 граммов глюкозы соответствуют 0,139 моля.
-
3
Сравните соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению и поделите количество молекул ожидаемого продукта на число молекул ключевого компонента реакции.
-
4
Умножьте найденное отношение на количество ключевого компонента реакции в молях. В результате вы получите теоретический выход ожидаемого продукта реакции в молях.
- В рассматриваемом примере 25 граммов глюкозы соответствуют 0,139 моля. Отношение углекислого газа к глюкозе равно 6:1. То есть ожидается, что из каждого моля глюкозы получится шесть молей углекислого газа.
- Теоретический выход углекислого газа составляет (0,139 моля глюкозы) x (6 молей углекислого газа / 1 моль глюкозы) = 0,834 моля углекислого газа.
-
5
Переведите полученный результат в граммы. Это обратно тому, что вы делали, когда в самом начале вычисляли количество молей реагента. Если известно ожидаемое число молей, достаточно умножить его на молярную массу продукта реакции, чтобы получить его теоретический выход в граммах.[9]
- В нашем примере молярная масса CO2 составляет около 44 г/моль (молярная масса углерода ~12 г/моль, кислорода ~16 г/моль, в итоге имеем 12 + 16 + 16 = 44).
- Умножьте 0,834 моля CO2 x 44 г/моль CO2 = ~36,7 грамма. Таким образом, теоретический выход продукта реакции равен 36,7 грамма CO2.
-
6
При желании проделайте такие же вычисления для других продуктов реакции. Во многих экспериментах интерес представляет лишь один продукт реакции. Однако если вы хотите найти теоретический выход второго продукта, просто повторите вычисления.
- В нашем примере вторым продуктом реакции является вода,
. Согласно сбалансированному уравнению реакции, из 6 молекул глюкозы получается 6 молекул воды. Это соответствует соотношению 1:1. Таким образом, если в начале реакции имеется 0,139 моля глюкозы, в конце должно получиться 0,139 моля воды.
- Умножьте количество молей воды на ее молярную массу. Молярная масса воды составляет 2 + 16 = 18 г/моль. В результате получаем 0,139 моля H2O x 18 г/моль H2O = ~2,50 грамма. Таким образом, в данном эксперименте теоретический выход воды составит 2,50 грамма.
Реклама
- В нашем примере вторым продуктом реакции является вода,
Об этой статье
Эту страницу просматривали 23 616 раз.
Была ли эта статья полезной?
Дорогие друзья продолжаем наши разборы задач и сегодня разберем “Что такое выход продукта химической реакции?” Не всегда в ходе практических опытов мы получаем то количество вещества, на которое изначально рассчитывали. Часть вещества может не прореагировать, часть потеряться. Поэтому, полностью реагенты вряд ли когда-то прореагируют, отсюда возникли понятия практический выход от теоретически возможного
Сначала основные термины:
Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Алгоритм решения задач
1.Записываем условие задачи, определяем известные и не известные данные
2.Составляем уравнение химической реакции (УХР), расставляем коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3.Находим количество вещества известных данных
4.По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
5.Находим массовую (объёмную) долю выхода продукта по формуле.
6.Если в условии задачи уже дан выход продуктов реакции, следовательно выводим из основной формулы практические или теоретические массы.
Пример 1. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Пример 2. Определите массу осадка (г, н.у.), полученного при сливании двух растворов, один из которых содержит 4,5 г хлорида кальция, а другой 4,1 г ортофосфата натрия. Выход продукта реакции составляет 88%
Пример 3. Рассчитайте выход (%) продукта реакции 43,05 г анилина с избытком бромной воды, если для нейтрализации выделившегося бромоводорода потребовалось 62,5 г 40%-ного раствора гидроксида натрия
Задачи для самоконтроля
1.При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,5 г. Определите выход продукта реакции (%). (91,67%.)
2.При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объемом 4,2 л. Вычислите практический выход газа(%). (75%.)
3.Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить восстановлением его оксида массой 228 кг, если практический выход хрома составляет 95%. (148,2 кг.)
4.При каталитическом гидрировании формальдегида получили метиловыи спирт, при взаимодейтвии которого с металлическим натрием образовался водород объемом 8,96 л (н. у.). Выход продукта на каждой стадии синтеза составил 80%. Определите исходную массу формальдегида. (37,5 г.)
5.Вычислите, какой объем раствора с массовой долей гидроксида калия 26% (р = 1,24 r/мл) необходим для реакции с алюминием, чтобы получить водород объемом 10,64 л, если выход водорода составляет 95%. (41,35)
Надеюсь, моя статья была для вас полезна. Еще больше интересной информации вы найдете в наших сообществах в ВКонтакте vk.com/biochemschool и Телеграме t.me/biochemschool.
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, – теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( – “этта”) – это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.















