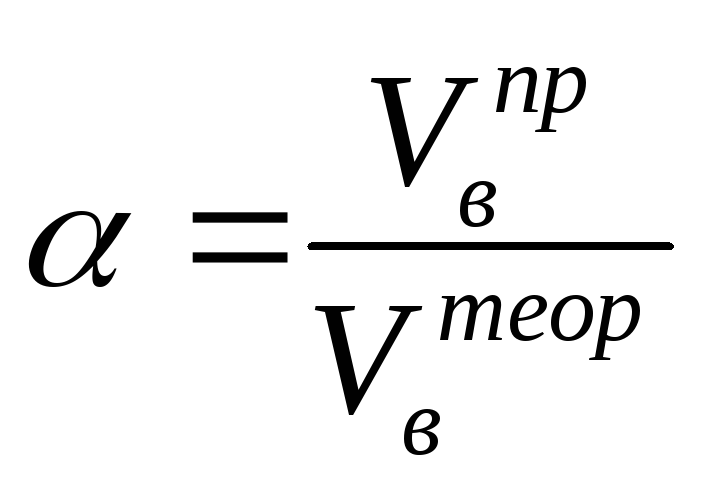Расчет
объема воздуха, необходимого для горения,
предполагает вычисление
а)
теоретического объема воздуха Vвтеор
и б) практического объема воздуха Vвпр,
затраченного на горение (с учетом
коэффициента избытка воздуха).
Стехиометрическое
количество воздуха
в уравнении реакции горения предполагает,
что при данном соотношении компонентов,
участвующих в реакции горения, воздух
расходуется полностью. Объем воздуха
в данном случае называется теоретическим
(Vвтеор).
Горение
может происходить не только при
стехиометрическом соотношении
компонентов, но и при значительном
отклонении от него. Как правило, в
условиях пожара на сгорание вещества
воздуха затрачивается больше, чем
определяется теоретическим расчетом.
Избыточный воздух Vв
в реакции горения не расходуется и
удаляется из зоны реакции вместе с
продуктами горения. Таким образом,
практический объем воздуха равен
Vвпр
= Vвтеор
+ Vв
(2.1)
и,
следовательно, избыток
воздуха
будет равен
Vв=
Vвпр
– Vвтеор
(2.2)
Обычно
в расчетах избыток воздуха при горении
учитывается с помощью коэффициента
избытка воздуха
().
Коэффициент избытка воздуха показывает,
во сколько раз в зону горения поступило
воздуха больше, чем это теоретически
необходимо для полного сгорания вещества:
(2.3)
Для
горючих смесей стехиометрического
состава (т.е. состава, соответствующего
уравнению реакции горения) коэффициент
избытка воздуха
= 1, при этом реальный расход воздуха
равен теоретическому. В этом случае
обеспечивается оптимальный режим
горения.
При
> 1 горючую смесь называют бедной
по горючему компоненту,
а при
< 1 – богатой
по горючему компоненту.
Избыток воздуха
имеется только в смеси, бедной по горючему
компоненту. Из формул (3.2) и (3.3) следует
Vв=
Vвтеор(
1)
(2.4)
В
закрытом объеме диффузионное горение
большинства горючих материалов возможно
только до определенной пороговой
концентрации кислорода, так называемой
остаточной
концентрации кислорода в продуктах
горения
(О2)ПГ.
Для
большинства органических веществ она
составляет 12 – 16 % О2.
Для некоторых веществ, например,
ацетилена С2Н2,
ряда металлов, горение возможно и при
значительно меньшем содержании кислорода
(до 5 % объемных О2).
Зная
содержание кислорода в продуктах
горения, можно определить коэффициент
избытка воздуха (коэффициент участия
воздуха в горении) на реальном пожаре:
(2.5)
2.1.1.
Горючее – индивидуальное химическое
соединение
Теоретический
объем воздуха, необходимый для горения
рассчитывается по уравнению реакции
горения.
|
Расчет |
Пример |
1.
Записываем уравнение реакции горения
1
кг х
м3
С2Н5ОС2Н5
+ 6(О2
+ 3,76N2)
=4СО2
+ 5Н2О
+63,76N2
М
= 74 кг 64,76
Vм
=
=64,7619,35
м3
2.
Записываем в уравнении известные и
неизвестные величины с указанием
размерности.
3.
Молярная масса диэтилового эфира 74
кг/кмоль. Записываем эту величину под
формулой эфира.
4.
При нормальных условиях молярный объем
(Vм)
любого газообразного вещества составляет
22, 4 л/моль или 22,4 м3/кмоль.
Если
условия отличаются от нормальных, то
необходимо определить, какой объем
будет занимать 1 кмоль любого газообразного
вещества при данных условиях. Расчет
VМ
ведут по формуле объединенного газового
закона:
,
где
Р
и
Т – данные
в задаче температура и давление.
Рассчитаем,
какой объем занимает 1 кмоль воздуха
(как и любого другого газообразного
вещества) при данных температуре и
давлении.
м3/кмоль
Записываем
данную величину под формулой воздуха,
умножив ее
на стехиометрический коэффициент
(64,76).
5. По уравнению
реакции найдем теоретический объем
воздуха, необходимый для полного сгорания
эфира:
Vвтеор
=
7,5
м3
|
Расчет |
Пример |
1.
Записываем уравнение реакции горения
50
кг х
м3
СН3СОСН3
+ 4(О2
+ 3,76N2)
= 3СО2
+ 3Н2О
+43,76N2
М
= 58 кг 44,76
Vм
=
=44,7625,9
м3
2.
Рассчитаем, какой объем занимает 1 кмоль
воздуха (как и любого другого газообразного
вещества) при данных температуре и
давлении.
м3/кмоль
3.
По уравнению реакции найдем теоретический
объем воздуха, необходимый для полного
сгорания эфира:
Vвтеор
=
м3
4.
По условию задачи коэффициент избытка
воздуха
= 1,2.
С
учетом этого определим практический
объем воздуха, необходимый для горения:
Vвпр
= Vвтеор
= 425,1
1,2 = 510,1 м3.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Калькулятор позволяет рассчитать необходимый объем кислорода (О2) и воздуха при сжигании природного газа:
-
- приведенный к нормальным условиям (по стехиометрическим уравнениям);
- приведенный к рабочим условиям (исходя из температуры воздуха).
Калькулятор объема воздуха необходимого для сжигания газа
Общие данные
Теоретический объем воздуха на сжигание природного газа зависит от его химического состава. Химический состав газа для сетей газораспределения определяется согласно данным газораспределительных организации (обычно паспорта на газ размещены на официальных сайтах этих организаций).
Объем кислорода необходимого для сжигании природного газа (алканов, парафинов, также насыщенных углеводородов) определяется согласно химическим уравнениями:
-
-
-
-
- CH4+2O2=>CO2+2H2O;
- C2H6+3.5O2=>2CO2+3H2O;
- C3H8+5O2=>3CO2+4H2O;
- и т.д,
-
-
-
где красным (стехиометрические коэффициенты) выделено количество молекул кислорода необходимых для сжигании 1 молекулы природного газа. Так как согласно закону Авогадро в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул, то это соотношение верно и к объема веществ в уравнениях.
В составе воздуха кислород занимает 21 % объема. Исходя из этого условия определяется количество необходимого воздуха для горения.
Калькулятор рассчитывает рабочий объем воздуха на горений при рабочей температуре. Часто на практике для повышения КПД теплогенерирующих установках (больших мощностей) предварительно подогревают дутьевой воздух.
Коэффициент избытка воздуха в калькуляторе по умолчанию принят равным 1.05. Коэффициент избытка воздуха — это отношение фактически подаваемого количества воздуха к теоретически необходимому. Избыток воздуха необходим для исключения неполноты сгорания топлива. Коэффициент избытка воздуха зависит от конструкции газовой горелки и топки теплогенерирующего устройства: чем они совершеннее, тем ближе коэффициент к 1. При эксплуатации (в процессе пуско-наладочных работ) необходимо следить, чтобы коэффициент избытка воздуха не был меньше 1, так как это приводит к неполному сгоранию газа. Увеличение коэффициента избытка воздуха ведет к снижению к.п.д. теплогенерирующего устройства.
Более подробно методика расчет состава дымовых газов в зависимости от вида и состав топлива приведена в нормативном методе «ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД)».
Литература
-
- ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД). Издание третье, переработанное и дополненное, Санкт-Петербург, 1998 г.
Примечание.
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
Ирина С.6,1 K
Книги, звери и еда – это хобби навсегда. · 19 янв 2019
Уравнение горения метана:
CH4+2*O2->CO2+2*H2O
Из уравнения видно, что объем кислорода равен удвоенному объему метана
V(O2)=2*V(CH4)=2*250=500 м^3
Поскольку процентное содержание кислорода в воздухе составляет 21%, то требуемый объем воздуха V(возд) = V(O2)/0.21=500/0.21=2381 м^3.
16,3 K
Петр Кривенко
20 декабря 2020
спасибо!
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос