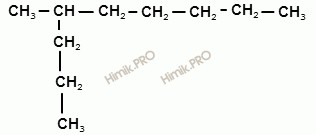
Примеры
Пример 1. определить
теоретическую массу и объём воздуха,
необходимого для сгорания 1 м3
метана при нормальных условиях.
Решение.
Горючее вещество
является индивидуальным химическим
соединением, поэтому для расчёта его
объёма надо пользоваться формулой
(1.1.3,а), запишем уравнение химической
реакции горения СН4
в воздухе
.
Из уравнения
находим
тогда
м3/м3
или кмоль/кмоль
По формуле (1.1.15) с
учётом уравнения (1.1.16) рассчитаем массу
воздуха
кг/м3.
Пример 2. Определить
теоретический объём воздуха, необходимого
для горения 1 кг бензола.
Решение.
Горючее –
индивидуальное химическое соединение,
поэтому для расчёта по формуле (1.1.3,б)
запишем уравнение химической реакции
горения
найдём
.
Молекулярная масса
бензола
.
Объём 1 кмоля газа
при нормальных условиях составляет
22,4 м3
м3/кг.
Пример 3. Определить
объём и массу воздуха, необходимого для
горения 1 кг органической массы состава
С – 60%, Н – 5%, О – 25%, N
– 5%, W
– 5%(влажность), если коэффициент избытка
воздуха
;
температура воздуха 305 К, давление 99500
Па.
Решение.
Так как горючее
вещество сложного состава, то теоретическое
количество воздуха при нормальных
условиях определим по формуле (1.1.4)
м3/кг.
Из формулы (1.1.7)
рассчитаем практическое количество
воздуха при нормальных условиях
м3/кг.
Находи количество
воздуха, пошедшего на горение веществ
при заданных условиях горения. Используя
формулу (1.1.6), получим
м3/кг,
кг/кг.
Пример 4. Определить
объём воздуха, необходимого для горения
5 м смеси газов, состоящих из 20% – СН4;
40% – С2Н2;
10% – СО; 5% – N2
и 25% – O2,
если коэффициент избытка воздуха 1,8.
Решение.
Горючее-смесь
газов, поэтому для расчёта объёма
воздуха, пошедшего на горение, воспользуемся
формулой (1.1.5). Для определения
стехиометрических коэффициентов при
кислороде
запишем уравнение реакций горения
горючих компонентов в кислороде
тогда
м3/м3.
Для горения 5 м3
газовой смеси необходимый теоретический
объём воздуха составит
м3.
Практическое количество воздуха:
м3.
Пример 5. Определить
коэффициент избытка воздуха при горении
уксусной кислоты, если на горение 1 кг
поступило 3 м3
воздуха.
Решение.
Для определения
коэффициента избытка воздуха по формуле
(1.1.7) необходимо рассчитать его
теоретическое количество. Молекулярная
масса уксусной кислоты 60.
м3/кг.
Тогда коэффициент
избытка воздуха по формуле (1.1.7) равен
Горение протекало
при недостатке воздуха.
Пример 6. Определить
объём воздуха, пошедшего на окисление
1 м3
аммиака, если в продуктах горения
содержание кислорода составило 18%.
Решение. Определяем
теоретическое количество воздуха,
необходимого для горения 1 м3
аммиака:
тогда
м3/м3.
Для определения
коэффициента избытка воздуха необходимо
рассчитать теоретическое количество
продуктов горения 1 м3
аммиака
м3/м3.
Коэффициент
избытка воздуха
Объём воздуха,
участвующего в процессе горения 1 м3
аммиака, определим из формулы (1.1.7)
м3/м3.
Пример 7. Определить
объём окислительной среды, состоящей
из 60% О2
и 40% N2,
необходимый для горения 1 кг изоприлового
спирта, если её температура равна 295 К,
давление 62,0 кПа.
Решение.
Так как окислительная
среда отличается по составу от воздуха,
определим по формуле (1.1.1) объёмное
соотношение кислорода и азота 40:60=0,67.
Уравнение реакции
горения изоприлового спирта
Теоретический
объём окислительной среды при нормальных
условиях рассчитаем по формуле (1.1.3,б).
Молекулярная масса горючего равна 60,
м3/кг.
Объём окислительной
среды при заданных условиях горения
определим из формулы (1.1.6)
м3/кг.
Пример 8. Определить
массу динитротолуола, сгоревшего в
герметичном объёме 100м3,
если содержание кислорода в продуктах
горения составило 12%.
Решение.
Так как в продуктах
горения содержится кислород, то горение
протекало в избытке воздуха, коэффициент
избытка определим по формуле(1.1.10).
.
Молекулярная масса
горючего равна 183. Теоретический объём
воздуха
м3/кг.
Теоретический
объём продуктов горения (формула 1.1.15)
м3/кг,
.
Практический объём
воздуха, пошедший на горение
м3/кг.
Тогда массу
сгоревшего динитротолуола Мг
определим из соотношения
м3–
полный объём помещения
кг.
Задание на
самостоятельную работу
Задача 1: Рассчитать
теоретически необходимое количество
воздуха для сгорания m кг вещества при
Т= … и Р= … . (жидкость)
|
Вариант |
Вещество |
m, |
Т,оС |
Р, |
|
1 |
Амилбензол |
3 |
-20 |
780 |
|
2 |
Н-Амиловый |
5 |
20 |
760 |
|
3 |
Анизол |
7 |
-15 |
778 |
|
4 |
Анилин |
15 |
15 |
762 |
|
5 |
Бутилацетат |
20 |
-10 |
776 |
|
6 |
Бутиловый |
10 |
10 |
764 |
|
7 |
Бензол |
2 |
-5 |
774 |
|
8 |
Диэтиловый |
4 |
5 |
768 |
|
9 |
Ксилол |
6 |
-18 |
772 |
|
10 |
Уайт-спирит |
8 |
18 |
770 |
|
11 |
Этиленгликоль |
9 |
-16 |
740 |
|
12 |
Трет-Амиловый |
11 |
16 |
758 |
|
13 |
Гексан |
12 |
-14 |
742 |
|
14 |
Метиловый |
13 |
14 |
756 |
|
15 |
Толуол |
14 |
-12 |
744 |
|
16 |
Стирол |
16 |
12 |
754 |
|
17 |
Пентан |
19 |
-8 |
746 |
|
18 |
Этанол |
17 |
8 |
752 |
|
19 |
Амилметилкетон |
18 |
-6 |
748 |
|
20 |
Бутилбензол |
22 |
6 |
750 |
|
21 |
Бутилвиниловый |
24 |
-4 |
769 |
|
22 |
Ацетон |
1 |
4 |
779 |
|
23 |
Этиловый |
21 |
-2 |
749 |
|
24 |
Гептан |
25 |
2 |
761 |
|
25 |
Октан |
28 |
-25 |
765 |
|
26 |
Гексан |
1,5 |
19 |
759 |
|
27 |
Бутиловый |
8 |
-6 |
757 |
|
28 |
Анилин |
4,6 |
21 |
769 |
|
29 |
Бензол |
9 |
-11 |
770 |
|
30 |
Ксилол |
2 |
13 |
754 |
Задача 2: Рассчитать
теоретически необходимое количество
воздуха для сгорания V м3горючего
газа
|
Вариант |
Горючий |
V, |
|
1 |
Ацетилен |
25 |
|
2 |
Метан |
5 |
|
3 |
Окись |
15 |
|
4 |
Этан |
7 |
|
5 |
Водород |
10 |
|
6 |
Пропан |
8 |
|
7 |
Сероводород |
3 |
|
8 |
Бутан |
27 |
|
9 |
Ацетилен |
4 |
|
10 |
Метан |
26 |
|
11 |
Окись |
6 |
|
12 |
Этан |
24 |
|
13 |
Водород |
9 |
|
14 |
Пропан |
23 |
|
15 |
Сероводород |
11 |
|
16 |
Бутан |
22 |
|
17 |
Метан |
12 |
|
18 |
Этан |
21 |
|
19 |
Пропан |
13 |
|
20 |
Бутан |
20 |
|
21 |
Окись |
10 |
|
22 |
Ацетилен |
30 |
|
23 |
Водород |
14 |
|
24 |
Метан |
16 |
|
25 |
Ацетилен |
3 |
|
26 |
Метан |
6 |
|
27 |
Окись |
4 |
|
28 |
Этан |
5 |
|
29 |
Водород |
2 |
|
30 |
Пропан |
1,5 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Какой объем воздуха на сгорание
Какой объем воздуха на сгорание , содержащего 21% кислорода (O2), затрачивается на сгорание 40 грамм 2-пропилгептана (C10H22)?
Решение задачи
Запишем реакцию горения 2-пропилгептана (C10H22):
Учитывая, что молярная масса 2-пропилгептана (C10H22) равна 142 г/моль (смотри таблицу Менделеева), найдем химическое количество 2-пропилгептана (C10H22) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (C10H22) = 40 /142 = 0,28 (моль).
По уравнению реакции найдем химическое количество кислорода (O2), который участвует в реакции:
на сгорание 0,28 моль C10H22 образуется х моль O2
на сгорание 2 моль C10H22 образуется 31 моль O2
Откуда:
Найдем объем кислорода (O2), по формуле, устанавливающей связь между объемом и количеством вещества:
Получаем:
V (O2) = 4,34 ⋅ 22,4 = 97,22 (л).
Напомню, объемной долей газа в смеси газов называется число, показывающее какую часть составляет объем данного газа от общего объема смеси, принятого за единицу или 100%. Обозначается греческой буквой фи (φ).
Найдем, объем воздуха по формуле:
Получаем:
V (воздуха) = 97,22 ⋅ 100% / 21% = 462,93 (л).
Ответ:
объем воздуха равен 462,93 литра.
Калькулятор позволяет рассчитать необходимый объем кислорода (О2) и воздуха при сжигании жидкого и твердого топлива.
Калькулятор объема кислорода (О2) и воздуха необходимого при сжигании жидкого и твердого топлива
Общие данные
Объем углекислого газа образующегося при сжигании жидкого и твердого топлива определяется согласно химическим уравнениям:
-
-
-
- C+1O2=>CO2;
- H+0.25O2=>0.5HO2;
- S+1O2=>SO2;
-
-
где красным (стехиометрические коэффициенты) выделено количество молекул кислорода необходимых для сжигания 1 молекулы топлива. Так как согласно закону Авогадро в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул, то это соотношение верно и к объема веществ в уравнениях. То есть при сжигании 1 молекулы топлива (углерода С) необходима 1 молекула кислорода (O2). Молярная масса углерода (С) равна 12г/моль, то есть 1 моль вещества весит 12 грам. В результате при сжигании 12 грамм углерода (С) необходим кислород в объеме 22,4 л. На основании этого можно рассчитать, что при сжигании 1 грамма углерода необходимо 22,4/12 л кислорода или при сжигании 1 кг углерода необходимо 22,4/12 м3 кислорода (O2).
Для остальных горючих компонентов жидкого и твердого топлива количество кислорода необходимого для горения определяется аналогично, то есть получается для сжигания 1 кг:
-
-
- водорода (H) необходимо (0,25*22.4)/1 м3 кислорода (O2);
- серы (S) необходимо (1*22.4)/32 м3 кислорода (O2).
-
Кислород, входящий в состав топлива, участвует в горении. Поэтому его вычитают из необходимого объема кислорода на горение.
В составе воздуха кислород занимает 21 % объема. Исходя из этого условия определяется количество необходимого воздуха для горения.
Более подробно методика расчет состава дымовых газов в зависимости от вида и состав топлива приведена в нормативном методе «ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД)».
Литература
-
- ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД). Издание третье, переработанное и дополненное, Санкт-Петербург, 1998 г.
Примечание.
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой: