Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму.

Вам понадобится
- – таблица Менделеева;
- – ручка;
- – бумага для записей.
Инструкция
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
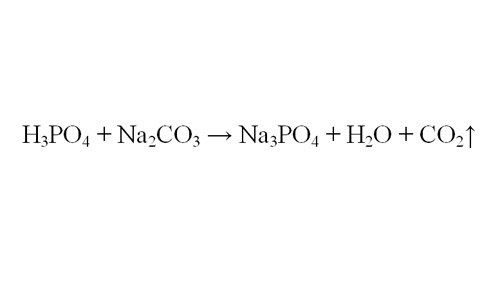
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
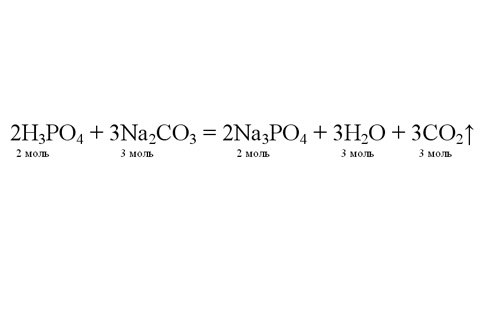
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условии не дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса H3PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л. Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент H3PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму. Вам понадобится
Вам понадобится
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условиине дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса H3PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л.Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент H3PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Как подсчитать объем выделившегося газа, зная массы взаимодействующих жидкостей?
Ученик
(121),
закрыт
4 года назад
Я надыбыл макароны)
Гуру
(2888)
12 лет назад
для каждой жидкости необходимо подсчитать количество вещества, вступившего в реакцию (т. е. сколько моль вещества = n):
m/M=n
m-масса жидкости, г
M-молярная масса, г/моль.
Дальше посмотреть, у какой жидкости меньше n. Если меньше n у первой жидкости, то
m1/M1=V(газа) /Vm
Vm-молярный объем газа при н. у. =22,4 моль/л.
Таким образом, V(газа) =Vm*m1/M1=22,4*m1/M1
Ответ в литрах
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):

В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:

Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:

На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:

и, наоборот, химическое количество по массе:

а также число структурных единиц:

Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:

Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.

Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.

б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):

Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:

Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».
Теги
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
Определение объема выделившегося газа в реакции, если одно вещество взято в избытке
Определение избытка-недостатка
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
масса алюминия: m(А1) = 8 г;
масса соляной кислоты: mр-ра(НС1) = 200 г;
массовая доля хлороводорода в соляной кислоте: (НС1) = 8% .
Найти:
объем выделившегося газа;
массу раствора после реакции.
Решение:
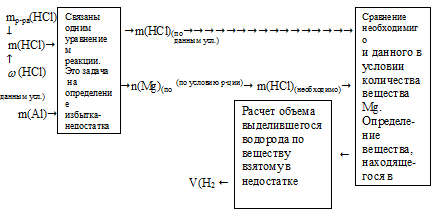
2А1 + 6НС1 – 2А1С13 + ЗН2↑
Сначала необходимо определить, какое вещество будет в недостатке. По нему можно рассчитать объем выделившегося водорода. Алгоритм вычисления массы конечного раствора
зависит от того, какое вещество окажется в избытке, поэтому отразить эту часть решения заранее невозможно. Алгоритм вычисления массы конечного раствора зависит от того, какое
вещество окажется в избытке. В большинстве задач на определение избытка-недостатка при растворении металла в растворе в недостатке оказывается именно металл. В этом случае
масса конечного раствора определяется очень просто:
mкон. р-ра = т(Ме) + mисх. р-ра – mгаза.
Если же металл окажется в избытке, то его излишек не будет входить в состав конечного раствора, а опустится на дно сосуда.
Поэтому отразить весь алгоритм решения заранее невозможно.
Схематично алгоритм первой части решения будет иметь вид:
1. Определяем массу НС1 в 200 г 8% -ного исходного раствора.
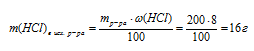
2. Определяем количество веществ НС1 и А1.
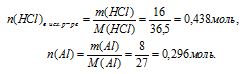
3. Выберем за основу алюминий, и определим по уравнению реакции количество вещества НС1, которое необходимо для полного растворения всего (0,296 моль) алюминия.
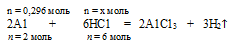
Составляем пропорцию:
на 0,296 моль А1 должно расходоваться х моль НС1 (по условию)
на 2 моль А1 полностью расходуется 6 моль НС1 (но уравнению)
 НС1 должно расходоваться на 0,296 моль А1.
НС1 должно расходоваться на 0,296 моль А1.
4 .Определим, какое вещество дано в недостатке.
Таблица
n(НС1) необходимо
n(НС1) дано по условию
0,888моль > 0,438 моль
В реакции участвует меньше НС1, чем необходимо для полного растворения А1, следовательно, НС1 дано в недостатке. В процессе реакции НС1 израсходуется полностью, а А1 расходуется не весь и часть его останется после реакции.
5. Рассчитаем по уравнению реакции объем (н.у.) выделившегося водорода. Для расчета используем НС1, т.к. это вещество взято в недостатке.
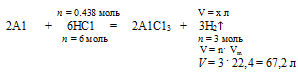
Составляем пропорцию:
0,438 моль НС1 дают х л Н2 (по условию)
6 моль НС1 дают 67,2 л Н2 (по уравнению)
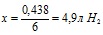 выделится в процессе реакции.
выделится в процессе реакции.
6. Определим массу выделившегося Н2 по алгоритму:
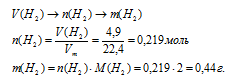
7. Определяем массу раствора после реакции.
mкон. р-ра = m(HCl)р-ра + m(Al)растворившегося – m(H2)выделившегося
При определении массы конечного раствора нужно учитывать, что алюминий находился в избытке, и часть его осталась после реакции в неизменном виде. Не прореагировавший алюминий, очевидно, не входит в состав раствора и будет находиться на дне. Поэтому нам придется определить массу растворившегося А1. Это можно сделать по уравнению реакции, используя данные по НС1.
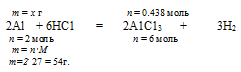
Составляем пропорцию:
х т А1 растворяются в 0,438 моль НС1 (по условию)
54 г А1 растворяются в 6 моль НС1 (по уравнению)
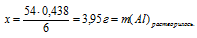
Теперь возможно определить массу конечного раствора:
mкон. р-ра = 200 + 3,95 – 0,44 = 203,51 г.
Ответ: объем выделившегося водорода — 4,9 л; масса конечного раствора 203,51 г.
Определение объема образовавшегося углекислого газа
Задача 7.
Определите объем выделившегося газа при взаимодействии 20,0 г карбоната кальция с избытком азотной кислоты.
Решение:
Несмотря на то, что в условии говориться об избытке азотной кислоты, данная задача не относится к типу «на определение избытка-недостатка». В условии указана масса только одного из участников реакции (СаСО3). Указание на избыток другого участника (НNO3) показывает, что карбонат кальция расходуется полностью и объем выделившегося газа необходимо считать именно по СаСО3.
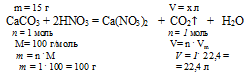
Определим объем образовавшегося углекислого газа из пропорции:
20 г А1 дают х л СО2 (по условию)
100 г А1 дают 22,4 л СО2 (по уравнению)
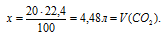
Ответ: V(CO2) = 4,
Задачи на избыток-недостаток:
1. Определение избытка-недостатка
2 . Алгоритм определения избытка-недостатка
