Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на аноде, при электролизе раствора соли нитрата серебра (AgNO3), если время электролиза 20 минут, а сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический (Ag)?
Решение задачи
Электролиз раствора соли нитрата серебра (AgNO3):
(-) К: Ag+, H2O.
(+) А: NO3— , H2O.
Катионы металла (Ag+), имеющие большое значение ϕ0 при электролизе полностью восстанавливаются. Следовательно:
(-) К: Ag+ + e—= Ag0;
(+) A: 2H2O — 4e— = O2↑+4H+
Анион NO3— неокисляем. Суммарное уравнение электролиза раствора соли нитрата серебра (AgNO3):
![]()
Итак, в ходе электролиза раствора соли нитрата серебра на инертных электродах будут выделяться серебро (на катоде) и кислород (на аноде).
Найдем массу серебра, полученного на катоде согласно закону Фарадея. Закон Фарадея выражается следующей формулой:
![]()
Где:
m — масса образовавшегося на электродах или подвергшегося превращению вещества, г;
Мэ — его эквивалентная масса, г/ моль;
I — сила тока, А (ампер);
t — время, с;
F — число Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Учитывая, что эквивалентная масса серебра (Ag+) равна 108 г/моль (смотри таблицу Менделеева), следовательно, его эквивалентная масса равна 108 г/моль, получаем:
m (Ag) = 108 ⋅ 2 ⋅ 1200 /96500 = 2,69 (г).
II закон Фарадея. При прохождении одинакового количества электричества через растворы (расплавы) различных электролитов массы (объемы) выделяющихся веществ пропорциональны их эквивалентным массам (объемам).
Получаем:
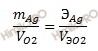
Откуда:
![]()
Так как масса серебра равна 2,69 г; Vэ(O2) = 5,6 л/моль; Э (Ag) = M (Ag) / n = 108 /1 = 108 г/моль (n -количество электронов, принимающих участие в анодном процессе).
V (O2) = 2,69 ⋅ 5,6 /108 = 0,14 (л)
Ответ:
масса серебра 2,69 грамма,
объем кислорода 0,14 литра.
При замене инертного анода на серебряный, на аноде становится возможным протекание еще одного окислительного процесса — растворение серебра, из которого сделан анод:
(+) А: Ag0 — e—= Ag+
Этот процесс характеризуется более низким значение потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе раствора соли нитрата серебра (AgNO3) с серебряным анодом на аноде происходит реакция окисления серебра (Ag), а в анодном пространстве будет накапливаться AgNO3.
Суммарная электродная реакция выразится уравнением в ионном виде:
Ag0 + Ag+ = Ag+ + Ag0
Так как ионы сокращаются, то составить молекулярное уравнение электролиза раствора соли нитрата серебра (AgNO3) невозможно. Это означает, что электролиз раствора соли нитрата серебра (AgNO3) с анодом из серебра (Ag) сводится к переносу серебра с анода на катод.
Найди верный ответ на вопрос ✅ «какой объем займет, выделившийся на аноде газ (н. у.) при электролизе 39 г 15% раствора хлорида калия? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » какой объем займет, выделившийся на аноде газ (н. у.) при электролизе 39 г 15% раствора хлорида калия?
Пример расчета количества выделившихся веществ при электролизе
Сколько кислорода
и водорода выделится при электролизе
серной кислоты в течение 15 минут, если
сила тока равна 2,5 А?
(C-графит)
К(-) 2Н+
+SO42-
(+) A(C-графит)
Н+2О-2
|
Катодный |
Анодный |
|
2Н++2еН2, побочных mн2 mн2 Согласно Vн2 |
2Н2О-2-4е побочных mо2= mо2 Согласно Vо2 |
Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
Задание №1.
Рассмотрите электролиз водного раствора
соли:
1. Указать электроды.
2. Записать вещества,
подвергающиеся электролизу с точки
зрения теории электролитической
диссоциации.
3. Написать все
возможные процессы на катоде и аноде с
указанием стандартных и равновесных
потенциалов (по уравнению Нернста).
4. Определить какой
процесс протекает в первую очередь.
Почему?
5. Написать суммарное
уравнение электролиза.
Варианты заданий
|
№ варианта |
Состав |
рН |
|
1. |
0,1 |
рН=4, |
|
2. |
0,1 |
рН=6,2, |
|
3. |
1 |
рН=5, |
|
4. |
0,1 |
рН=5, |
|
5. |
1 |
рН=8, |
|
6. |
0,1 |
рН=7, |
|
7. |
0,01 |
рН=6, |
|
8. |
1 |
рН=5, |
|
9. |
0,1 |
рН=5, |
|
10. |
0,01 |
рН=6,2, |
|
11. |
1 |
рН=2, |
|
12. |
0,01 |
рН=6, |
|
13. |
1 |
рН=5, |
|
14. |
0,01 |
рН=2, |
|
15. |
0,01 |
рН=6, |
|
16. |
0,1 |
рН=4, |
|
17. |
1 |
рН=14, |
|
18. |
0,1 |
рН=7, |
|
19. |
1 |
рН=5, |
|
20. |
0,5 |
рН=4, |
|
21. |
0,5 |
рН=1, |
|
22. |
0,01 |
рН=12, |
|
23. |
1 |
рН=7, |
|
24. |
0,1 |
рН=7, |
|
25. |
1 |
рН=4, |
Задание №2.
Сколько граммов
металла…. выделится на катоде, если
через раствор соли… пропустить ток
силой (I)…в
течение ()
…. Выход Ме ()
принять за…..
|
№ варианта |
Металл |
Соль |
I, A |
, |
Ме, |
|
1. |
Cu |
CuSO4 |
0,5 |
120 |
100 |
|
2. |
Zn |
ZnCl2 |
0,6 |
100 |
65 |
|
3. |
Ni |
NiSO4 |
0,8 |
80 |
85 |
|
4. |
Cr |
Cr2(SO4)3 |
1,2 |
80 |
50 |
|
5. |
Sn |
SnSO4 |
0,5 |
60 |
95 |
|
6. |
Ag |
AgNO3 |
0,5 |
60 |
100 |
|
7. |
Au |
Au(NO3)3 |
0,2 |
90 |
100 |
|
8. |
Cd |
CdSO4 |
0,6 |
90 |
65 |
|
9. |
Mn |
MnSO4 |
0,4 |
60 |
40 |
|
10. |
Pt |
PtCl2 |
0,6 |
100 |
100 |
Через раствор….
пропускали ток (I)…
в течение ()….
Вычислить объем газа (при н.у.),
выделившегося на аноде (Pt).
Выход вещества на аноде принять за 100%.
|
№ варианта |
раствор |
I, |
, |
|
11. |
HCl |
1,2 |
30 |
|
12. |
K2SO4 |
0,8 |
60 |
|
13. |
H2SO4 |
0,6 |
90 |
|
14. |
AlCl3 |
1,5 |
30 |
|
15. |
KNO3 |
0,8 |
20 |
|
16. |
NaF |
0,4 |
20 |
|
17. |
H2O |
1 |
60 |
|
18. |
KCl |
0,2 |
120 |
|
19. |
KOH |
1,4 |
80 |
|
20. |
NaCl |
0,5 |
90 |
|
21. |
Al2(SO4)3 |
0,6 |
5 |
|
22. |
H2O |
0,9 |
30 |
|
23. |
H2SO4 |
1,0 |
45 |
|
24. |
NaCl |
0,6 |
20 |
|
25. |
BaCl2 |
1,2 |
10 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Получи верный ответ на вопрос 🏆 «При электролизе водного раствора хлорида натрия на аноде выделился газ, объем 5,6 л (при н. у). определите объем выделившегося газа на …» по предмету 📕 Химия, используя встроенную систему поиска. Наша обширная база готовых ответов поможет тебе получить необходимые сведения!
Найти готовые ответы
Главная » Химия » При электролизе водного раствора хлорида натрия на аноде выделился газ, объем 5,6 л (при н. у). определите объем выделившегося газа на катоде и масса образовавшейся щелочи в растворе
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13/2006
Электролиз
План
 1.
1.
Определение сущности процесса электролиза.
2. Правила для определения результатов
электролиза:
а) процессы на катоде;
б) процессы на аноде.
3. Закон Фарадея.
4. Области использования электролиза.
Движение ионов в растворе или расплаве
электролита является хаотическим,
беспорядочным. Но если в раствор или расплав
электролита опустить электроды и пропустить
постоянный электрический ток, то ионы будут
двигаться упорядоченно к электродам: катионы – к
катоду, анионы – к аноду. На катоде идет процесс
восстановления, катионы принимают электроны. На
аноде идет процесс окисления, анионы отдают
электроны. Это явление называется электролизом.
Электролиз – это
окислительно-восстановительный процесс,
протекающий на электродах в растворах или
расплавах электролитов при пропускании
электрического тока. Сущность электролиза
заключается в том, что за счет электрической
энергии осуществляется химическая реакция,
которая не может протекать самопроизвольно.
Для определения результатов электролиза
существует ряд правил.
П р о ц е с с ы н а к а т о д е
(восстановление).
• В расплавах катионы металла
восстанавливаются до свободного металла:
Мn+ + nе = М0.
• В растворах процесс на катоде н е з а в
и с и т от материала катода, а зависит от
активности восстанавливаемого металла.
а) Если металл расположен в ряду напряжений от Li
до Al включительно, то на катоде идет процесс
восстановления воды:
2Н2О + 2e = H20![]() + 2OH–.
+ 2OH–.
б) Если металл расположен в ряду напряжений
между Al и H2, то на катоде идут одновременно
процессы восстановления воды и катионов металла:
2Н2О + 2e = H20![]() + 2OH–,
+ 2OH–,
Мn+ + nе ![]() М0.
М0.
в) Если металл расположен в ряду напряжений
после Н2, то на катоде идет процесс
восстановления катионов металла:
Мn+ + nе = М0.
При электролизе растворов кислот идет процесс
восстановления ионов водорода:
2Н+ + 2е = H20![]() .
.
П р о ц е с с ы н а а н о д е (окисление).
• В расплавах анионы бескислородных кислот
(кроме фторидов) окисляются до соответствующего
простого вещества, например:
2Cl– – 2е = Cl20![]() .
.
Кислородсодержащие анионы выделяют кислород и
превращаются в один из оксидов:
SO42– – 2e = SO20![]() + O20
+ O20![]() .
.
• В растворах процесс на аноде зависит от
материала анода и от природы аниона. Аноды могут
быть двух видов – растворимые (железо, медь, цинк,
серебро и все металлы, которые окисляются в
процессе электролиза) и нерастворимые, или
инертные (уголь, графит, платина, золото).
а) Если анод растворимый, то независимо от
природы аниона всегда идет окисление металла
анода, например:
Cu0 – 2e = Cu2+.
б) Если анод инертный, то в случае
бескислородных анионов (кроме фторидов) идет
окисление анионов:
2Cl– – 2е = Cl20![]() .
.
В случае кислородсодержащих анионов и фторидов
идет процесс окисления воды, анион при этом не
окисляется и остается в растворе:
2H2O – 4e = O20![]() + 4H+.
+ 4H+.
При электролизе растворов щелочей идет
окисление гидроксид-ионов:
4OH– – 4e = O20![]() + 2H2O.
+ 2H2O.
Количественная характеристика процессов
электролиза определяется з а к о н о м Ф а р а д
е я: масса электролита, подвергшегося
превращению при электролизе, а также массы
образующихся на электродах веществ прямо
пропорциональны количеству электричества,
прошедшего через раствор или расплав
электролита, и эквивалентным массам
соответствующих веществ.
Закон электролиза в математической форме:
m = ![]()
где Э – эквивалент вещества (г/моль), I –
сила тока (А), t – продолжительность процесса
электролиза (с), F – постоянная Фарадея (F =
96 500 Кл/моль).
Электролиз широко используют в промышленности
для выделения и очистки металлов, получения
щелочей, хлора, водорода. Алюминий, магний,
натрий, кадмий получают только электролизом.
Важной областью применения электролиза является
защита металлов от коррозии. При этом на
поверхности металлических изделий
электрохимическим методом наносят тонкий слой
другого металла, устойчивого к коррозии.
Тест по теме “Электролиз”
 1.
1.
При электролизе раствора сульфата цинка с
инертными электродами на аноде выделяется:
а) цинк; б) кислород;
в) водород; г) сера.
2. Объем кислорода (в л, н.у.), выделившегося
на инертном аноде при пропускании
электрического тока силой 20 А в течение 2,5 ч через
раствор сульфата калия, равен:
а) 10,4; б) 11,2; в) 6,8; г) 20,6.
3. При электролизе 240 г 15%-го раствора
гидроксида натрия на аноде выделилось 89,6 л (н.у.)
кислорода. Массовая доля вещества в растворе
после окончания электролиза равна (в %):
а) 28,1; б) 32,1; в) 37,5; г) 40,5.
4. При электролизе раствора хлорида натрия
образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
5. При электролизе расплава гидроксида
натрия на аноде выделяется:
а) натрий; б) водород; в) кислород; г) вода.
6. При электролизе раствора хлорида кальция
на катоде выделилось 5,6 г водорода. Какова масса
(в г) вещества, выделившегося на аноде?
а) 198,8; б) 99,4; в) 89,6; г) 44,8.
7. Медный купорос массой 100 г растворили в
воде и провели электролиз до обесцвечивания
раствора. Объем (в л, н.у.) собранного газа равен:
а) 2,24; б) 4,48; в) 11,2; г) 22,4.
8. Платиновый электрод:
а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
9. Процесс на катоде при электролизе
растворов солей зависит от:
а) природы катода;
б) активности металла;
в) состава аниона;
г) не зависит от перечисленных факторов.
10. При электролизе раствора нитрата меди(II)
с медными электродами на аноде будет
происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | а | в | б | в, г | а | б | а, г | б |
в |
Задачи на электролиз
Уровень А
 1.
1.
При электролизе раствора хлорида меди(II) на аноде
выделилось 560 мл газа (н.у.). Найти массу меди,
выделившейся на катоде.
Ответ. 1,6 г.
2. При электролизе расплава хлорида натрия
массой 70,2 г получен хлор, занимающий при н.у.
объем 10,08 л. Найти долю выхода хлора.
Ответ. 75%.
3. При электролизе 149 г 20%-го раствора хлорида
калия получен гидроксид калия массой 20,16 г. Найти
долю выхода продукта реакции.
Решение

Ответ. 90%.
4. При электролизе водного раствора хлорида
калия выделилось 7,2 л водорода (н.у.). Найти массу и
количество вещества гидроксида калия,
образовавшегося в результате электролиза.
Ответ. 36 г и 0,64 моль.
5. Какие вещества и в каких количествах
образуются при электролизе 234 г расплава хлорида
натрия? Какая масса железа может вступить в
реакцию с веществом, выделившимся на аноде?
Ответ. 4 моль Na и 2 моль Cl2; 74,7 г
Fe.
6. Ток одной и той же силы пропущен в течение
одинакового времени через растворы нитрата
серебра и сульфата меди. В результате выделилось
0,64 г меди. Найти массу выделившегося серебра.
Ответ. 2,16 г.
7. При электролизе раствора, содержащего 2,22
г соли двухвалентного металла, на аноде
выделилось 0,448 л хлора (н.у.). Определить, какая
соль была подвергнута электролизу. Написать
уравнение реакции электролиза.
Ответ. Хлорид кальция.
![]()
8. Ток силой 6 А пропустили через водный
раствор серной кислоты в течение 1,5 ч. Вычислить
массу разложившейся воды и объем выделившихся
газов (н.у.).
Ответ. 3,02 г Н2О; 3,76 л Н2 и
1,88 л О2.
9. Сколько времени потребуется для
разложения 2 моль воды током силой 2 А?
Ответ. 53,6 ч.
10. Найти объем кислорода (н.у.), который
выделится при пропускании тока силой 6 А в
течение 30 мин через водный раствор гидроксида
калия.
Ответ. 627 мл.
11. При электролизе водного раствора
сульфата хрома(III) током силой 2 А масса катода
увеличилась на 8 г. В течение какого времени
проводили электролиз?
Ответ. 6,18 ч.
12. Через расплав оксида алюминия пропускали
постоянный ток силой 16 А в течение 3 ч. Вычислить
массу алюминия, выделившегося на катоде.
Ответ. 16,1 г.
Уровень Б
1. При пропускании тока силой 2,5 А через
раствор электролита за 30 мин выделилось 2,77 г
металла. Определить металл.
Ответ. Олово.
2. При пропускании через раствор соли
некоторого металла тока силой 1,5 А в течение 30 мин
на катоде выделилось 1,071 г металла. Определить
металл.
Ответ. Индий.
3. Через 300 г 10%-го раствора хлорида натрия
пропустили ток. Спустя некоторое время ток
выключили. Объем газа, выделившегося на аноде,
при давлении 1 атм и температуре 27 °С равен
1 л. Найти массовые доли веществ, находящихся в
растворе после выключения тока, если доля выхода
продуктов электролиза составляет 91% от
теоретически возможного.
Ответ. 8,36% NaCl и 1,2% NaOH.
4. Газ, выделившийся на аноде при
электролизе 200 г 20%-го раствора хлорида натрия,
пропустили через 400 г 30%-го раствора бромида
калия. К полученному раствору добавили избыток
раствора нитрата серебра. Определить
количественный состав выпавшего осадка.
Ответ. 59,4 г AgBr и 98,15 г AgCl.
5. Через 800 г 10%-го водного раствора хлорида
натрия пропустили ток. После окончания процесса
электролиза соли весь выделившийся на аноде газ
поглотили горячим раствором, получившимся в
результате электролиза. Найти массовые доли
веществ, содержащихся в растворе после
поглощения газа.
Ответ. 8,35% NaCl и 3,03% NaClO3.
6. Через 50 г 10%-го раствора сульфата натрия
некоторое время пропускали ток. Когда процесс
прервали, объем выделившегося на аноде газа
составил 10 л (давление 1 атм, температура 20 °С).
Найти массовую долю сульфата натрия в растворе
после прекращения электролиза.
Ответ. 14,28%.
7. Некоторое количество нитрида натрия
обработали избытком воды и получили газ А.
Оставшееся в растворе вещество выделили и при
электролизе в расплаве получили газ В на аноде.
Смесь А и В пропустили над нагретой платиной, и
газы вступили в реакцию без остатка. Найти долю
выхода вещества А, если выход газа В можно
считать количественным.
Ответ. ![]() (NH3) = 60%.
(NH3) = 60%.
8. При электролизе расплава 8 г соединения
одновалентного металла на аноде выделилось
11,2 л водорода (н.у.). Определить соединение. Можно
ли подвергнуть электролизу его водный раствор?
Решение
Водород на аноде может выделяться только при
электролизе расплавов гидридов металлов МН:
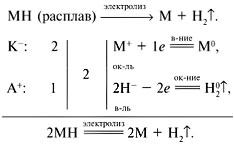
![]() (H2)
(H2)
= V(H2)/VM = 11,2/22,4 = 0,5 моль,
![]() (МH) = 2
(МH) = 2![]() (H2) = 1 моль,
(H2) = 1 моль,
M(MH) = m(MH)/![]() (MH) = 8/1 = 8 г/моль.
(MH) = 8/1 = 8 г/моль.
Искомый гидрид – LiH.
Подвергнуть электролизу водный раствор LiH
невозможно, т.к. он разлагается водой:
LiH + H2O = LiOH + H2![]() .
.
Ответ. LiH.
9. Водный раствор каустической соды
подвергали электролизу током 10 А в течение 268 ч.
После окончания электролиза осталось 100 г 24%-го
раствора гидроксида натрия. Найти
первоначальную концентрацию раствора.
Ответ. 2,4%.
10. При пропускании постоянного тока силой 6,4
А в течение 30 мин через расплав хлорида
неизвестного металла на катоде выделилось 1,07 г
металла. Определить состав соли, подвергшейся
электролизу.
Ответ. Хлорид алюминия.
