Значит, дана реакция горения углерода, а это значит, что продуктами реакции, то есть веществами, которые участвуют в реакции будут кислород и углерод. Ход решения задачи разделим на два этапа.
Правильная запись дано и необходимых условий
Разработаем план записи данных:
- запишем вещества и их химические формулы, которые участвуют в реакции.
- записываем данные, которые даются в условии.
- записываем, что с чем реагирует.
- записываем то, что надо найти.
Значит, продукты реакции: углерод, химическая формула которого C, и кислород – O2.
Дано:
m(C) = 1 кг = 1000г.
взаимодействие C с O2;
Найти: V(угл. газа)-?
Последовательное решение задачи
Также запишем по пунктам этапы решения задачи и сразу же будем решать(m – масса вещества, v – количество вещества, M – молярная масса вещества, V – объем вещества):
- Запишем уравнение реакции и укажем агрегатное состояние веществ: C + O2 = CO2↑. C – твердое, O2/CO2↑ – газообразные.
- Из реакции – на 1 моль C расходуется 1 моль CO2;
- Найдем v(C), v(C) = m(C)/M(C).
M(C) = 12 г/моль.
v(C) = (1000 г) / (12 г/моль) = 83,33 моль.
- Так как v(C) : v(CO2) = 1 : 1, то v(CO2) = v(C) = 83,33 моль.
- Запишем формулу нахождения объема: V = v * Vm. Vm – молярный объем, который равен 22,4 л/моль, когда реакция протекает в нормальных условиях без каких-либо катализаторов и ускорителей реакции. Но, он используется для нахождения объема только газообразных веществ.
- V(CO2) = 83,33 моль * 22,4 л/моль = 1866,592 л.
Запишем ответ:
Таким образом получаем, что при сгорании 1 кг углерода (C), выделяется углекислый газ (CO2) с объемом в 1866,592 л. [V(CO2) = 1866,592 л]
Вычислите объём углекислого газа (н. у.), который выделится при действии на избыток карбоната кальция 730 г 20 %-ного раствора соляной кислоты. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Спрятать решение
Решение.
1) Составлено уравнение реакции:
2) Рассчитаны количество вещества и масса соляной кислоты, содержащегося в полученном растворе:
3) Определён объём углекислого газа:
Ответ: 44,8 л.
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, включает все названные элементы. | 3 |
| Правильно записаны два первых из названных выше элементов. | 2 |
| Правильно записан один из названных выше элементов. | 1 |
| Все элементы ответа записаны неверно или отсутствуют. | 0 |
| Максимальный балл | 3 |
Какой объем можно выделить углекислого газа (CO2) при действии 200 грамм 10-процентного раствора азотной кислоты (HNO3) на 90 грамм мела, содержащего 8% нерастворимых в кислоте примесей?
Решение задачи
Напомню, что основу химического состава мела составляет карбонат кальция (CaCO3) с небольшим количеством примесей.
Запишем уравнение реакции выделить углекислый газ (CO2):
![]()
Вычислим, сколько азотной кислоты (HNO3) (в граммах) содержится в 200 грамм 10-процентного раствора азотной кислоты (HNO3) по формуле:
![]()
m (HNO3) = 200 г ⋅ 0,1 = 20 (г).
Если раствор 10-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,1.
Учитывая, что мел содержит 8% примесей, следовательно, в состав мела входит 92% (0,92) карбоната кальция (CaCO3). Вычислим, сколько карбоната кальция (CaCO3) (в граммах) содержится в 90 грамм мела по формуле:
![]()
m (CaCO3) = 90 г ⋅ 0,92 = 82,8 (г).
Учитывая, что молярные массы азотной кислоты (HNO3) и карбоната кальция (CaCO3) соответственно равны 63 и 100 г/моль (смотри таблицу Менделеева), найдем химическое количество данных веществ по формуле:
![]()
Получаем:
n (HNO3) = 20 г / 63 г/моль = 0,32 (моль),
n (CaCO3) = 82,8 г / 100 г/моль = 0,83 (моль).
По уравнению реакции определим, какое вещество находится в избытке, а какое в недостатке. Напомню, расчет следует вести по недостатку.
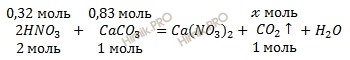
Из уравнения реакции следует, что на 1 моль карбоната кальция (CaCO3) требуется в 2 раза больше азотной кислоты (HNO3), то есть на 0,83 моль карбоната кальция (CaCO3) необходимо 1,66 азотной кислоты (HNO3), следовательно, 0,32 моль недостаточно для 0,83 карбоната кальция (CaCO3), который взят в избытке и прореагирует неполностью.
Так как карбонат кальция (CaCO3) взят в избытке, расчет следует вести по числу молей азотной кислоты (HNO3). Составим соотношение:
2 моль HNO3 надо, чтобы выделить углекислый газ 1 моль
0,32 моль HNO3 надо, чтобы выделить углекислый газ х моль
Откуда:
![]()
Вычислим объем углекислого газа (CO2), который выделяется в ходе реакции по формуле, устанавливающей связь между химическим количеством вещества и объемом:
![]()
V (CO2) = 0,16 моль ⋅ 22,4 л/моль = 3,58 (л).
Ответ:
выделить углекислый газ объемом 3,58 литра.
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
-
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
-
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
Метод решения задачи по химии на определение объема газа, выделившегося при горении этана | Типовая задача «В10» – химия ЕГЭ
Задача 1.
Объем газа (н.у.), который образуется при горении 20,0 л этана (н.у.) в 52,0 л кислорода (н.у.), равен……л. (Запишите число с точностью до десятых).
Дано:
объем этана (н.у.): V(С2Н6) — 20 л;
объем кислорода (н.у.): V(О2) = 52 л.
Найти: объем газа.
Решение:
Записываем реакцию горения этана:
2 С2Н6 + 7О2 → 4СО2 + 6Н2О
В тестах ЕГЭ в заданиях «В9» и «В10» при горении органических веществ всегда предполагается образование СО2, вне зависимости от количества кислорода или воздуха1.
В задаче требуется определить объем газа. Это требование относится только к СО2, несмотря на то, что в условиях горения образующаяся вода тоже находится в газообразном состоянии. Ее при вычислениях учитывать не надо, т.к. необходимо найти объем газа при нормальных условиях2.
В условии указаны количественные данные, относящиеся к двум исходным веществам одной химической реакции. Это верный признак задачи на избыток-недостаток.
1. Находим количество вещества С2Н6 и О2, принявших участие в первой реакции:
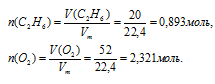
2. Определяем, какое вещество находится в недостатке. Выберем за основу этан и определим по уравнению реакции количество О2, которое необходимо для полного сгорания 0,893 моль С2Н6:
|
n(С2Н6) необходимо |
n(С2Н6) дано по условию |
|---|---|
|
3,126 моль —-> 2,321 моль |
О2 находится в недостатке и расходуется весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить по кислороду.
3. По уравнению реакции, используя значение количества вещества кислорода, находим объем выделившегося углекислого газа:
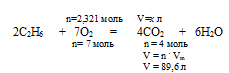
Составляем пропорцию:
2,321 моль О2 дает х л СO2 (по условию)
7 моль О2 дает 89,6 л СО2 (по уравнению)
x=2,321 . 89,6 = 29,7 л = V(CO2).
Ответ: V(CO2) = 29,7 л.
Объем выделившегося углекислого газа можно было найти и по закону объемных отношений, так как и кислород, и СО2 являются газами. Для расчета используем объем кислорода, так как он в недостатке.
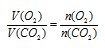
Согласно уравнению реакции 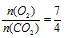 , получим:
, получим:
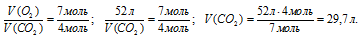
Ответ: V(CO2) = 29,7 л.
Комментарии:
1В реальности при недостатке кислорода может образоваться не только СО2, но и СО. Причем, чем больше молярная масса горящего вещества, тем больше угарного газа образуется при недостатке О2.
2В некоторых задачах, где описана реакция горения органических веществ, нет указания на н.у. Несмотря на это газом надо считать только СО2, не учитывая воду (если нет специальной оговорки по этому поводу).
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
