Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Дорогие друзья продолжаем наши разборы задач и сегодня разберем “Что такое выход продукта химической реакции?” Не всегда в ходе практических опытов мы получаем то количество вещества, на которое изначально рассчитывали. Часть вещества может не прореагировать, часть потеряться. Поэтому, полностью реагенты вряд ли когда-то прореагируют, отсюда возникли понятия практический выход от теоретически возможного
Сначала основные термины:
Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Алгоритм решения задач
1.Записываем условие задачи, определяем известные и не известные данные
2.Составляем уравнение химической реакции (УХР), расставляем коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3.Находим количество вещества известных данных
4.По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
5.Находим массовую (объёмную) долю выхода продукта по формуле.
6.Если в условии задачи уже дан выход продуктов реакции, следовательно выводим из основной формулы практические или теоретические массы.
Пример 1. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Пример 2. Определите массу осадка (г, н.у.), полученного при сливании двух растворов, один из которых содержит 4,5 г хлорида кальция, а другой 4,1 г ортофосфата натрия. Выход продукта реакции составляет 88%
Пример 3. Рассчитайте выход (%) продукта реакции 43,05 г анилина с избытком бромной воды, если для нейтрализации выделившегося бромоводорода потребовалось 62,5 г 40%-ного раствора гидроксида натрия
Задачи для самоконтроля
1.При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,5 г. Определите выход продукта реакции (%). (91,67%.)
2.При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объемом 4,2 л. Вычислите практический выход газа(%). (75%.)
3.Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить восстановлением его оксида массой 228 кг, если практический выход хрома составляет 95%. (148,2 кг.)
4.При каталитическом гидрировании формальдегида получили метиловыи спирт, при взаимодейтвии которого с металлическим натрием образовался водород объемом 8,96 л (н. у.). Выход продукта на каждой стадии синтеза составил 80%. Определите исходную массу формальдегида. (37,5 г.)
5.Вычислите, какой объем раствора с массовой долей гидроксида калия 26% (р = 1,24 r/мл) необходим для реакции с алюминием, чтобы получить водород объемом 10,64 л, если выход водорода составляет 95%. (41,35)
Надеюсь, моя статья была для вас полезна. Еще больше интересной информации вы найдете в наших сообществах в ВКонтакте vk.com/biochemschool и Телеграме t.me/biochemschool.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
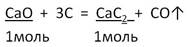 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.


Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:

Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4.
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим
|
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4.
|
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим
|
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3.
|
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР:
, следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |
Расчёты по уравнениям химических реакций
Расчёты по уравнениям химических реакций (стехиометрические расчёты) основаны на законе сохранения массы. Уравнение химической реакции показывает:
1) в каких количественных соотношениях реагируют и образуются вещества;
2) в каких отношениях масс реагируют и образуются вещества.
Если в реакции участвуют газообразные и парообразные вещества, то химическое уравнение реакции показывает, в каких объёмных соотношениях они реагируют и образуются.
Пользуясь уравнением химической реакции, можно производить вычисления, имеющие большое значение в лабораторной практике и на производстве. На основе химических уравнений вычисляют количество вещества реагирующих или полученных веществ, массу, объём (для газообразных веществ).
Уравнение химической реакции содержит обычно больше информации, чем нужно для решения задачи. Поэтому, прочитав условие задачи и написав уравнение химической реакции, надо обратить внимание на то, какая величина является данной и какая искомой. Далее надо определить, в каких единицах должен быть дан ответ (в единицах количества вещества, массы или объёма). Необходимо стремиться к наиболее рациональным вычислениям, что может быть достигнуто использованием различных единиц массы и объёма.
Расчёты количественных величин искомого вещества по уравнению химической реакции основываются на данных об известном веществе, которые могут быть указаны с использованием разных величин (массы, объёма, количества вещества).
В задачах данного вида исходное вещество содержится в растворе, поэтому найти массу растворённого вещества можно по формуле:
`m_((“р”.”в”.))=m_((“р-ва”))*omega_((“р”.”в”.))`.
Если заданы объём и плотность раствора, то массу растворённого вещества можно найти по формуле:
`m_((“р”.”в”.))=V*rho*omega_((“р”.”в”.))`.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Выражают либо в долях единицы, либо в процентах (чаще всего).
$$ {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{раствора}}}}·100%, {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{смеси}}}}·100%$$.
По уравнениям химических реакций можно рассчитывать количество вещества, массу или объём реагирующих веществ и продуктов реакции. Количества вещества соединений, вступающих в химическую реакцию и образующихся в результате реакции, пропорциональны друг другу и относятся как коэффициенты перед формулами этих соединений в уравнении реакции.
Зная количество вещества одного из реагентов, можно найти количества вещества других участников данной реакции, а по количеству вещества достаточно легко выйти на массу или объём.
Вещества реагируют друг с другом в строго определенных количественных соотношениях. Для проведения химической реакции исходные вещества могут быть взяты в любых количествах, причём одно из реагирующих веществ может быть взято в избытке, другое – в недостатке. Главная задача – определить, какое из реагирующих веществ было взято в избытке, а какое в недостатке. Определив это, дальнейший расчёт задачи вести строго по тому веществу, которое было взято в недостатке. Это можно объяснить тем, что вещество, находящееся в недостатке, прореагирует полностью, и количество вещества данного реагента будет точно известно.
Для того чтобы определить, какое из реагирующих веществ будет в избытке, а какое – в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Если же вещества реагируют в неравных количествах, то для расчёта избытка и недостатка следует учитывать коэффициенты в уравнении реакции.
При проведении расчётов по уравнениям химических реакций полагают, что исходные вещества полностью превратились в продукты реакции и что количества веществ, образующихся в результате реакции, строго соответствуют количествам вступивших в реакцию веществ.
Расчёты по уравнению химической реакции основаны на законе сохранения массы вещества. Осуществляя расчёты по химическому уравнению, мы получаем теоретический `100 %`-ный выход продукта реакции.
На самом деле масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с расчётом по уравнению химической реакции. Это связано, прежде всего, с неполным протеканием реакций в реальных химических процессах и с некоторыми потерями веществ.
Выход продукта реакции – это отношение массы практически полученного продукта к массе вещества, которая должна получиться теоретически:
`eta=m_”практ”/m_”теор”*100%`.
Зная массу исходного вещества и долю выхода продукта реакции, можно рассчитать практическую массу образующегося в результате реакции вещества. Для этого вычисляют теоретические значения этих величин, а затем с использованием формул вычисляют их практические значения:
$$ {m}_{mathrm{практ}}={displaystyle frac{{m}_{mathrm{теор}}·eta }{100%}}$$.
В случае газообразных веществ рассчитывают объёмную долю выхода продукта.
Объёмная доля выхода продукта – это отношение объёма практически полученного газообразного продукта к объёму газообразного вещества, который должен получиться теоретически:
`varphi=V_”практ”/V_”теор”*100%`.














