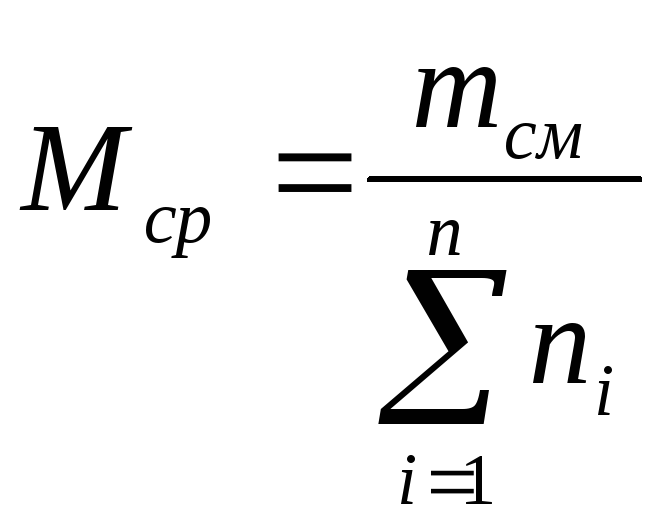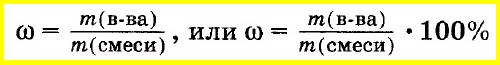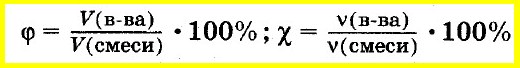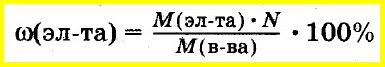Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
– молекулярная масса компонентов смеси;
– % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Массовая и объемная доли компонентов смеси. Полные уроки
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Массовая и объемная доли компонентов смеси. Полные уроки
Тема. Массовая и объемная доли компонентов смеси (раствора).
Содержание
- 1 Цели урока:
- 2 Задачи урока:
- 3 Основные термины:
- 4 Ход урока:
- 5 Растворы в природе.
- 6 Массовая доля.
- 7 Объемная доля.
- 8 Выводы.
- 9 Контролирующий блок.
- 10 Домашнее задание.
- 11 Интересно знать, что.
- 12 Список литературы:
Цели урока:
- Изучить понятие массовой и объемной доли компонентов смеси и научится их вычислять.
Задачи урока:
• обучающие: сформировать представление о массовой и объемной доли компонентов смеси, научить вычислять эти доли;
• развивающие: развить у учащихся умение анализировать, решать задачи, обобщать, сравнивать и делать выводы;
• воспитательные: расширение кругозора.
Основные термины:
Массовая доля – отношение массы растворенного вещества к общей массе раствора.
Объемная доля – отношение объема данного вещества к общему объему смеси.
Ход урока:
1. Проверка домашнего задания.
1. Среди приведенных объектов выберите самый маленький по размеру:
а) бактерия;
б) молекула;
в) маковое зернышко;
г) песчинка.
2. В каком ряду все перечисленные вещества относятся к простым?
а) мел, углерод, озон;
б) алмаз, кислород, гранит;
в) сера, фосфор, озон;
г) крахмал, водород, железо.
3. Очень важной для живой природы особенностью физических свойств воды является то, что:
а) температура кипения воды равна 100º С;
б) плотность жидкой воды выше плотности льда;
в) температура замерзания воды равна 0º С;
г) вода обладает очень низкой электропроводностью.
4. Соединений, содержащих только атомы водорода и кислорода:
а) не известно ни одного;
б) известно только одно;
в) известно несколько;
г) известно огромное количество.
5. При взаимодействии кислорода с металлами:
а) образуются соли;
б) выделяется озон;
в) образующиеся соединения всегда являются оксидами;
г) образующиеся соединения не всегда являются оксидами.
Растворы в природе.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Вы уже знаете, что природная вода никогда не бывает совершенно чистой. Так, существует вода, которая содержит значительное количество солей кальция и магния и называется жесткой (есть также мягкая вода, например дождевая). Жесткая вода дает мало пены с мылом, а на стенках котлов и чайников при ее кипячении образуется накипь. На рисунке 1 вы можете посмотреть, как жесткая вода образует накипь. Жесткость воды зависит от количества растворенных в ней солей. Содержание растворенного вещества в растворе выражают с помощью ее массовой доли.

Рис.1. Влияние жесткой воды
Давайте посмотрим видео про жесткость воды:
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
В ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром. Чистое золото — металл слишком мягкий, ноготь оставляет на нем след. износостойкость его невелика. Проба, стоящая на золотых изделиях, изготовленных в нашей стране, означает массовую долю золота в сплаве, точнее, содержание его из расчета на тысячу массовых частей сплава. Проба 583°, например, означает, что в сплаве массовая доля золота составляет 0,583 или 58,3%.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).

Рис.2. Массовая доля компонентов смеси.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).

Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5.
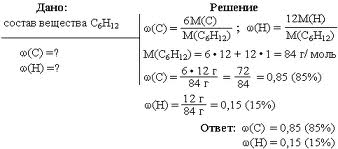
Рис.4. Задача на нахождение массовой доли.
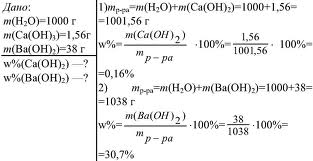
Рис.5. Задача на нахождение массовой доли (в процентах).
Объемная доля.
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6):
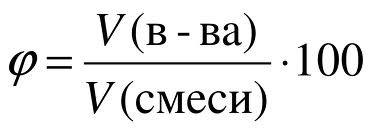
Рис. 6. Объемная доля.
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7).

Рис.7. Объемная доля благородных газов в воздухе.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Давайте посмотрим, как решать задачи на нахождение объемной доли (рисунок 8).

Рис.8. Задача на нахождение объемной доли.
Выводы.
1. Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
2. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах.
3. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой фи.
Контролирующий блок.
1. Что такое массовая доля растворенного вещества?
2. Что такое объемная доля компонента в газовой смеси?
3. Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
4. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки?
5. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
6. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе.
7. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
Домашнее задание.
1. Сделайте сообщение о чистом веществе и о растворах в природе.
2. Приведите как можно больше примеров указания объемной или массовой доли вещества в растворе.
3. Придумайте по одной задаче на нахождение массовой и объемной доли вещества.
Интересно знать, что.
Как известно, один из самых соленых водоемов в мире — Мертвое море. В нем массовая доля поваренной соли NaCl может достигать 10 %, в то время как в Черном море — не более 1,8 %. При этом молярные концентрации этой соли составляют соответственно 3,3 моль/л и 0,5 моль/л. Таким образом, массовые доли различаются примерно в 5,5 раз, а молярности — в 6,6 раз. Это объясняется тем, что воды двух морей имеют разную плотность: у Мертвого моря она настолько велика, что в нем почти невозможно утонуть; плотность человеческого тела меньше плотности такого солевого раствора (рисунок 9).

Рис.9. Мертвое море и купание в нем.
Именно благодаря своему высокому содержанию солей мертвое море считается лечебным, как сказано в этом видео:
Список литературы:
1. Урок на тему «Массовая и объемные доли» Панина С.Г., учитель химии, СОШ №27, г. Архангельск.
2. Урок на тему «Раствор» Денисов А.Н., учитель химии, гимназия №3, г. Москва.
3. Габриелян О.С. Химия. 8 класс: контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 8» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – М.: Дрофа, 2006.
4. Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений – М.: Дрофа, 2008.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали:
Панина С.Г.
Денисов А.Н.
Борисенко И.Н.
Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме, где на международном уровне собирается образовательный совет свежей мысли и действия. Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего. Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ.
Предмети > Химия > Химия 8 класс
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний – Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов –
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других “взрослых” тем.
Разработка – Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительно всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называют безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Можно выделить несколько типов математического описания: массовая концентрация, молярная концентрация, концентрация частиц и объемная концентрация[3].
Эти стаканы, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавлены, по сравнению с более концентрированными растворами справа.
Массовая доля[править | править код]
| определение | Массовая доля компонента — отношение массы данного компонента к сумме масс всех компонентов. |
|---|---|
| обозначение |  — по рекомендациям ИЮПАК[4]. — по рекомендациям ИЮПАК[4].
В технической литературе:
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |  где: где:
|
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля[править | править код]
| определение | Объёмная доля — отношение объёма компонента к сумме объёмов компонентов до смешивания. |
|---|---|
| обозначение | 
|
| единицы измерения | доли единицы,
%об (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
где:
|
При смешивании жидкостей их суммарный объём может уменьшаться, поэтому не следует заменять сумму объёмов компонентов на объём смеси.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)[править | править код]
| определение | Молярность — количество вещества (число молей) компонента в единице объёма смеси. |
|---|---|
| обозначение | По рекомендации ИЮПАК, обозначается буквой  или или ![{displaystyle [B]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6c6caf9d188e4a608dfdac98bbcd140a9ea106) , где B — вещество, концентрация которого указывается.[6] , где B — вещество, концентрация которого указывается.[6]
|
| единицы измерения | В системе СИ — моль/м³
На практике чаще — моль/л или ммоль/л. Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам. |
| формула |
где:
|
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)[править | править код]
| определение | Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. |
|---|---|
| обозначение |  , ,  , , 
|
| единицы измерения | Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. |
| формула |
где:
|
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля[править | править код]
| определение | Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. |
|---|---|
| обозначение | ИЮПАК рекомендует обозначать мольную долю буквой  (а для газов — (а для газов —  )[7], также в литературе встречаются обозначения )[7], также в литературе встречаются обозначения  , ,  . .
|
| единицы измерения | Доли единицы или %мольн (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
|
Мольная доля может использоваться, например, для количественного описания уровня загрязнений в воздухе, при этом её часто выражают в частях на миллион (ppm — от англ. parts per million). Однако, как и в случае с другими безразмерными величинами, во избежание путаницы, следует указывать величину, к которой относится указанное значение.
Моляльность (молярная весовая концентрация, моляльная концентрация)[править | править код]
| определение | Моляльная концентрация (моляльность,[5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. |
|---|---|
| обозначение |  Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как 
|
| единицы измерения | моль/кг.
Также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. |
| формула |
где:
|
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Массовая концентрация (Титр)[править | править код]
| определение | Массовая концентрация — отношение массы растворённого вещества к объёму раствора. |
|---|---|
| обозначение |  или или  — по рекомендации ИЮПАК[8]. — по рекомендации ИЮПАК[8].
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |
где:
|
В аналитической химии используется понятие титр по растворённому или по определяемому веществу (обозначается буквой 
Концентрация частиц[править | править код]
| определение | Концентрация частиц — отношение числа частиц N к объёму V, в котором они находятся |
|---|---|
| обозначение |  — по рекомендации ИЮПАК[9]. — по рекомендации ИЮПАК[9].
однако также часто встречается обозначение |
| единицы измерения | м−3 — в системе СИ,
1/л |
| формула |
где:
|
Весообъёмные (массо-объёмные) проценты[править | править код]
Иногда встречается использование так называемых «весообъёмных процентов»[10], которые соответствуют массовой концентрации вещества, где единица измерения г/(100 мл) заменена на процент. Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[11] Стоит отметить, что поскольку масса и объём имеют разные размерности, использование процентов для их соотношения формально некорректно. Также международное бюро мер и весов[12] и ИЮПАК[13] не рекомендуют добавлять дополнительные метки (например «% (m/m)» для обозначения массовой доли) к единицам измерения.
Другие способы выражения концентрации[править | править код]
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, при приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства[править | править код]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим[править | править код]
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От молярности к нормальности[править | править код]
,
где:
От молярности к титру[править | править код]
,
где:
— молярная концентрация;
— молярная масса растворённого вещества.
Если молярная концентрация выражена в моль/л, а молярная масса — в г/моль, то для выражения ответа в г/мл его следует разделить на 1000 мл/л.
От массовой доли к молярности[править | править код]
,
где:
Если плотность раствора выражена в г/мл, а молярная масса в г/моль, то для выражения ответа в моль/л выражение следует домножить на 1000 мл/л. Если массовая доля выражена в процентах, то выражение следует также разделить на 100 %.
От массовой доли к титру[править | править код]
,
где:
От моляльности к молярности[править | править код]

где:
— моляльность,
— масса растворителя,
— суммарный объём раствора,
От моляльности к мольной доле[править | править код]
,
где:
— моляльность,
— молярная масса растворителя.
Если моляльность выражена в моль/кг, а молярная масса растворителя в г/моль, то единицу в формуле следует представить как 1000 г/кг, чтобы слагаемые в знаменателе имели одинаковые единицы измерения.
Сводная таблица[править | править код]
| ωB | φB | xB | cB | CB | mB | TB | |||
|---|---|---|---|---|---|---|---|---|---|
| массовая доля | г/г | ωB | 
|

|

|

|

|

|

|
| объёмная доля | л/л | φB | 
|

|
|||||
| мольная доля | моль/моль | xB | 
|

|

|

|
|||
| молярность | моль/л | cB | 
|

|

|

|
|||
| нормальность | моль-экв/л | c((1/z) B) | 
|

|
|||||
| концентрация частиц | 1/л | CB | 
|

|

|
||||
| моляльность | моль/кгр-ля | mB | 
|

|
|||||
| титр | г/мл | TB | 
|

|

|
— моляльность вещества B,
— масса вещества B,
— масса растворителя,
— масса раствора,
— титр (массовая концентрация) B,
— плотность вещества B,
— плотность раствора,
— суммарный объём раствора,
— постоянная Авогадро,
— количество частиц вещества В,
— количество вещества В,
— количество раствора,
— молярная масса,
Примечания[править | править код]
- ↑ International Union of Pure and Applied Chemistry. concentration (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.C01222. Архивировано 20 июля 2018 года.
- ↑ International Union of Pure and Applied Chemistry. fraction (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.F02494. Архивировано 20 августа 2018 года.
- ↑ IUPAC Gold Book internet edition: «concentration».
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass fraction, w (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 13 декабря 2018 года.
- ↑ 1 2 3 Z. Sobecka, W. Choiński, P. Majorek. Dictionary of Chemistry and Chemical Technology: In Six Languages: English / German / Spanish / French / Polish / Russian. — Elsevier, 2013-09-24. — С. 641. — 1334 с. — ISBN 9781483284439.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount concentration, c (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 21 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount fraction, x ( y for gaseous mixtures) (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass concentration, γ, ρ (англ.). goldbook.iupac.org. Дата обращения: 16 декабря 2018. Архивировано 7 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – number concentration, C,n (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ Способы приготовления растворов на МедКурс. Ru. Дата обращения: 24 апреля 2012. Архивировано 29 октября 2012 года.
- ↑ Бернштейн И. Я., Каминский Ю. Л. Спектрофотометрический анализ в органической химии. — 2-е изд. — Ленинград: Химия, 1986. — с. 5
- ↑ The International System of Units (SI). www.bipm.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 14 августа 2017 года.
- ↑ Quantities, Units and Symbols in Physical Chemistry. www.iupac.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 20 декабря 2016 года.