Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
![]()
![]()
![]()
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
![]()
можно написать:
![]()
или сокращенно:
![]()
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
![]()
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
![]()
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
![]()
![]()
![]()
Учитывая, что:
![]()
можно написать:
![]()
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
![]()
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
![]()
![]()
![]()
Учитывая,
что:![]()
получим:![]()
Пересчет мольных
долей в массовые можно проводить по
формуле:
![]()
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
![]()
толуола
![]()
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
![]()
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
![]() (21)
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле
 (22)
(22)
или
![]() (23)
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
– молекулярная масса компонентов смеси;
![]() – % масс. компонента.
– % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга
 (24)
(24)
Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)

Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
![]() кг/м3;
кг/м3;
г/см3
или, исходя из
объемного состава:
![]() ,
,
или, исходя из
массового состава смеси:
 .
.
Относительную плотность определяют по
формуле:
![]()
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
![]()
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
![]() (C2H6)
(C2H6)
= 0,33 : 3,74 = 0,088;
![]()
![]() (C5H8)
(C5H8)
= 0,34 : 3,74 = 0,091;
![]() (C4H10)
(C4H10)
= 0,43 : 3,74 = 0,115;
![]()
![]() (C5H12)
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
![]()
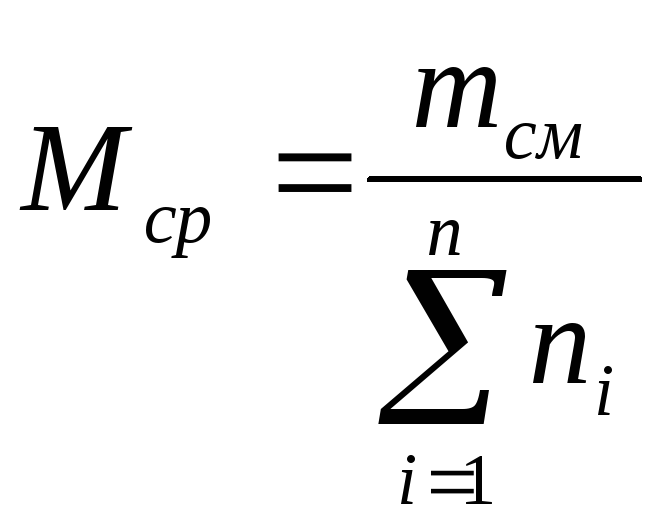
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
![]()
Находим относительную
плотность:
![]()
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
![]() (CH4)
(CH4)
= 480 : 4120 = 0,117;
![]() (C2H6)
(C2H6)
= 450 : 4120 = 0,109;
![]()
![]() (C3H8)
(C3H8)
= 880 : 4120 = 0,214;
![]() (C4H10)
(C4H10)
= 870 : 4120 = 0,211;
![]()
![]() (C5H12)
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
![]() г/л
г/л
![]()
![]()
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Сегодня буду хулиганить, как хочу 😜 (в пределах разумного, конечно 😊). С чего бы это? Объясняю: первая причина – мои ученики, вторая причина – их школьные учителя. Теперь, более подробно.
Ученики 😘 должны иметь интерес к изучаемому предмету. Я не о химии вообще. Это яркая, замечательная наука, если рассматривать ее экспериментальную часть. Я о задачах по химии. Многие ребята не решают задачи, поскольку считают их сложными, скучными, непонятными. Перед родителями встает вопрос: “Как любимую зайку, лапушку, солнышко заставить готовиться к ЕГЭ по химии?!” А никак. Вы никогда не заставите учить предмет, как бы не старались. Насильно мил не будешь. Даже если вы найдете самого дорогого репетитора, заплатите ему бешеные деньги, привяжете ребенка к креслу и поставите рядом вооруженную охрану, ребенок будет только делать вид, что он слушает учителя и усердно учится. А сам будет прокручивать в голове совсем другие мысли, типа: “Чтобы ты, зараза, сдохла! Как я тебя ненавижу!” Как быть? Давайте вспомним себя в детстве. Что у нас было в голове до 18 лет? Правильно. Ветер майский пел нам песни и менял свое направление каждый день. Чем развлекается майский ветер? Блестящим фантиком, который беззаботно машет своими бумажными крылышками. В этот момент делай с ветром, что хочешь. Так и с ребенком. Если поманить его интересной формой и дать понятное, разложенное по полочкам, содержание, сердце “ветра” растает и задачи по химии превратятся в любимейшее занятие. Это много раз проверено на моем 30-ти летнем опыте работы. Поэтому я постоянно ищу новые фантики, а содержание у меня уже давным-давно отработано и разложено по полочкам.
Школьные учителя моих учеников 😡 – еще та категория читателей, особенно, старые бабушки-химички и дедушки-химичи. Лично у меня уже закончился словарный запас приличных слов, а неприличные слова писать запрещается (произносить их тоже нельзя, можно только в мыслях). Уважаемые коллеги (🤬 пи-пи-пи), я именно к вам (🤬 пи-пи-пи) обращаюсь, прежде чем писать (🤬 пи-пи-пи) комментарии, прочитайте хотя бы школьные учебники, чтобы не получилось вот так:
Однако, вернемся к основной теме. В статье “Секретная шпаргалка по химии. 4.3. Горение смеси газов” я рассказала о гипотетических (предполагаемых) алгоритмических приемах для 28 задания ЕГЭ и подробно описала первую фишку:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по участникам процесса горения (задачи на уравнения с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции
4) Задачи на изменение объема газовой смеси в процессе реакции
Сегодня речь пойдет о второй предполагаемой фишке “Определение объемного состав смеси по участникам процесса горения (задачи на уравнения с двумя неизвестными)”. Мое мнение – это абсолютно простые задачи. Самое сложное в них – решить систему уравнений с двумя неизвестными. Итак, поехали!
Задание 28*(1)
Для сжигания 20 л смеси пропана и бутана израсходовано 124 л кислорода. Определить объемный состав смеси.
Решаем задачу с применением Четырех Заповедей (шагов). Каждое выполненное действие обводится зеленым овалом.
1. Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2. Вторая заповедь. Написать уравнение реакции.
В задаче протекает две реакции. При написании реакций, не забываем делать отступ над каждой – для дальнейших расчетов.
3. Третья заповедь. Сделать предварительные расчеты
Выписываем два досье – на пропан и бутан. В каждом досье прописываем объем газа. Пугаться не нужно, если мы не знаем значение объема. Что нам математика говорит? “Если не знаешь число – пиши неизвестное (Х или Y). Советую в каждое досье записать также объем кислорода, который был израсходован на сжигание газа. Для это выполняются стандартные расчеты по уравнению реакций. Как это сделать? Очень просто! Читайте мою статью: “Команда “Газы!” дана для всех! 4.1 Закон Гей-Люссака. Закон Авогадро. Горение” и
Составляем два алгебраических уравнения. Одно – по сумме объемов газов (20 л), второе – по общему объему кислорода, затраченного на сжигание (124 л). Решение системы уравнений лучше проводить методом сложения-вычитания (меньше действий, значит, меньше вероятность технической ошибки). В ответе мы получим объемы каждого газа.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Алгоритм решения составляем по вопросу задачи: “Определить объемный состав смеси” Объемный состав смеси газов – это значения объемных долей каждого газа, которые определяют по формуле, описанной в статье “Вангую новую фишку в заданиях ЕГЭ по химии”
Решим еще парочку задач на закрепление алгоритма.
Задание 28*(2)
Для сжигания 10 л метан-пропановой смеси израсходовано 205 л воздуха. Определить объемный состав исходной смеси.
Задача решается аналогично предыдущей, только вначале следует “извлечь” кислород из 205 л воздуха. Кстати, мы должны помнить объемную долю кислорода в воздухе – 20% (более точно 21%).
Задание 28*(3)
2,8 л смеси СО и СО2 прореагировали с 0,56 г кислорода. Определить объемный состав исходной смеси.
Из двух газов в смеси, только один участвует в реакции горения – угарный газ. Его объем рассчитывают по уравнению реакции через объем кислорода. А вот объем кислорода рассчитывают по его массе, используя универсальную расчетную единицу – количество вещества (моль). Состав смеси хорошо виден в таблице. Кстати, делать расчеты по таблице очень удобно и я советую использовать такой технический прием для ускорения решения задач и визуализации алгоритма.
Задание 28*(4)
При сжигании 350 л смеси метана и ацетилена в кислороде получили 775 л смеси СО2 и кислорода с плотностью по воздуху 1,424. Вычислите объемный состав исходной смеси.
Достаточно своеобразная задача. Поэтому разберу ее подробно, по Четырем Заповедям.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”
2) Вторая Заповедь. Написать уравнения реакции
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции.
Небольшой стоп! Я предупредила, задача необычная – нужно найти состав смеси реагентов по составу смеси продуктов. Поэтому, первые предварительные расчеты – определить состав смеси продуктов по средней молярной массе. Этот прием я подробно описывала в статье статье “Вангую новую фишку в заданиях ЕГЭ по химии”.
После определения объемных долей газов-продуктов, определяем объем углекислого газа – это суммарный углекислый газ, который выделился и при сжигании метана, и при сжигании ацетилена.
Применяем уже известный нам алгоритм – “Определение объемного состав смеси по участникам процесса горения (задачи на уравнения с двумя неизвестными)”. На этапе предварительных расчетов определяем объемы газов-реагентов
4. Четвертая заповедь. Составить алгоритм решения задачи. Алгоритм решения составляется по вопросу задачи: “Вычислите объемный состав исходной смеси”. Объемный состав исходной смеси рассчитывается по формуле объемной доли (объем каждого газа делится на общий объем смеси). Эту и другие формулы я подробно разобрала в вышеуказанной статье “Вангую новую фишку в заданиях ЕГЭ по химии”
Вот и все. Задача решена. Усидчивым читателям – респект и уважуха 👍! Если еще остались силы, можете попробовать решить задачи самостоятельно, не подсматривая в мое объяснение. Если сил уже нет, идите пить чай с имбирем, шоколадом и горячими плюшками ☕️ 🍫 🥧 (рецепт отличных плюшек прочитаете в следующих статьях). И до скорого свидания на полях Яндекс Дзен!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 – mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
