2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
или
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
или
для двух состояний
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
или
для двух состояний
,
г)
объединенный газовый закон (m=const)
или
для двух состояний
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
,
где
т
—
масса смеси.
Концентрация молекул
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно – кинетической теории газов
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
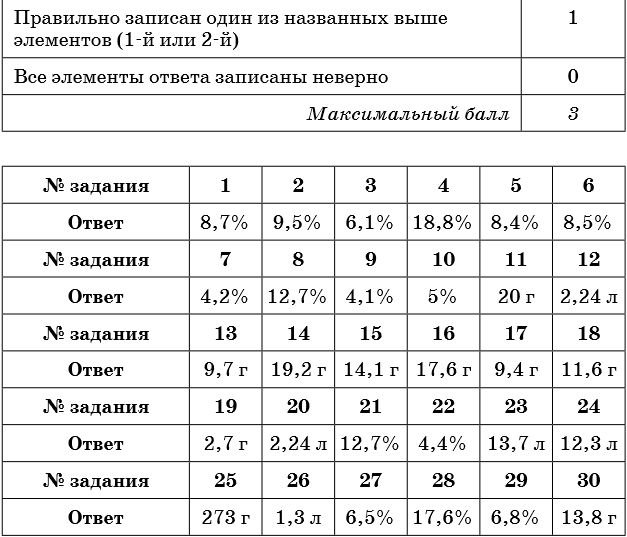
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
Итак, количество вещества в химии обозначается греческой буквой “ню”.
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву “ню”. До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую “ню”.
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
“Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси”.
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой “фи”. Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите “Нет”.
НЕОБХОДИМЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
КОЛИЧЕСТВО ВЕЩЕСТВА — отношение массы вещества к молярной массе вещества.
КОЛИЧЕСТВО ВЕЩЕСТВА — отношение объема газа к молярному объему (22,4л/моль). (н.у.)
МАССОВАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ — отношение массы компонента к массе всей смеси.
Обычно массовую долю выражают в %, но не обязательно.
МАССОВАЯ ДОЛЯ КОМПОНЕНТА В РАСТВОРЕ — отношение массы компонента к массе всего раствора.
Обычно массовую долю выражают в %, но не обязательно.
МОЛЬНАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
ОБЪЕМНАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
ОПРЕДЕЛЕНИЕ ВЫХОДА ПРОДУКТА по отношению к теоретически возможному :
АЛГОРИТМ 1
ВЫЧИСЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЕМУ ДРУГОГО ВЕЩЕСТВА, УЧАСТВУЮЩЕГО В РЕАКЦИИ
2. Записать уравнение реакции, расставим коэффициенты;
3. Найти молярные массы веществ, о которых идет речь в условии задачи
4. Найдем количество веществ, массы или объемы которых даны в условии задачи по формулам:
5. Над формулами веществ запишем найденные количества веществ, а под формулами – стехиометрические соотношения, отображаемые уравнением реакции
6. Составить соотношение количеств веществ (первая дробь – коэффициенты, равно, вторая дробь найденная величина, и что необходимо найти).
7. По формулам, указанным выше, найдем массу или объем вещества, которую требуется вычислить.
АЛГОРИТМ 2
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ИСХОДНОГО ВЕЩЕСТВА, СОДЕРЖАЩЕГО ПРИМЕСИ.
АЛГОРИТМ 2
ВЫЧИСЛЕНИЕ МАССЫ ИСХОДНОГО ВЕЩЕСТВА, СОДЕРЖАЩЕГО ПРИМЕСИ, ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ПРОДУКТА РЕАКЦИИ
АЛГОРИТМ 3
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА ПО ИЗВЕСТНОЙ МАССЕ ИЛИ ОБЪЁМУ ИСХОДНОГО РАСТВОРА ВЕЩЕСТВА С ОПРЕДЕЛЕННОЙ МАССОВОЙ ДОЛЕЙ РАСТВОРЕННОГО ВЕЩЕСТВА
АЛГОРИТМ 4
ВЫЧИСЛЕНИЕ МАССЫ ПРОДУКТА РЕАКЦИИ ПО ИЗВЕСТНОЙ МАССЕ РЕАГЕНТА, ЕСЛИ ИЗВЕСТЕН ВЫХОД ПРОДУКТА РЕАКЦИИ.
АЛГОРИТМ 4
ВЫЧИСЛЕНИЕ МАССЫ ИСХОДНОГО ВЕЩЕСТВА ПО ИЗВЕСТНОЙ МАССЕ ПРОДУКТА РЕАКЦИИ, ЕСЛИ ИЗВЕСТЕН ВЫХОД ПРОДУКТА РЕАКЦИИ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО.
АЛГОРИТМ 5
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, ЕСЛИ ОДНО ИЗ РЕАГИРУЮЩИХ ВЕЩЕСТВ ДАНО В ИЗБЫТКЕ.
26(Б) Задачи ЕГЭ ФИПИ 2015 на расчет массы вещества или объема газов
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/

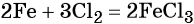
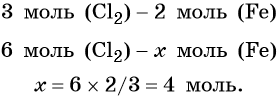
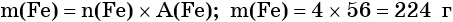
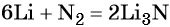
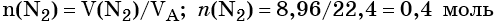
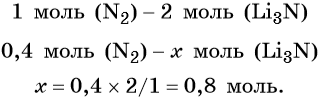
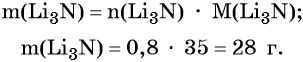
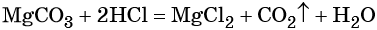
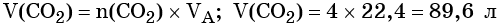
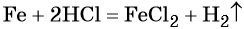
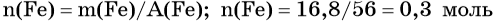
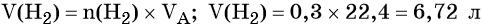
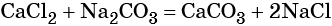
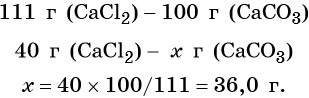
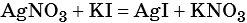
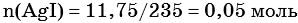
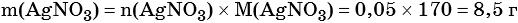
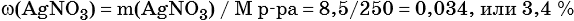
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)

























