Самое первое задание второй части ЕГЭ и ОГЭ по химии, где нужно дать развернутый ответ, касается окислительно-восстановительных реакций (ОВР). Также знание этой темы необходимо для выполнения задания №21 в ЕГЭ и задания №14 в ОГЭ. Попробуем разобраться, что же это такое – ОВР, и как их правильно записывать и уравнивать.
ОВР – это реакции, в которых атомы обмениваются электронами и меняют свои степени окисления.
Например, образование молекулы воды:
Атомы кислорода забирают электроны у атомов водорода.
Атомы, принимающие электроны – окислители, а отдающие – восстановители.
Рассмотренная реакция относится к межмолекулярным ОВР, так как атомы окислителя и восстановителя находятся в разных молекулах. В случаях, когда они находятся в составе одной молекулы, ОВР называют внутримолекулярными (например: 2H2O = 2H2 + O2). Бывают реакции, в которых атомы одного и того же химического элемента играют роль и окислителя и восстановителя. Это реакции диспропорционирования. В них часть одинаковых атомов понижает степень окисления, а другая часть повышает. Например, в реакции 2H2O2 = 2H2O + O2 часть атомов кислорода из степени окисления -1 переходит в -2, а часть из -1 в 0. Если же атомы одного и того же химического элемента переходят из разных степеней окисления в одну – то это реакции репропорционирования. В реакции SO2 + 2H2S = 3S + 2H2O в левой части есть атомы S в степени окисления +4 и -2, а переходят они в степень окисления 0.
Поговорим о методах уравнивания ОВР. Число атомов химических элементов в левой и правой части уравнения должно быть одинаковым – это закон сохранения массы. Как правильно и быстро подобрать коэффициенты? Есть два метода.
Метод электронного баланса
Подберем коэффициенты для реакции
Для начала выясним, какие элементы меняют свои степени окисления. Видно, что это азот (из +5 в +4 – принимает 1 электрон) и медь (из 0 в +2 – отдает 2 электрона). Запишем это:
Число отданных и принятых электронов должно быть равно!
Для того, чтобы уравнять число отданных и принятых электронов, подберем наименьшее общее кратное для чисел 1 и 2 – это 2. Первую полуреакцию умножаем на 2, вторую – на 1, и с учетом умножающих коэффициентов записываем суммарную реакцию:
Перенесем полученные коэффициенты в полное уравнение химической реакции. Перед HNO3 и NO2 поставим 2. Однако, видимо, что часть нитрат ионов пошла на образование нитрата меди, и в правой части атомов азота не 2, а 4. Поэтому перед молекулой HNO3 удваиваем коэффициент. Проверим атомы H. В левой части их 4, значит перед H2O ставим 2.
Коэффициенты найдены. Как видите, после составления электронного баланса, нам понадобились дополнительные действия для поиска верных коэффициентов. Можно воспользоваться более удобным методом.
Метод ионно-электронных схем
В данном методе при составлении полуреакций используют реально существующие в растворе частицы (ионы, если вещество электролит, и молекулы, если вещество слабый электролит или не распадается на ионы вовсе). Для той же самой реакции взаимодействия меди и концентрированной HNO3 составим полуреакции. Азотная кислота является электролитом, поэтому атом N(+5) в растворе существует в виде нитрат иона NO3(-). А полученный в ходе реакции оксид NO2 не является электролитом. Он и будет фигурировать в полуреакции:
Нужно уравнять правую и левую части. Для этого воспользуемся правилами:
В кислой или нейтральной среде:
1.Недостаток атомов O уравниваем молекулами воды
2.Недостаток атомов H уравниваем протонами (H+)
3.Если в нейтральной среде в левой части возникают протоны, добавляем в правую и левую часть уравнения гидроксо-группы для образования молекул воды.
В щелочной среде:
1.Недостаток атомов O уравниваем гидроксо-группами (OH-), взятыми в 2-хкратном избытке
2.Недостаток атомов H уравниваем молекулами воды.
В нашем случае среда кислая. Поэтому в правой части полуреакции добавляем молекулу H2O для уравнивания атомов O, а в левой части два протона для уравнивания атомов H. Суммарный заряд всех ионов в левой части полуреакции составил +1, а в правой части 0. Значит система приняла 1 электрон:
Такими же рассуждениями записываем полуреакцию с участием меди, находим наименьшее общее кратное, и с учетом умножающих коэффициентов записываем суммарное уравнение:
Нам остается просто перенести полученные коэффициенты в уравнение реакции:
Как видно, количество протонов и молекул воды в результате использования данного метода получается автоматически.
Метод ионно-электронных схем в сравнении с методом электронного баланса правильнее отражает химию протекания окислительно-восстановительных реакций, так как показывает реально существующие в растворе частицы.
В дальнейших публикациях рассмотрим применение метода ионно-электронных схем в нейтральной и щелочной среде, а также при уравнивании органических реакций.
Как производится метод электронного баланса?
Метод электронного баланса
Анонимный вопрос
21 декабря 2018 · 52,5 K
Получил математическое и богословское образование. Есть дети, соответсвенно и опыт их… · 12 янв 2019
Метод электронного баланса используется для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций. Суть метода заключается в том, что количество электронов, отданных восстановителями равно количеству электронов, принятых окислителями.
Алгоритм:
-
В схеме реакции определяем, какие вещества – окислители, а какие – восстановители.
-
Определяем, сколько электронов отдал каждый восстановитель, и сколько принял каждый окислитель.
-
Отдельно суммируем число отданных электронов и принятых.
-
Находим наименьшее общее кратное, и расставляем коэффициенты так, чтобы количество отданных электронов равнялось количеству принятых (учитываем количество атомов окислителей и восстановителей в веществах).
-
Перенеся коэффициенты в схему реакции, также уравниваем количество атомов тех элементов, которые не меняли степень окисления.
Пример (в скобках указано количество принятых или отданных электронов):
Дана реакция: FeS + O2 = Fe2O3 + SO2
-
Здесь железо и сера – окислители, кислород – восстановитель.
-
Fe(+2) – 1e = Fe (+3) , S(-2) – 6e = S(+4), т.е. железо отдаёт один электрон, сера отдаёт четыре.
O2 +4e = 2O(-2), кислород принимает четыре электрона. -
Получаем, что окислители отдали 7 электронов: Fe(+2) + S(-2) – 7e = Fe(+3) + S(+4), а восстановитель принял 4 электрона.
-
Наименьшее общее кратное для 7 и 4 – это 28, коэффициенты получаются такими:
4Fe(+2) + 4S(-2) + 7O2 = 4Fe(+3) + 4S(+4) + 14O(-2) -
Уравнение приобретает вид: 4FeS + 7O2 = 2Fe2O3 + 4SO2
55,4 K
Комментировать ответ…Комментировать…
Расставить коэффициенты в уравнениях многих ОВР можно с помощью метода электронного баланса. Он основан на том, что общее число электронов, “отдаваемых” восстановителем и “принимаемых” окислителем в одной и той же реакции должно быть одинаковым. Метод электронного баланса рассматривает, как правило, не реально существующие частицы, а условные ионы, т.е. атомы, взятые в данной СО. Поэтому он, с одной стороны, носит формальный характер, а, с другой, может применяться для различных ОВР. При этом рекомендуется определенная последовательность действий. Рассмотрим ее на примере ОВР, схема которой
Na2SO3 + K2Cr2O7 + H2SO4 → Na2S2O6 + Cr2(SO4)3 + K2SO4 + H2O + Na2SO4. 1. Для заданной схемы реакции находим, какое вещество является
восстановителем, а какое – окислителем. С этой целью необходимо определить СО атомов в исходных веществах и в продуктах реакции
Na2+1S+4O3-2 + K2+1Cr2+6O7-2 + H2+1S+6O4-2 → Na2+1S2+5O6-2 + Cr2+3(S+6O4-2)3 + + K2+1S+6O4-2 + H2+1O-2 + Na2+1S+6O4-2.
Видно, что Na2SO3 является восстановителем за счет атома серы, СО которого повышается с +4 до +5, а K2Cr2O7 – окислителем за счет атомов хрома, понижающих СО с +6 до +3.
2. Составляем электронные уравнения процессов окисления
S+4 – e = S+5
и восстановления
Cr+6 + 3e = Cr+3.
Числа электронов в этих уравнениях и знаки перед ними, т.е. “+” или “-“, определяются из закона сохранения заряда (+4) – x = (+5) ═=> x = -1; (+6) – y = (+3) => y = +3. Напомним, что заряд электрона равен -1.
17
3. Находим наименьшее общее кратное (НОК) для чисел “отданных” и “присоединенных” электронов и с его помощью определяем множители для обоих электронных уравнений: НОК для 1 и 3 равно 3; множитель для первого уравнения 3 : 1 = 3; множитель для второго уравнения 3 : 3 = 1. Обычно это запи-
|
сывают так: |
||
|
Восстановитель S+4 – e = S+5 |
3 Окисление |
|
|
НОК = 3 |
||
|
Окислитель Cr+6 + 3e = Cr+3 |
1 Восстановление. |
Схему подобного типа называют схемой электронного баланса или просто электронным балансом.
Составляем суммарное уравнение электронного баланса с учетом закона сохранения массы (число атомов каждого элемента слева и справа от знака равенства должно быть одинаково). Коэффициенты в этом уравнении – это множители, полученные в п.3, а электроны должны сократиться
3S+4 + Cr+6 = 3S+5 + Cr+3.
5. Подставляем коэффициенты в уравнение реакции к формулам восстановителя, окислителя, продуктов окисления и восстановления, перенося туда коэффициенты из суммарного уравнения электронного баланса, деленные на индексы при атомах-восстановителях (3 : 1 = 3) и атомах-окислителях (1 : 2 = 0.5) в формулах исходных веществ и атомах-продуктах окисления (3 : 2 = 1.5) и атомах-продуктах восстановления в формулах продуктов реакции (1 : 2 = 0.5).
3Na2SO3 + 0.5K2Cr2O7 + H2SO4 → 1.5Na2S2O6 + 0.5Cr2(SO4)3 + K2SO4 + H2O + Na2SO4. 6. Поскольку коэффициенты в обычных уравнениях должны быть
натуральными числами, то необходимо левую и правую части умножить на 2: 6Na2SO3 + K2Cr2O7 + H2SO4 → 3Na2S2O6 + Cr2(SO4)3 + K2SO4 + H2O + Na2SO4.
18
7. Подбираем остальные коэффициенты в следующем порядке:
–перед формулами соединений содержащих атомы металлов (в нашем случае 1 перед K2SO4 и 3 перед Na2SO4);
–перед формулой вещества, создающего кислую или щелочную среду в растворе (в нашем случае перед формулой H2SO4 необходим коэффициент 7, так как на связывание образующихся в реакции катионов хрома(III), калия и натрия идет 7 молекул кислоты);
–перед формулой воды (в нашем случае все атомы водорода из H2SO4 перешли в H2O, а индексы при атомах водорода в обеих молекулах совпадают, следовательно коэффициент перед формулой воды равен 7).
8. Проверяем правильность расстановки коэффициентов, подсчитав суммарное число атомов каждого элемента в левой и правой частях уравнения. Чаще всего ограничиваются подсчетом числа атомов кислорода в исходных веществах и продуктах.
Окончательный вид уравнения
6Na2SO3 + K2Cr2O7 + 7H2SO4 = 3Na2S2O6 + Cr2(SO4)3 + K2SO4 + 7H2O + 3Na2SO4.
Рассмотрим еще один пример. Схема реакции
FeS2 + O2 → Fe2O3 + SO2.
1. Определяем СО атомов во всех участниках реакции
Fe+2S2-1 + O20 → Fe2+3O3-2 + S+4O2-2
и находим восстановитель и окислитель. Видно, что FeS2 является восстановителем за счет атомов обоих элементов, входящих в его состав. При этом атом железа повышает свою СО с +2 до +3, а атомы серы – с -1 до +4. ОкислителемявляетсяO2 засчетатомовкислорода, понижающихсвоюСОс0 до-2.
19
2. Составляем электронные уравнения процессов окисления и восстановления
Fe+2 – e = Fe+3
S-1 – 5e = S+4
O0 + 2e = O-2.
3. Составляем схему электронного баланса. При этом, поскольку атомывосстановители здесь являются атомами различных элементов, но входят в состав одного вещества, то необходимо, чтобы в схему вошло суммарное электронное уравнение окисления формульной единицы FeS2 как единого целого
|
Fe+2S2-1 – (1 + 2·5 = 11)e = Fe+3 + 2S+4. |
|||
|
Схема электронного баланса |
|||
|
Восст-ль Fe+2S2-1 – 11e = Fe+3 + 2S+4 |
2 Окисление |
||
|
НОК = 22 |
|||
|
Окислитель O0 + 2e = O-2 |
11 Восст-ние. |
4.Суммарное уравнение электронного баланса
2Fe+2S2-1 + 11O0 = 2Fe+3 + 4S+4 + 11O-2.
5.Поставим коэффициенты в уравнение реакции перед формулами восстановителя (2), окислителя (11 : 2 = 5.5; 2 – индекс в молекуле дикислорода при атоме-окислителе), продуктов окисления (2 : 2 = 1; 2 – индекс в формуле продукта окисления Fe+2 при атоме-продукте окисления; 4 : 1 = 4; 1 – индекс в молекуле продукта окисления S-1 при атоме-продукте окисления) и восстановления (т.к. атомы O-2 входят в состав обоих продуктов окисления, то коэффициенты, относящиеся к кислороду, получаются автоматически из предыдущего)
2FeS2 + 5.5O2 = Fe2O3 + 4SO2.
Поскольку коэффициенты в обычных уравнениях должны быть натуральными, то необходимо левую и правую части умножить на 2.
Окончательный вид уравнения
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
20
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Окислительно-восстановительные реакции. Окислитель и восстановитель

Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
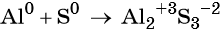
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:

Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
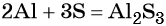
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
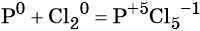
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
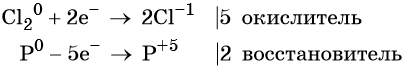
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
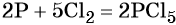
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
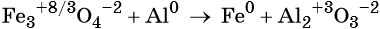
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
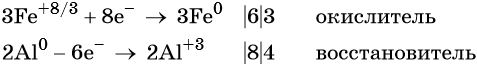
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
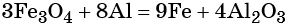
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
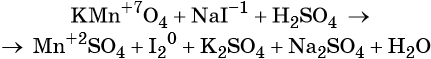
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
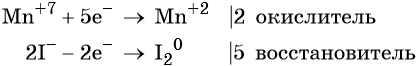
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
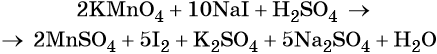
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
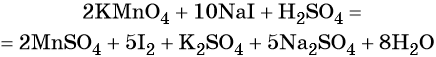
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
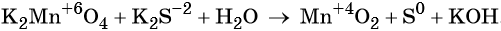
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
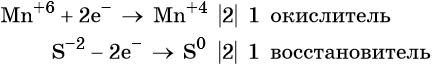
Основные коэффициенты в уравнении реакции равны единице:
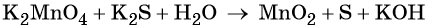
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
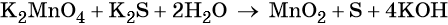
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
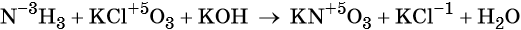
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:

Проставляем найденные основные коэффициенты в уравнение реакции:
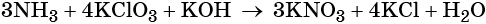
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
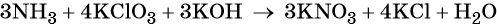
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
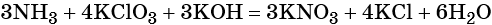
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
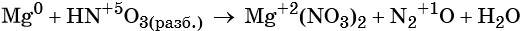
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
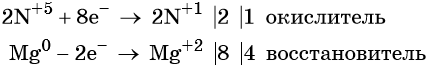
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
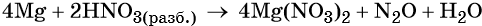
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
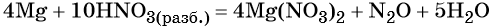
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
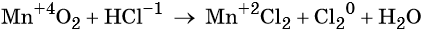
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
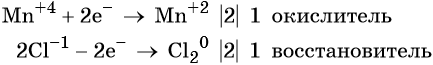
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
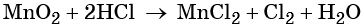
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
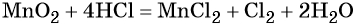
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
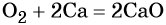
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
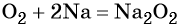
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
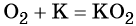
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
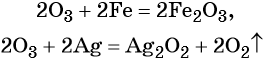
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
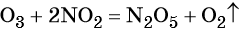
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
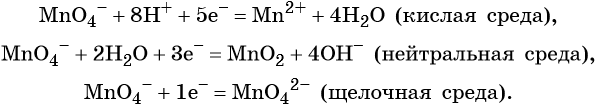
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
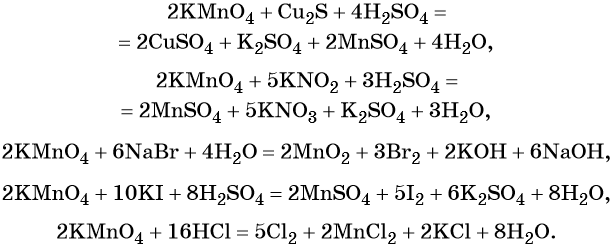
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
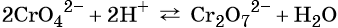
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
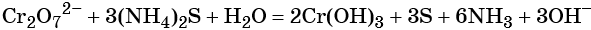
В кислой среде образуются ионы Cr3+:
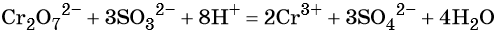
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
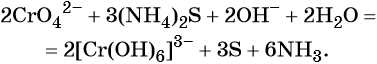
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
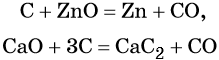
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:

Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
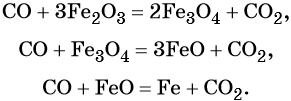
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
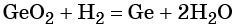
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы


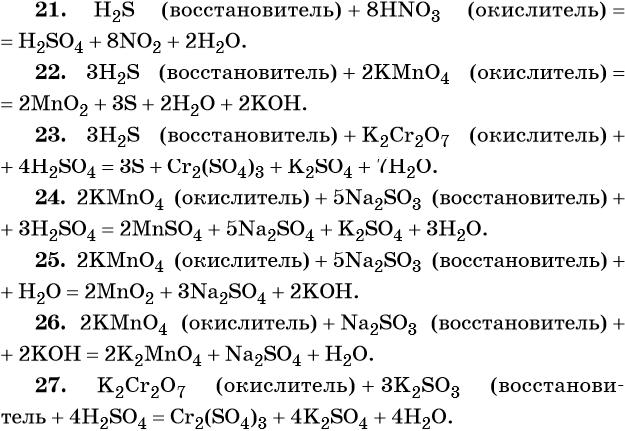



План урока:
Основные термины
Характеристика окислителей
ОВР кислот
Запись ОВР процесса
Уравнивание ОВР-реакций
Виды уравнений окислительно-восстановительных реакций
Основные термины
Если реакция рассматривается как ОВР-процесс, в ней обязательно присутствует окислитель и восстановитель.

Источник
- восстановитель – атом в составе простой или сложной молекулы, отдающий электроны. Степень окисления становится меньше.
- окислитель – атом в составе простой или сложной молекулы, принимающий электроны.
Характеристика окислителей
Это все неметаллы, кислоты, пероксиды и некоторые соли. Способность отщеплять электроны изменяется в зависимости от положения элемента в таблице Менделеева: в периоде увеличивается слева направо, в группе – с низу вверх. Самым сильным окислителем считается фтор. Так же, к этой группе относятся высшие оксиды элементов. Сила способности отнять электроны сложных веществ зависят от степени окисления нужного атома и от концентрации.
Такие свойства выражаются стандартным электродным потенциалом. Чем он выше, тем выше окислительные свойства. Все окислители делятся на четыре группы.
Таблица. Группы окислителей и их характеристика


ОВР кислот
От растворимости зависят свойства азотной и серной кислот.
HNO3
Чем ближе концентрация HNO3 к 100%, тем больше электронов получит азот.
- Ca + 4HNO3(конц.)= Ca(NO3)2+ 2NO2 + 2H2O (1 e)
- 3Mg + 8HNO3(40 %)= 3Mg(NO3)2+ 2NO + 4H2O (3 e)
- 4Mg + 10HNO3(20 %)= 4Mg(NO3)2+ N2O + 5H2O (4 e)
- 5Ba + 12HNO3(6 %)= 5Ba(NO3)2+ N2 + 6H2O (5 e)
- 4Zn + 10HNO3(0.5 %)= 4Zn(NO3)2+ NH4NO3 + 3H2O (8 e).
Продукты реакции, также, зависят от положения металла в ряду активности.

Источник
Таблица. Продукты реакции разбавленной и концентрированной азотной кислоты с металлами с различной активностью.

Исключения:
- Благородны металлы не реагируют с этой кислотой ни при каких условиях.
- Al, Cr и Fe реагируют с безводным окислителем только при нагревании.
H2SO4
Серная кислота одно из сильных веществ, отнимающих электроны. Продукт реакции, так же, как и с азотной, зависят от концентрации кислоты и активности первоначального металла. Растворимая серная кислота не дает специфических продуктов и реагирует только с металлами до водорода в ряду активности. При этом, образуется соль металла и водород:
2Na + H2SO4 → Na2SO4 + H2
Продукты H2SO4(конц.) с металлами перечислены в таблице.
Таблица. Продукты реакции концентрированной серной кислоты с металлами с различной активностью.

Источник
Зависимость окисления от реакционной среды
ОВР может проходить в щелочной, нейтральной или кислой среде. При этом, один и тот же атом может проявлять разные свойства. Ярким примером являются реакции KMnO4и K2Cr2O7
Особенности KMnO4 как окислителя
Перманганат калия или натрия способен проявлять только окислительные свойства за счет иона Mn+7. В реакциях с ним всегда используется вещество, определяющее кислотность среды, не участвующее в ОВР-процессе. Им может быть:
- H2SO4 (формирует кислую среду)
- H2O (нейтральная)
- NaOH или KOH (щелочная среда).
Таблица. Продукты реакции перманганата калия в зависимости от реакционной среды.

Источник
Особенности K2Cr2O7 как окислителя
Бихромат калия – один из распространенных веществ с указанными свойствами, продукты восстановления которого, так же, зависят от среды.
Таблица. Продукты реакции перманганата калия в зависимости от кислотности среды.

Запись ОВР процесса
При отображении такого процесса записывают не только реакцию, но и преобразования окислителя и восстановителя. Так, первая строчка – само уравнение c расставленными степенями окисления:
H+2S2- + Cl02 = S0 + 2H+Cl–
Если у элемента н изменилась степень окисления, он не является участником ОВР (у нас это водород)
Далее записывается процесс его восстановления:
S2- – 2е → S0 (окислитель, восстановление)
И восстановления:
Cl02 + 2е →2 Cl– (восстановитель, окисление)
Уравнивание ОВР-реакций
Одним из самых сложных действий в написании ОВР является уравнивание молекул. Существует два способа: метод электронного баланса и метод электронно-ионного баланса (полуреакций).
Метод электронного баланса
Метод основан на определении баланса между количеством отданных и принятых электронов:
Al0 + Cu+2S+6O4 -2 → Al+32(S+6O4-2 )3 + Cu0
В ходе процесса изменяются степени окисления двух элементов – Alи Cu, с которыми работаем в первую очередь. Алюминий отдает электроны и превращается в ион Al+3. Он окисляется в ходе реакции. Ион меди, принимая два электрона, восстанавливается, степень окисления меди изменяется от +2 до 0. Изменения степеней окисления можно выразить электронными уравнениями:
Al0 – 3e → Al+3 (окисление)
Cu+2 + 2e → Cu0 (восстановление)
Количество принятых и переданных электронов должно быть одинаковым. Поэтому: умножаем цифры между собой (находим общее кратное): 3×2=6.
Если разделить общее кратное на число переданных алюминием электронов(6/3=2), то найдем коэффициент перед этой молекулой в уравнении (ставим перед Al).
То же действие позволит найти коэффициент для второго реагента: 6/2=3 (ставим перед Cu).
В результате получаем основные цифры в записи реакции:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Если в уравнении больше реагентов и продуктов, остальные находятся математическим уравниванием.
Проверку правильности коэффициентов всегда осуществляем по кислороду.
Метод полуреакций
Чтобы уравнять и написать уравнение методом полуреакций, нужно использовать определенный алгоритм:
- Записать реагенты: K2Cr2O7+ H2SO4+ H2S
- Определить окислитель и восстановителя
- Записывают процесс окисления и восстановления с учетов преобразования всех атомов молекул: Cr2O72−+ 14H++ 6e− = 2Cr3+ + 7H2O * 1
H2S − 2e− = S(т) + 2H+ * 3
- Записывают продуты образования окислителя и восстановителя с учетов коэффициентов (из формул): 2Cr3+ и S
- Сгруппировать остальные атомы в продукты (дополнительное ионное взаимодействие между средообразующей молекулой и реагентом. Чаще всего – соль): K2SO4
- Собирать полный процесс: K2Cr2O7+ 4H2SO4+ 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
- Проверить правильность коэффициентов по кислороду.
Виды уравнений окислительно-восстановительных реакций
Окислитель и восстановитель не всегда находятся в разных молекулах. Иногда это один атом, участвующий сразу в двух процессах или разные молекулы с одним и тем же элементом и т.д. в зависимости от этого выделяют несколько вариантов ОВР:
- Межмолекулярные
Окислитель и восстановитель являются разными молекулами.
2 KMn+7O4 + 10 KI– + 8 H2SO4 → 6 K2SO4 + 5 I20 + 2 Mn+2SO4 + 8 H2O
Mn+7 + 5 ē → Mn+2 – 5 – 2 (окислитель восстанавливается)
2 I-1 – 2 ē → I20 – 2 – 5 (восстановитель окисляется)
- Внутримолекулярные
Внутримолекулярные– взаимодействия, в которых окислитель и восстановитель находятся в одной молекуле.
(N-3H4)2Cr2+6O7 → N20 + Cr2+3O3 + 4 H2O
2 Cr+6 +6 ē → 2 Cr+3 – 6 – 1 (окислитель восстанавливается)
2 N-3 – 6 ē → N20 – 6 – 1 (восстановитель окисляется)
Атомы с противоположными свойствами находятся в одной молекуле
- Реакция диспропорционирования
Диспропорционирование – ОВР, в котором и оба свойства проявляет один и тот же атом, образуя несколько продуктов с разными степенями окисления.
Cl20 + 2 NaOH → NaCl– + NaCl+O + Н2О
Cl20 + 2 ē → 2 Cl– – 2 – 1 (окислитель восстанавливается)
Cl20 – 2 ē →2 Cl+ – 2 – 1 (восстановитель окисляется)
- Реакция репропорционирования
Репропорционирование – противоположный процесс, когда один элемент из разных состояний переходит в одно.
2 H2S-2 + S+4O2 → 3 S0 + 2 H2O
S-2 + 4 ē → S0 – 4 – 1 (окислитель восстанавливается)
S+4 – 2 ē → S0 – 2 – 2 (восстановитель окисляется)
Общее кратное коэффициентов – 2. т.о., у соединений первой серы (S-2) коэффициент 1, а у соединений второй серы (S+4) – коэффициент 2.
При кажущейся сложности, ОВР-процессы одни из самых распространенных в природе. Например – ржавление железа, скисание молока и даже дыхание являются примерами этих процессов.
