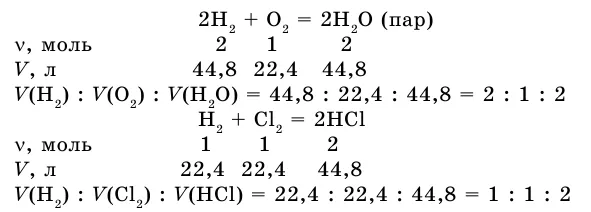Как найти объем раствора
Существует несколько формул для нахождения объема раствора. В зависимости от того, что дано в условии задачи, можно выбрать одну из них. Порой данных в задаче недостаточно, и приходится применять дополнительные формулы для их нахождения.

Инструкция
Одна из наиболее часто используемых формул выглядит так: V = m/p, где V – объем, m – масса(г), p – плотность(г/мл). Соответственно, если даны эти величины, можно без труда найти объем. Иногда бывает так, что не дана масса вещества, но дано количество вещества (n) и указано, какое это вещество. В этом случае массу находим по формуле: m = n*M, где n – количество вещества (моль), а M – молярная масса(г/моль). Лучше всего рассмотреть это на примере задачи.
Количество вещества раствора сульфата натрия равно 0,2 моль, а плотность – 1,14 г/мл, найти его объем.Сначала пишем основную формулу для нахождения объема: V = m/p. Из этой формулы по условию задачи мы имеем только плотность (1,14 г/мл). Находим массу: m = n*M. Количество вещества дано, осталось определить молярную массу. Молярная масса равна относительной молекулярной массе, которая в свою очередь складывается из относительных атомных масс простых веществ, входящих в состав сложного. На самом деле все просто: в таблице Менделеева под каждым веществом указывается его относительная атомная масса. Формула нашего вещества Na2SO4, считаем. M (Na2SO4) = 23*2+32+16*4=142 г/моль. Подставляем в формулу, получаем: m = n*M = 0,2*142 = 28,4 г. Теперь полученное значение подставляем в общую формулу: V = m/p = 28,4/1,14 = 24,9 мл. Задача решена.
Бывают еще другие типы задач, где присутствует объем раствора – это задачи на концентрации раствора. Формула, необходимая для нахождения объема раствора, выглядит так: V = n/c, где V – объем раствора(л), n – количество растворенного вещества(моль), c – молярная концентрация вещества(моль/л). При необходимости найти количество растворенного вещества, это можно сделать по формуле: n = m/M, где n – количество растворенного вещества(моль), m – масса(г), M – молярная масса(г/моль).
Обратите внимание
Единицы измерения данных величин должны соответствовать друг другу. Например, если масса дана в кг, то соответствующий ей объем измеряется в литрах. А если масса в г, то объем в мл.
Полезный совет
Всегда внимательно читайте условие задачи. Порой из-за неправильно прочитанного условия можно не решить даже самую легкую задачу.
Источники:
- “Сборник задач по химии”, Г.П. Хомченко, И.Г. Хомченко, 2002.
- определить объем раствора
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как найти объем в химии?
ХимияХимические формулы
Анонимный вопрос
6 марта 2019 · 20,3 K
ОтветитьУточнить
Помощь по химии: решение задач, химия онлайн101
Помощь c решением задач по химии онлайн от выпускника химфака МГУ с красным дипломом… · 22 янв 2021 · chemhelp.ru
ОтвечаетВладислав Панарин
Чтобы найти объём газа (при н.у.), нужно количество моль газа умножить на молярный объём газа (при н.у):
- V = n*Vm
- Vm = 22.4 л/моль
Чтобы найти объём раствора, нужно массу раствора поделить на плотность раствора:
- V(р-ра) = m(р-ра)/ρ
Помощь по химии: решение задач, химия онлайн
Перейти на chemhelp.ru
22,9 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Просмотров 3.3к. Опубликовано 28.06.2022
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Как найти объем в химии ℹ️
Вы знаете, что один и тот же химикат любого вещества содержит одинаковое количество структурных единиц. Однако у каждого вещества есть своя структурная единица массы. Поэтому масса одной и той же химической массы разных веществ также отличается.
Молекулярная масса — это масса той части вещества, которая приходится на один моль химической массы.
Молекулярная масса вещества X обозначается символом m(x). Она равна отношению массы конкретного вещества M(x) (г или кг) к химической массе N(x) (моль).
В Международной системе единиц молекулярный вес выражается в кг/моль. В химии чаще используется единица измерения Г/моль.
Определите молекулярную массу углерода. Масса углерода в одном моле стехиометрической массы составляет 0,012 кг или 12 г. Поэтому:.
Молекулярная масса любого вещества численно равна его относительной молекулярной массе, выраженной в Г/моль.
На рисунке 47 показан пример веществ (H2O, CACO3и Zn) с одинаковой химической массой — 1 моль. Как видите, массы различных веществ с одним молем химической массы различны.
Молекулярный вес является важной характеристикой всех индивидуальных веществ. Она отражает взаимосвязь между массой вещества и его химическим количеством. Знание одной из этих величин позволяет определить массу другой — химической — величины.
И наоборот, химическое количество по массе:.
А также количество структурных подразделений:.
Связь между свойствами этих трех веществ в их кумулятивном состоянии можно представить с помощью простой диаграммы.
Формула и алгоритм нахождения объёма
Сегодня мы изучаем важный навык в химии — как находить количество различных растворов и других веществ. Эти знания необходимы, потому что они помогут вам решить многие проблемы как в тетради, так и в жизни. Все, что вам нужно знать, — это состоявшийся человек.
Важно понимать, что тип опухоли, которую нужно найти, может варьироваться в зависимости от сущности, которую нужно найти, а точнее, от общего состояния этой сущности. Типы нахождения объемов газа и жидкости противоположны друг другу.
Точный и правильный вид для нахождения объема жидкости: C = n/v.
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Используя другую задачу и другие данные, существует второй тип для нахождения объема жидкости: v = m/p.
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
Если в дополнение к объему вам нужно найти массу, вы можете сделать это, зная тип и количество интересующего вас вещества. Используя тип вещества, найдите его молекулярную массу, сложив атомные массы всех элементов, входящих в его состав.
Например, возьмем M(AUSO2). В наших расчетах мы должны получить 197 + 32 + 16 * 2 = 261 г/моль. После этих вычислений находим массу по типу m = n*m: где
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества обычно указывается в задаче. Если нет, то это может быть опечатка или ошибка в задаче, и вместо того, чтобы пытаться самостоятельно вычислить несуществующую цену, следует обратиться за помощью и объяснениями к преподавателю. В этой статье приведены основные алгоритмы типов и разрешений.
Существует также тип для определения количества газа. Это: v= n*vm:.
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Однако существуют определенные исключения. Исключением является то, что при нормальных условиях, т.е. при определенном давлении и температуре, объем газа постоянен и составляет 22,3 л/моль.
Также возможен третий вариант. Если сама задача содержит уравнения реакций, то решение должно проходить по-другому. Из полученных уравнений вы можете найти количество каждого вещества, равное коэффициенту. Например, Ch4 + 2O2 = CO2+H2O. Из этого уравнения следует, что при взаимодействии 1 моль метана и 2 моль кислорода образуется 1 моль углерода и 1 моль воды. Учитывая, что речь идет о количестве вещества одного компонента, нетрудно найти количества всех остальных веществ. Если количество метана составляет 0,3 моль, то n(Ch4) = 0,6 моль, n(CO2) = 0,3 моль и n(H2O) = 0,3 моль.
б) Газовые законы объем газа
В дополнение к приведенным выше формулам, для решения задач вычислительной химии часто необходимо использовать газовые законы, известные из физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
Комбинированный закон Бойля-Мариотта и Гей-Люссака для газов.
Кроме того, если известна масса или количество газа, его объем можно рассчитать по формуле Менделеева-Клапейрона
где n — число молекул вещества, m — масса (г), b — молекулярная масса газа (г/моль) и R — глобальная газовая постоянная, равная 8,31 Дж/(моль х К).
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, количество содержащегося вещества, количество содержащихся молекул, определение объема (v.o.), обнаружение массы, ее массовые частицы, масса определенных молекул, названия веществ, обнаружение массы молекул, определение абсолютной массы молекул, количество содержащихся атомов, относительная плотность. Определение.
Количество вещества — это число строительных блоков (атомов, молекул, ионов), содержащихся в конкретном образце этого вещества. Единицей измерения количества вещества является моль. Количество вещества (n) связано с числом строительных блоков (N), массой (m) и объемом (V) (для газообразных веществ при температуре нулевой концентрации), содержащихся в образце вещества, следующей формулой
В котором.
Vm = 22,4 л/моль (мл/моль, м 3/кмоль) в н.у., Na = 6,02-10 23 (постоянная Авогадро) и молекулярная масса (М) численно равна относительной молекулярной массе вещества:.
Существование такой связи означает, что знание одной из величин (количества, массы, объема или числа структурных единиц вещества) позволяет определить все остальные величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Вопрос 1: Сколько вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(CO2) = 0,75 моль.
Задача № 2. Сколько молекул содержится в 2,5 моль кислорода?
Ответ: n (O2) = 1,505-1024.
Внимание. В этом сборнике лекций вы будете решать задачи общей сложности. Решения сложных задач и задач с кратким ответом см. в конспекте лекций «Решение упражнений по количественным свойствам».
Задача №3. Определите объем (н.у.), занимаемый 0,25 моль водорода.
Задача № 4. Какова масса куска оксида серы (IV) в объеме 13,44 л (об.)?
Вопрос № 5. Если 3 моль кислорода O2Чтобы. Определите массу кислорода, его количество и число молекул кислорода.
Ответ: m = 96 g- v = 67. 2 l- n(o2) = 1.81-10 24.
Работа №6. масса водорода h2. Определите количество водорода, его количество se. Количество доступных молекул водорода.
Ответ: 5 моль-112 L- 3,01- 10 24.
Работа № 7. Пример количества хлора.2 Н.О.С. Найдите количество хлора, его массу и число молекул хлора.
Ответ: 2,5 моль- 177,5 г- 1,5- 10 24.
Работа № 8. 2.4-10 23. Есть молекулы монооксида углерода (IV) CO2. Определите количество углекислого газа, его массу и количество углекислого газа (Н.С.).
Ответ: 0,4 моль — 17,6 г — 8,96 л.
Вопрос нет. 9. какова масса участка оксида азота (IV), содержащего 4,816-10 23 точки? Каков его объем (Н.С.)?
Вопрос нет. 10. 1,806-10 Масса простого отрезка вещества, содержащего 24 точки, равна 6 г. Определите молекулярный вес вещества и назовите его.
Внимание. В данном пособии рассматриваются задачи нормальной сложности. Нажмите на кнопку ниже, чтобы перейти к решению задач на количество и краткому ответу …
Решайте задачи на количество, массу и объем. Выберите следующие шаги: 1.
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Молярный объем: общая информация
Чтобы рассчитать молекулярный вес химического вещества, молекулярный вес вещества делится на его плотность. Таким образом, молекулярный вес рассчитывается по следующему типу
где VM — молекулярный вес вещества, m — молекулярная масса, p — плотность. В международной системе СИ это количество измеряется в кубических метрах на моль (м 3 /моль).
Рисунок 1.Типы молекулярных опухолей.
Молекулярная масса газов отличается от молекулярной массы жидкостей и твердых тел тем, что один молярный элемент газа всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа.
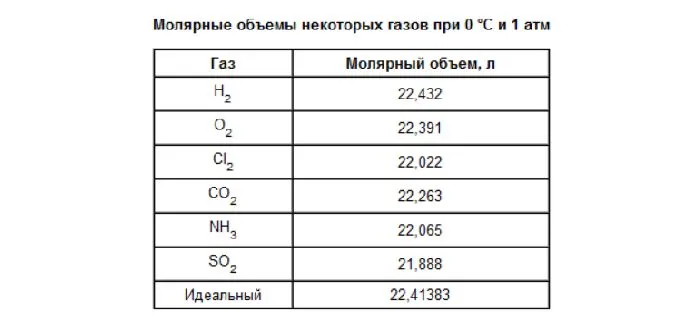
Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.
Молекулярная масса при нормальных условиях может быть получена с помощью законного уравнения для идеального газа, называемого уравнением Клайперона-Менделеева
Где r — глобальная постоянная газа, r = 8,314 дж/моль*k = 0,0821 л*атм/моль k
Объем молярного газа v = rt/p = 8,314*273,15/101,325 = 22,413 л/моль, где t и p — значения температуры (к) и давления при нормальных условиях.
Рисунок 2.Таблица молекулярных опухолей.
Закон Авогадро
В 1811 году А. Авогадро предположил, что равные объемы различных газов (температура и давление) содержат одинаковые молекулы. Впоследствии этот случай был подтвержден и стал законом, названным в честь великого итальянского ученого.
Рисунок 3: Амедео Авогадро.
Закон становится понятным, если вспомнить, что расстояние между частицами в виде газа несравненно больше, чем размер самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы.
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствия закона Авогадро и понятие молекулярного объема основаны на том, что молекулы любого вещества содержат число частиц (в случае газов и молекул), равное постоянной Авогадро.
Чтобы найти количество молей растворенного вещества в литре раствора, необходимо определить молекулярную концентрацию вещества по формуле c = n / V Где n — количество растворенного вещества, выраженное в молях; V — объем раствора, выраженный в литрах C — молекулярный.
При расчетах газа часто необходимо преобразовать заданные условия в нормальные и наоборот. Таким образом, полезно использовать уравнения, полученные из законов газовой связи Бойля-Мариотта и Гей-Люссака.
Молярный объем
В этом видео учащиеся вспоминают основные формулы и физические величины, знакомятся с новыми понятиями молекулярного объема и учатся решать задачи на основе новых материалов. Это значительно облегчает изучение новых тем.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других наборов, необходимо приобрести их в каталоге и добавить в личный кабинет.
Конспект урока «Молярный объем»
Молекулярный объем — это объем одного моля вещества. Понятие молекулярного объема применимо к газам. Например, если взять 1 моль воды, то 18 г воды не взвешивают на весах, потому что это совершенно неудобно. Зная, что плотность воды составляет 1 г/мл, мы измеряем ее объем в цилиндре или мензурке.
В этом случае молекулярный объем воды составит 18 мл/моль. Молекулярный объем твердых тел и жидкостей зависит от их плотности. Вода, кислота, сахар и соль имеют разную плотность и, следовательно, разный молекулярный объем.
Если проглотить одну молекулу кислорода, одну молекулу углекислого газа и одну молекулу водорода, то при одинаковых нормальных условиях они занимают одинаковый объем, равный 22,4 л. Эти газы также содержат одинаковое число частиц, т.е. 6,02-1023. Нормальные условия или a.c. — это температура 0°C (градусов Цельсия) и давление 760 мм рт.ст. (миллиметров рт.ст.) или 101,3 кПа (килопаскалей).
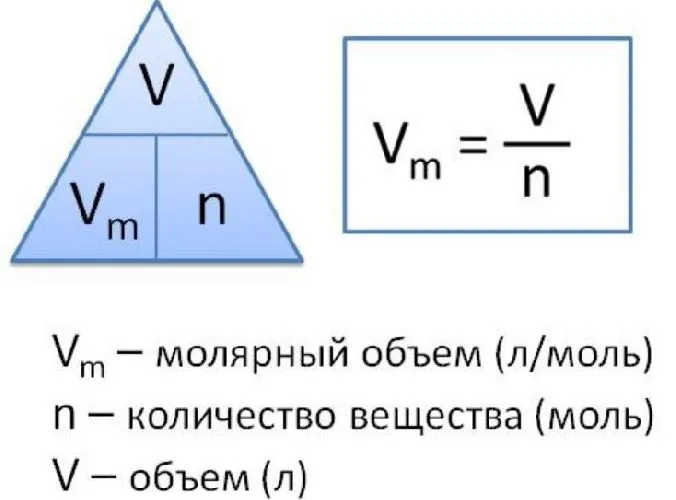
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Молекулярный объем — это также физическая величина, равная отношению объема вещества к количеству вещества. Он может быть записан в следующих типах форматов
Vm =
V — объем газа, а n — количество вещества.
Из этого уравнения также можно найти V.
V = n-Vm
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Объем 1 кмоль называется объемным объемом и измеряется в м 3 / кмоль. То есть 22,4 м 3 / кмоль, а объем 1 ммоль называется объемным объемом и измеряется в мл / моль. Другими словами, объем составляет 22, 4 мл/моль.
Используйте новую формулу для решения задачи.
1. найдите объем азота (N2 ) объемом 2 моль.
Найдите объем азота (N2) в объеме 2 моль. По условию, дано 2 моль азота. Найдите объем азота. Чтобы решить эту задачу, используйте уравнение, чтобы найти объем газа относительно объема вещества. Другими словами, умножьте объем молекулы на объем вещества. Подставьте значение в формулу. То есть 22,4 литра на моль, умноженные на 2 моля, дают 44,8 литра. Таким образом, 2 моль азота занимают объем 44,8 л.
2. найти объем озона (O3 ) имеет объем 67,2 литра.
Согласно этой задаче, учитывая объем озона — 67,2 литра, необходимо найти количество вещества озона. Чтобы решить проблему, используйте тип. Объем делится на молекулярный вес, и значения в формуле обмениваются. Итак, разделив 67,2 литра на 22,4 литра на молекулу, получаем 3 молекулы. Таким образом, 3 моль озона занимают объем 67,2 л.
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Закон объемных отношений
Если в результате реакции также образуется газ, напишите уравнение реакции между газами.
Соотношение объемов реактора и вещества: 2:1:2. Получим соотношение этих газовых опухолей при нормальных условиях.
Как видите, коэффициент газовой опухоли соответствует отношению предыдущего коэффициента типа вещества в уравнении.
В этой же ситуации объемы реакционных газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа. Это закон Гей-Лоссака о пропорциональности объемов.
Из изученных примеров можно сделать вывод, что при решении задачи удобно использовать коэффициенты, так как они указывают на количество вещества в уравнении химической реакции.
Согласно уравнению, определите количество кислорода, необходимое для окисления 60 л серы (IV) оксидом серы (VI).
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги в области химии:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не предназначены для получения коммерческой и/или иной выгоды.
Этот сайт предназначен для облегчения образовательного пути студентов. Наталья Брилёнова не предлагает и не оказывает товары и услуги.
Обязательно ссылайтесь на сайт Natalibrilenova.ru в случае создания копий материалов.
Как найти объем в химии
Для того, чтобы определить объем вещества, нужно выяснить, в каком агрегатном состоянии оно находится – газ, либо раствор. Далее приведены соответствующие формулы.
Для нахождения объема растворов:
1. V = m/p, где V – объем раствора(мл), m – масса(г), p – плотность(г/мл). Если требуется дополнительно найти массу, то это можно сделать, зная формулу и количество нужного вещества. С помощью формулы вещества мы найдем его молярную массу, сложив атомные массы всех элементов, входящих в его состав. Например, M(AgNO3) = 108+14+16*3 = 170 г/моль. Далее находим массу по формуле: m = n*M, где m – масса(г), n – количество вещества(моль), M – молярная масса вещества(г/моль). Подразумевается, что количество вещества дано в задаче.
2. Следующая формула для нахождения объема раствора выводится из формулы молярной концентрации раствора: с = n/V, где c – молярная концентрация раствора(моль/л), n – количество вещества(моль), V – объем раствора(л). Выводим: V = n/c. Количество вещества можно дополнительно найти по формуле: n = m/M, где m – масса, M – молярная масса.
Для нахождения объема газов:
1. q(x) = V(x)/V, где q(x)(фи) – объемная доля компонента, V(x) – объем компонента (л), V – объем системы (л). Из этой формулы можно вывести 2 другие: V(x) = q*V, а также V = V(x)/q.
2. Если в условии задачи присутствует уравнение реакции, решать задачу следует с помощью него. Из уравнения можно найти количество любого вещества, оно равно коэффициенту. Например, CuO + 2HCl = CuCl2 + H2O. Отсюда видим, что при взаимодействии 1 моля оксида меди и 2 моль соляной кислоты получилось 1 моль хлорида меди и 1 моль воды. Зная по условию задачи количество вещества всего одного компонента реакции, можно без труда найти количества всех веществ. Пусть, количество вещества оксида меди равно 0,3 моль, значит n(HCl) = 0,6 моль, n(CuCl2) = 0,3 моль, n(H2O) = 0,3 моль
Концентрация
раствора – это величина, отражающая
пропорции между растворенным веществом
и растворителем. Такие качественные
понятия, как «разбавленный» и
«концентрированный», говорят только о
том, что раствор содержит мало или много
растворенного вещества. Для количественного
выражения концентрации растворов часто
используют проценты (массовые или
объемные), а в научной литературе –
число молей или химических эквивалентов
растворенного вещества на единицу
массы или объема растворителя либо
раствора.
Важной
характеристикой растворов служит их
концентрация, кот-я выраж-т относит-е
кол-во компонентов в р-ре. Различ-т
массовые и объемные концентрации,
размерные и безразмерные.К безразмерным
концентрациям
(долям) отн-ся:
1.Массовая
доля — отношение массы
растворённого вещества к массе раствора.
Массовая доля измеряется в долях единицы.
ωв
=mв-ва/mр-ра*100%
2.Объёмная
доля — отношение объёма
растворённого вещества к объёму раствора.
Объёмная доля измеряется в долях единицы
или в процентах.
φ=
V1/V
V1–
объём растворённого вещества, л
V–
общий объём раствора, л.
3.Молярная
концентрация (молярность)
— количество растворённого вещества
(число молей) в единице объёма раствора.
Молярная концентрация в системе СИ
измеряется в моль/м³, однако на практике
её гораздо чаще выражают в моль/л или
ммоль/л. Также распространено выражение
в «молярности». Возможно другое
обозначение молярной концентрации CM
, которое принято обозначать М.
ν
— количество растворённого вещества,
моль;
V
— общий объём раствора, л.
4.Моляльность
– количество растворённого
вещества (число молей) в 1000 г растворителя.
Сm=n/m1*1000
Сm=n/m2-m3*1000
Сm=m3/M(m2-m3)*1000,
где
m1-масса раствора m2-масса
растворителя m3-растворенного
вещества
5.Мольная
доля-отношение число
гр.молекул данного вещества к общему
числу гр.молекул всех веществ им-ся в
растворе. Мольную долю выражают в
долях единицы.
N=n2/n1+n2,
где
n1-число
растворителя n2-число
грамм молекул растворенного вещества
6.Титр
раствора — масса
растворённого вещества в 1 мл раствора.
где:
m1
— масса растворённого
вещества, г;
V
— общий объём раствора, мл;
7.Нормальность
– количество эквивалентов
данного вещества в 1 литре раствора.
Нормальную концентрацию выражают
в моль-экв/л или г-экв/л (имеется в виду
моль эквивалентов)
Сн=m/mЭ*V
,
где
m-раствор.в-ва, mЭ-масса
эквивалентов в гр.
9.
Теория электролитической диссоциации.
Основные положения ТЭД.
Степень
и константа диссоциации. Диссоциации
сильных и слабых
электролитов.
Диссоциация соединений с ионным и
ковалентно-полярным
видом связи.
Для
объяснения особенностей водных растворов
электролитов шведским ученым С.Аррениусом
в 1887 г. была предложена ТЭД. В дальнейшем
она была развита многими учеными на
основе учения о строении атомов и
химической связи.
Вещества,
распадающиеся на ионы в растворах или
расплавах и потому проводящие эл.ток,
называются электролитами. К таким
веществам относятся соли, щелочи и
кислоты. В этих веществах преобладает
ионная связь. Вещества, которые в
тех же условиях на ионы не распадаются
и Эл.ток не проводят, называются
неэлектролитами. К таким веществам
относятся кислород, азот, водород, метан
и др. В этих веществах характерна
ковалентная связь.
Соврем-е
содерж-е этой теории можно свести к 3
положениям:
1.
Электролиты при растворении в воде
распадаются (диссоциируют) на ионы –
положительные и отрицательные. Ионы
нах-ся в более устойчивых электронных
состояниях, чем атомы. Они могут состоять
из одного атома – это простые ионы (Na+,
Mg2+, Аl3+ и т.д.) – или из нескольких
атомов – это сложные ионы (NО3-,
SO2-4, РОЗ-4и т.д.).
2.
Под действием электрич-о тока ионы
приобр-т направленное движение:
положительно заряж-е ионы движутся к
катоду, отрицательно заряж-е – к аноду.
Поэтому первые наз-ся катионами, вторые
– анионами. Направленное движение ионов
пр-т в рез-те притяжения их противоположно
заряженными электродами.
3.
Диссоциация – обратимый процесс:
параллельно с распадом мол-л на ионы
(диссоциация) протекает процесс соединения
ионов (ассоциация).Поэтому в ур-х
электролитической диссоциации вместо
знака равенства ставят знак обратимости.
Напр, ур-е диссоциации мол-лы электролита
КA на катион К+ и анион А– в
общем виде записывается так: КА↔К+
+ А–
ТЭД
яв-ся одной из основных теорий в
неорг-ой химии и полностью согласуется
с атомно-молекулярным учением и теорией
стр-я атома.
Т.к.
электролитическая диссоциация-проц
обратимый, то в р-рах электролитов наряду
с их ионами присут-т и мол-лы. Поэтому
р-ры электролитов харак-ся степенью
диссоциации (α).
Степень
диссоциации – это отнош-е
числа распавшихся на ионы молекул N’
к общему числу растворенных мол-л N:
Степень
диссоциации электролита опр-ся опытным
путем и выражается в долях единицы или
в процентах. Если α = 0, то диссоциация
отсутствует, а если α = 1 или 100%, то
электролит полностью распадается на
ионы. Если же α = 20%, то это означает, что
из 100 молекул данного электролита 20
распалось на ионы.Различные электролиты
имеют различную степень диссоциации.
Опыт показывает, что она зависит от
концентрации электролита и от температуры.
С уменьшением концентрации электролита,
т.е. при разбавлении его водой, степень
диссоциации всегда увеличивается. Как
правило, увеличивает степень диссоциации
и повышение температуры. По степени
диссоциации электролиты делят на сильные
и слабые.
Состояние
равновесия в
любом обратимом процессе, том числе
электролитической диссоциации, можно
охарактеризовать с помощью константы
равновесия,
которую
в данном случае называют константой
диссоциации слабого
электролита.
Кд=[K+][A–]/[KA]
Применительно
к прочности комплксноых соединений
константу диссоциации называют константой
нестойкости.
Чем меньше константа нестойкости
комплекса, тем в меньшей степени он
распадается на ионы, тем устойчивее это
соединение.
Чем
выше константа, тем легче электролиты
диссоциируют. Многооснов к-ты диссоциируют
ступенчато
Н2СО3=Н++НСО3–
К1=[Н+][НСО3–]/[Н2СО3]
НСО3–=Н++СО32-
К2=[Н+][СО32-]/[НСО3–]
Н2СО3=
2Н++СО32-
К=[Н+]2
[СО32-]/[Н2СО3]
К=К1+К2
КА=К++А–
Кд=[К+]
[А–]/[КА]
Сильные
электролиты – это
соединения, которые в водных растворах
практически полностью диссоциируют на
ионы. У таких электролитов степень
диссоциации стремится к единице. Сильными
электролитами яв-ся почти все соли (том
числе и орг. Кислот.), некоторые неогр.
Кислотыт(HNO3,HCl,
HI, H2SO4),
Щелочи (LiOH, NaOH,
KOH, CsOH,
Ca(OH)2.
Слабые
электролиты,
напротив в незначительной степени
распадаются на ионы, их степень диссоциации
значительно меньше единицы. К слабым
электролитам от-ся органич. кис-ты
(НСООН,C6H5COOH),многие
неогр.кислоты (H2S,
H2CO3,
HCN),
гидрат аммиака NH3*H2O,
вода.
Степень
диссоциации зависит
от концентрации электролита в
растворе. Разбавленные раствора всегда
усиливает диссоциацию ве-ва.
Механизм
электролитической диссоциации ионных
веществ
При
растворении соединений с ионными связями
(например, NaCl) процесс гидратации
начинается с ориентации диполей воды
вокруг всех выступов и граней кристаллов
соли.
Ориентируясь
вокруг ионов кристаллической решетки,
молекулы воды образуют с ними либо
водородные, либо донорно-акцепторные
связи. При этом процессе выделяется
большое количество энергии, которая
называется энергией гидратации.
Энергия
гидратации, величина которой сравнима
с энергией кристаллической решетки,
идет на разрушение кристаллической
решетки. При этом гидратированные ионы
слой за слоем переходят в растворитель
и, перемешиваясь с его молекулами,
образуют раствор.
Механизм
электролитической диссоциации полярных
веществ
Аналогично
диссоциируют и вещества, молекулы
которых образованы по типу полярной
ковалентной связи (полярные молекулы).
Вокруг каждой полярной молекулы вещества
(например, HCl), определенным
образом ориентируются диполи воды. В
результате взаимодействия с диполями
воды полярная молекула еще больше
поляризуется и превращается в ионную,
далее уже легко образуются свободные
гидратированные ионы.
10.
Окислительно-восстановительные реакции.
Реакции, идущие с изменением степени
окисления. Классификация
окислительно-восстановительных
реакций. Окислители и восстановители,
процессы окисления и восстановления.
Шкалы окисления элементов.
Все хим реакции
можно разделить на 2
типа. К 1типу
отн-ся реакции, протек-е без
изм-я степени окисления атомов,
вход-х в состав реагир-х в-в. Например:
=
Как видно, степень
окисления каждого из атомов до и после
реакции осталась без изменения. Ко 2
типу относятся
реакции, идущие с
изм-ем степени окисления атомов
реагир-х в-в. Например:
=
атомы брома и хлора изменяют степень
окисления.
Реакции, протек-е с
изм-ем степени окисления атомов, входящих
в состав реагир-х в-в, называются
окислительно-восстановительными.
Изм-е степени
окисления связ-о с оттягиванием или
перемещ-ем электронов. ОВР – самые
распростр-е и играют большую роль в
природе и технике. Основные положения
теории ОВР. 1. Окислением
наз-ся процесс отдачи электронов атомом,
мол-ой или ионом. Напр:
Al – 3e- =
Al3+
Fe2+
– e- = Fe3+
H2
– 2e- = 2H+
2Cl–
– 2e- = Cl2
При окислении степень
окисления повышается.
2. Восстановлением
наз-ся процесс присоед-я электронов
атомом, молекулой или ионом. Напр:S
+ 2е- = S2-
Сl2
+ 2е- = 2Сl–
Fe3+
+ e-
= Fe2+
При восстановлении
степень окисления понижается.
3. Атомы, мол-лы или
ионы, отдающие электроны наз-ся
восстановителями.
Во время реакции они окисляются. Атомы,
мол-лы или ионы, присоед-ие электроны,
называются окислителями.
Во время реакции они восстанавливаются.
Т.к. атомы, мол-лы и ионы входят в состав
опр в-в, то и эти в-ва соответственно
наз-ся восстановителями
или окислителями.
4. Окисление всегда
сопровожд-ся восстан-ем, и наоборот,
восстановление всегда связано с
окислением, что можно выразить уравнениями:
Восстановитель –
е- Окислитель
Окислитель + е-
Восстановитель
Поэтому ОВР представ-т
собой единство двух противопол-х проц-в
– окис-я и восстан-я. Число электронов,
отдаваемых восстановителем, равно
числу электронов, присоединяемых
окислителем.
Межмолекулярные
ОВР. Окислитель
и восстановитель нах-ся в разных в-вах;
обмен электронами в этих реакциях пр-т
му различными атомами или мол-ми:
S0 + O20
= S+4O2-2
S – восстановитель;
O2
– окислитель
Cu+2O
+ C+2O
=Cu0
+ C+4O2
CO – восстановитель;
CuO – окислитель
Zn0
+ 2HCl
= Zn+2Cl2
+ H20
Zn – восстановитель;
HСl – окислитель
Сюда же отн-ся реакции
му в-ми, в кот-х атомы одного и того же
элемента им-т разные степени окисления
H2S-2
+ H2S+4O3
= 3S0
+ 3H2O
Внутримолекулярные
ОВР. Во
внутримолекулярных реак-х окислитель
и восстановитель нах-ся в одной и той
же мол-ле. Внутримолек-е реакции протекают,
как правило, при термическом разложении
в-в, содерж-х окислитель и восстановитель.
2KCl+5O3-2
® 2KCl-1
+ 3O20
Cl+5
– окислитель; О-2
– восстановитель
t
N-3H4N+5O3
= N2+1O
+ 2H2O
N+5
– окислитель; N-3
– восстановитель
2Pb(N+5O3-2)2
=2PbO
+ 4N+4O2
+ O20
N+5
– окислитель; O-2
– восстановитель
Диспропорционирование
– ОВР, в которой один элемент одноврем-но
повышает и понижает степень окисления.
Cl20
+ 2KOH =KCl+1O
+ KCl-1
+ H2O
3K2Mn+6O4
+ 2H2O
=2KMn+7O4
+
Mn+4O2
+
4KOH
3HN+3O2
=HN+5O3
+ 2N+2O
+ H2O
2N+4O2
+ 2KOH =KN+5O3
+ KN+3O2
+
H2O
Шкала.
→ отдача
электронов, окисление, -ne
← присоединение
электронов, восстановление, + ne
-4 -3 -2 -1 0
+ 1 + 2 + 3 + 4 + 5 + 6 + 7
11.
Способы подбора и расстановки коэффициентов
в уравнениях ОВР. Роль среды в
окислительно-восстановительных реакциях.
Стандартные окислительно-восстановительные
потенциалы, их использование для оценки
направленности процессов.
Электронный
баланс
– метод нахождения коэфф-в в уравнениях
ОВР, в кот-м рассматрив-ся обмен электронами
му атомами элементов, изменяющих свою
степень окисления. Число электронов,
отданное восстановителем равно числу
электронов, получаемых окислителем.
Ур-е состав-ся в неск-ко стадий:
1.Записывают
схему реакции.
KMnO4
+ HCl
=KCl
+ MnCl2
+
Cl2
+ H2O
2.Проставляют
степени окисления над знаками элементов,
кот-е меняются.
KMn+7O4
+ HCl-1
= KCl + Mn+2Cl2
+
Cl20
+ H2O
3.Выделяют
элементы, изменяющие степени окисления
и опр-т число электронов, приобретенных
окислителем и отдаваемых восстановителем.
Mn+7
+ 5ē = Mn+2
2Cl-1
– 2ē = Cl20
4.Уравнивают
число приобретенных и отдаваемых
электронов, устанавливая тем самым
коэффициенты для соединений, в кот-х
присут-ют элементы, измен-щие степень
окисления.
Mn+7
+ 5ē = Mn+2 2
2Cl-1
– 2ē= Cl20 5
––––––––––––––––––––––––
2Mn+7
+ 10Cl-1
= 2Mn+2
+ 5Cl20
5.Подбирают
коэффиц-ты для всех остальных участников
реакции.
2KMn+7O4
+ 16HCl-1=
2KCl + 2Mn+2Cl2
+ 5Cl20
+ 8H2O
Электронно-ионный
баланс (метод полуреакций)
метод нахождения коэффиц-в, в кот-м
рассматр-ся обмен электронами му ионами
в р-ре с учетом хар-ра среды:
2Cl1-
– 2ē ® Cl20 5
MnO41-
+ 8H+
+ 5ē = Mn2+
+ 4H2O 2
7+
2+
––––––––––––––––––––––––––––––––––––––
10Cl–
+ 2MnO41-
+ 16H+
=5Cl20
+ 2Mn2+
+ 8H2O
(для
уравнивания ионной полуреакции используют
H+,
OH–
или воду)
Типичные
реакции окисления-восстановления.
Реакции
с участием перманганата калия в качестве
окислителя
При
взаимод-и перманганата калия с
восстановителем обр-ся различные
продукты восстановления в завис-ти от
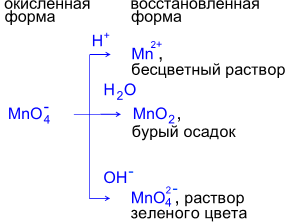
pH среды.
Реакции
в
кислой
среде.
5K2S+4O3
+ 2KMn+7O4
+
3H2SO4
=6K2S+6O4
+ 2Mn+2SO4
+
3H2O
электронный
баланс
Mn+7
+ 5ē = Mn+2 2
S+4
– 2ē = S+6 5
метод
полуреакций
MnO4-
+ 8H+
+ 5ē =Mn2+
+ 4H2O 2
SO32-
+ H2O
– 2ē=SO42-
+ 2H+ 5
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4-
+ 16H+
+ 5SO32-
+ 5H2O
=2Mn2+
+ 8H2O
+ 5SO42-
+ 10H+
или
2MnO4-
+ 6H+
+ 5SO32-
=2Mn2+
+ 3H2O
+ 5SO42-
Фиолетовый
р-р KMnO4
обесцвечивается при добавлении р-ра
K2SO3.
Реакции
в нейтральной среде
3K2S+4O3
+ 2KMn+7O4
+
H2O
=3K2S+6O4
+2Mn+4O2¯
+ 2KOH
электронный
баланс
S+4
– 2ē =S+6 3
Mn+7
+ 3ē = Mn+4 2
метод
полуреакций:
MnO41-
+ 2H2O
+ 3ē = MnO2 + 4OH– 2
SO32-
+ 2OH–
– 2ē = SO42-
+ H2O 3
2MnO4–
+ 4H2O + 3SO32-
+ 6OH–
® 2MnO2 + 8OH–
+ 3SO42-
+ 3H2O
или
2MnO4–
+ H2O + 3SO32-
® 2MnO2 + 2OH- + 3SO42-
Фиолетовый
р-р KMnO4 после окончания реакции
обесцвечивается и набл-ся выпадение
бурого осадка.
Реакции
в щелочной среде.
K2S+4O3
+ 2KMn+7O4
+ 2KOH
® K2S+6O4
+2K2Mn+6O4
+ H2O
электронный
баланс
S+4
– 2ē = S+6 1
Mn+7
+ 1ē = Mn+6 2
метод
полуреакций:
SO32-
+ 2OH–
– 2ē =SO42-
+ H2O 1
MnO41-
+ ē ® MnO42- 2
SO32-
+ 2OH–
+ 2MnO4–
® SO42-
+ H2O + 2MnO42-
Фиолетовый
р-р KMnO4
превращается в зеленоватый раствор
K2MnO4.
Т.о.,
Электродный
потенциал. Уравнение Нернста. Если
пластину любого металла погрузить в
воду или р-р электролита, содерж-й ионы
этого металла, то небольшая часть металла
перейдет в раствор, в форме положительно
заряженных ионов, а сама пластина,
концентрируя на себе избыток свободных
электронов, приобретает отрицательный
заряд. Такому переходу содействует
связывание ионов металла с молекулами
воды (растворителя).В итоге устанав-ся
равновесие
Me
↔
Me2+
+
2e
Me2+
+ m H2O
↔
Me2+
·
m H2O
Me
+ m H2O
↔
Me2+
·
m H2O
+2e
Положительно
заряженные ионы Me+2,
перешедшие в раствор, концентрируются
у поверхности пластины, приобретающей
отрицательный заряд, в рез-те возник-т
двойной электрический слой (ДЭС),
обусловлив-й резкий скачок электрического
потенциала на границе металл – раствор
электролита. Эту разность электрических
потенциалов или скачок потенциала на
границе металл-раствор электролита
наз-т электродным
потенциалом. Величина
электродного потенциала зав-т от природы
металла, концентрации, точнее активности
ионов металла в растворе и температуры.
Математически
эта завис-ть выраж-ся ур-ем В.Г.Нернста
(1888).
EMe
=
E0Me
+ (R ∙T/n ·F) / ln аMen+,
а
в случае разбавленных
растворов полностью диссоциирующих
солей данного металла
ЕMe
=
E0Me
+
(R∙T/n · F) / ln
[Men+
],
где
E0Me–
стандартный электродный потенциал
R-
универсальная
газовая
постоянная
F-
постоянная Фарадея
n
– заряд иона металла
аMe,n+
,
[
Men+]
– активность или концентрация ионов
металла (мольл)
После
перехода от натурального логарифма к
десятичному и подстановки значений
R=8,314Джмоль·
К
T=298,15
К
F=96500
Кл, точнее 96487 Кл уравнение примет
вид
EMe
=
E0Me
+
0,0592/n ·lg
[Men+]
Стандартные
электродные потенциалы. Эксперимент-но
опр-ть абсолютное знач-е электродного
потенциала невозможно. Поэтому на
практике измер-ся разность потенциалов
му электродным потенциалом исследуемой
системы и потенциалом электрода
сравнения. В качестве стандартного
электрода сравнения использ-т водородный
электрод.
2Н++2е
↔
Н2
(твердая фаза) ,кот-е
харак-ся опр значением скачка потенциала
на межфазной границе. Электродный
потенциал называется стандартным
водородным потенциалом Е02Н+/H2,
а его значение принято равным нулю.
Сочетая
электрод исследуемой ОВ системы со
стандартным водородным электродом
опр-т потенциал Е данной системы.
Потенциалы,
измеренные при температуре равной 250С,
Р=101,325кПа и концентрации ионов 1 моль/л
называются
стандартными электродными потенциалами
Е0
или окислительно – восстановительным
или редокс – потенциалами.
В таблице распол-ны в порядке их
возрастания, что соответ-т падению
восстановительной и росту окислительной
активности.
Система
с большим электродным потенциалом
всегда яв-ся окислителем по отношению
к системе с меньшим потенциалом.
1)
чем меньше электродный потенциал металла
Е0
,тем
легче он окисляется и труднее
восстанавливается из своих ионов. Чем
меньше алгебраическая величина
потенциала, тем выше восстановительная
способность этого металла и тем ниже
окислительная способность его ионов
(в ряду стандартных электродных
потенциалов).2) металлы, имеющие
отрицательные значения электродных
потенциалов , стоящие левее водорода,
способны его вытеснять из разбавленных
растворов кислот.3) каждый металл способен
вытеснять (восстанавливать) из растворов
солей те металлы, которые имеют более
высокий электродный потенциал. 4) с
ростом потенциала полуреакций
окислительная
форма/ восстановительная форма (сверху
вниз) в ряду стандартных электродных
потенциалов уменьшаются восстановительные
свойства восстанавленной формы и
увеличиваются окислительные свойства
окисленной формы.
12.
Периодический закон. Периодическое
изменение свойств химических элементов
(потенциала ионизации, сродства к
электрону, радиуса атомов и
электроотрицательности), а также простых
и сложных веществ на примере высших
оксидов и гидроксидов элементов второго
и третьего периодов.
Периодический
закон – один из важнейших законов химии.
Этот
закон открыл 1 марта 1896 г. великий русский
учёный-химик Дмитрий Иванович Менделеев
(1834 -1907). Попытка классифицировать
химические элементы имели место и до
Менделеева, замечая сходство некоторых
элементов, объединяли их отдельные
группы (Мейер), отмечали, что свойства
веществ в порядке возрастания атомного
веса повторяются через семь элементов
(Ньюлендс), выделяли триады элементов,
в которых свойства среднего элемента
являлись средними между мвойствами
крайных элементов (Доберейнер). В этих
работах не было теоретических обобщений,
не было найдено причины замеченных
изменений свойств.
В
середине XIX в. было известно около 63
химических элементов. Д.И. Менделеев
полагал, что должен существовать закон,
который объединяет все химические
элементы. Менделеев считал, что главной
характеристикой элемента является его
атомная масса. Поэтому он расположил
все известные элементы в один ряд в
порядке увеличения их атомной массы.
В
ряду от Li до F металлические свойства
элементов ослабляются, а неметаллические
свойства усиливаются. Аналогично
изменяются свойства элементов в ряду
от Na до Cl. Следующий элемент K, как Li и
Na, является типичным металлом.
Высшая
валентность элементов увеличивается
от 1 у Li до 5 у N (кислород и фтор имеют
постоянную валентность, соответственно
II и I) и от I у Na до VII у Cl. Следующий элемент
K, как Li и Na, имеет валентность I.
В
ряду оксидов от Li2O до N2O5
и гидроксидов от LiOH до HNO3 основные
свойства ослабляются, а кислотные
свойства усиливаются. Аналогично
изменяются свойства оксидов и гидроксидов
в ряду от Na2O и NaOH до Cl2O7
и HClO4. Оксид калия K2O как и
оксиды лития и натрия Li2O и Na2O,
является основным оксидом, а гидроксид
калия KOH, как и гидроксиды лития и натрия
LiOH и NaOH, являются типичным основанием.
Аналогично
изменяются формы и свойства водородных
соединений неметаллов от CH4 до HF
и от SiH4 до HCl.
Такой
характер изменения свойств элементов
и их соединений, какой наблюдается при
увеличении атомной массы элементов,
называется периодическим изменением.
Свойства всех химических элементов при
увеличении атомной массы изменяются
периодически.
Менделеев
назвал элементы, попавшие в один
вертикальный ряд, группой, и внизу каждой
группы поставил формулу окисла,
свойственную всем элементам, попавшим
в одну группу. Элементы 4,5,6 и 7 группы
образует соединения с водородом, общие
формулы которых также поставлены в
периодической таблице.
Периодического
закона: свойства элементов, а также
формы и свойства их соединений находятся
в периодической зависимости от величины
положительного заряда ядра их атомовю
Таким
образом, металлическое свойства наиболее
ярко выражены у элементов, находящихся
в левом нижнем углу перод.таблицы, а
неметаллические св-ва ярче выражены у
элементов, занимающих верхний правый
угол таблицы. Условная граница, отделяющая
металлы от неметаллов, проходит по линии
от верхней средней точки к нижнему
правому углу; элементы, расположенные
вблизи этой прямой, характеризуются
промежуточными св-вами. Таковы элементы:
бор, кремний, германий, мышьяк, сурьма,
теллур и полоний.
Потенциал
ионизации. Потенциал ионизации
представляет собой энергию, необходимую
для отрыва наиболее слабо связанного
электрона из атома в его нормальном
состоянии. Может быть выражено в кДж/моль
или эВ/атом. Наименьшие потен иониз у
щелоч-х мет, наибольшее у инертных газов.
Сродство
к электрону. Сродством к электрону
называется энергетический эффект F
процесса присоединения электрона к
нейтральному атому Э с превращением
его в отрицательный ион Э–: Э +
е- = Э– ± F
Сродство
к электрону может быть выражено в
кДж/моль или эВ/атом. Сродство к электрону
численно равно, но противоположно по
знаку энергии ионизации отрицательно
заряженного иона Э–.
Надежные
значения сродства к электрону найдены
лишь для небольшого числа элементов.
Понятно, что сродство к электрону
зависит от электронной конфигурации
атома, и в характере его изменения с
увеличением порядкового номера элемента
наблюдается отчетливо выраженная
периодичность. Сравнение с изменением
энергии ионизации показывает, что
максимумы и минимумы на кривой сродства
к электрону смещены по сравнению с
кривой энергии ионизации на один
элемент влево.
Выделением
энергии сопровождается присоединение
одного электрона к атомам кислорода,
серы, углерода и некоторым другим. Таким
образом, для указанных элементов силы
притяжения к ядру дополнительного
электрона оказываются большими, чем
силы отталкивания между дополнительным
электроном и электронной оболочкой
атома. Присоединение последующих
электронов, т. е. двух, трех электронов
и более к атому, согласно квантовомеханическим
расчетам, невозможно. Поэтому одноатомные
(простые) многозарядные анионы (О2-,
S2-, N3-) в свободном состоянии
существовать не могут. Наибольшие
сродство к электрону у галогенов,
наименьшие у мет.
Электроотрицательность.
Понятие электроотрицательности (ЭО)
– способность атома притягивать к себе
валентные электроны др элемен.
Очевидно, что эта способность зависит
от энергии ионизации атома и его сродства
к электрону. ЭО не может быть выражена
в ед-х каких либо физическ величин,
поэтому для ее количественного определения
предложены несколько шкал, одна из них
разработана Полингом. по его шкале ЭО
фтора(наиболее ЭО) условно принято =4;
на 2ом месте О2; 3ем N и CI. Имеется
около 20 шкал электроотрицательности,
в основу расчета значений которых
положены разные свойства веществ.
Значения ЭО разных шкал отличаются,
но относительное расположение элементов
в ряду электроотрицательностей
примерно одинаково.
Строго
говоря, элементу нельзя приписать
постоянную ЭО. Она зависит от многих
факторов, в частности от валентного
состояния элемента, типа соединения, в
которое он входит, и пр. Тем не менее,
это понятие полезно для качественного
объяснения свойств химической связи
и соединений.
Атомные
и ионные радиусы
Вследствие
волнового характера движения электрона
атом не имеет строго определенных
границ. Поэтому измерить абсолютные
размеры атомов невозможно. За радиус
свободного атома можно принять
теоретически рассчитанный так называемый
орбитальный радиус – это расстояние
от ядра до наиболее удаленного от него
максимума функций радиального
распределения электронной плотности.
Для любого атома может быть только один
орбитальный радиус в нормальном состоянии
и сколько угодно в возбужденном.
Практически приходится иметь дело с
радиусами атомов, связанных друг с
другом тем или иным типом химической
связи. Такие радиусы следует рассматривать
как некоторые эффективные (т, е,
проявляющие себя в действии) величины.
Эффективные радиусы определяют при
изучении строения молекул и кристаллов.
Изменение
атомных и ионных радиусов в периодической
системе имеет периодический характер.
В периодах атомные и ионные радиусы
по мере увеличения заряда ядра в общем
уменьшаются. Наибольшее уменьшение
радиусов наблюдается y элементов
малых периодов, так как у них происходит
заполнение внешнего электронного
слоя. В больших же периодах в пределах
семейств d- и f-элементов наблюдается
более плавное уменьшение радиусов. Это
уменьшение называется соответственно
d- и f-сжатием.
В
подгруппах эффективные радиусы атомов
увеличиваются из-за роста числа
электронных слоев. При этом в подгруппах
s- и р-элементов рост эффективных радиусов
происходит в большей мере по сравнению
с подгруппами d-элементов.
Существенно
подчеркнуть еще одну особенность для
подгрупп d-элементов. Увеличение атомных
и ионных радиусов в подгруппах d-элементов
в основном отвечает переходу от элемента
4-го к элементу 5-го периода. Соответствующие
же радиусы d-элементов 5-го и 6-го периодов
данной подгруппы примерно одинаковы.
Это объясняется тем, что увеличение
радиусов за счет возрастания числа
электронных слоев при переходе от 5-го
к 6-му периоду компенсируется f
-сжатием, вызванным заполнением 4 f
-подслоя у f -элементов 6-го периода.
При аналогичных электронных конфигурациях
внешних слоев и примерно одинаковых
размерах атомов и ионов для d-элементов
5-го и 6-го периодов данной подгруппы
характерна особая близость свойств.
13.
Периодическая система элементов Д.И.
Менделеева. Структура периодической
системы. Различные
варианты периодической таблицы.
Групповая, типовая, электронная аналогия.
Кайносимметрия. Горизонтальная и
диагональная аналогии. Верхняя и нижняя
границы системы.
Основной
закон химии – ПЗ был открыт Д.И.Менделеевым.
в основу ПЗ Д.И.Менделеев положил атомные
массы и хим св-ва эл-в. Д.И.Менделеев
получил естественный ряд хим эл-в, в
кот-м он обнаружил периодическую
повторяемость хим св-в. ПЗ в формулировке
Д.И.Менделеева: свойства простых тел,
а также формы и свойства соединений
эл-в нах-ся в периодической зависимости
от величины атомных весов эл-в.
Периодический
закон является фундаментальным законом
природы, отражающим единство количественной
(заряд ядра, число электронов, атомная
масса) и качественной (распределение
электронов, совокупность свойств)
характеристик элементов.
Совокупность
этих характеристик должна обеспечивать
инвариантность положения элемента в
таблице
На
основе ПЗ Д.И.Менделеев создал ПС хим
эл-в. Она состоит из 7 периодов
(горизонтальные делится на малые и
большие ряды), 8 групп (вертикальные
делится на главную и побочную). В главных
подгруппах хим св-ва меняются от немеет
к мет.
Форма
ПС предложенная Д.И.Менделеевым, наз-ся
короткопериодной или классической. В
наст вр используется др форма ПС
длиннопериодная, в которой все периоды
– малые и большие – вытянуты в длинные
ряды.
В
группы ПС объединяются элементы с
одинаковым общим числом электронов
достраивающихся оболочках независимо
от их типа. Подобное объединение позволяет
выделить наиболее общий вид аналогии,
который называется групповой
аналогией и просматривается
только в высшей степени окисления,
отвечающей номеру группы. Групповая
аналогия далеко формируется по наиболее
общему признаку — числу валентных
электронов — без учета типа валентных
орбиталей.
Эл-ты,
принадлежащие к одной подгр, обладают
более близким сходством в свойствах, в
основе которого лежит одинаковый тип
валентных орбиталей заполняющихся
электронами. Эта более глубокая аналогия
называется типовой аналогией.
Таким образом, элементы, принадлежащие
одной подгруппе, являются тип – аналогами.
Пример Ш группы бор, алюминий и подгрупп
галлия, образующие главную подгруппу
(или Ш А-группу). являются тип –аналогами,
поскольку для всех этих эл-тов характерен
одинаковый тип валентных орбиталей
(ns2np1). Элементы подгруппы
скандия. образующие побочную подгруппу
Ш группы (или Ш В-группу), также яв-ся му
собой тип – аналогами (валентная
электронная конфигурация (n-1)d1ns2).
Элементы
малых периодов (2-го и 3-го) с точки зрения
электронного строения харак-ся
качественным своеобразием по сравнению
со всеми остальными элементами. Это
своеобразие заключается в том, что у
элементов 2го и 3го периодов под валентной
электронной оболочкой находится атомный
остов предыдущего инертного газа. Что
касается s-элементов. то аналогичная
ситуация наблюдается и для элементов
больших периодов. Например, электронные
конфигурации атомов Nа и Сs соответственно
[Nе]103s1 и [Хе]546s1,а
электронные конфигурации ионов Nа+
и Сs+ совпадают с электронными
структурами неона и ксенона, т.е.
аналогичны. Электронная аналогия
это подобие валентных электронных
конфигураций.
Подобные
закономерности в электронном строении
наблюдаются и в остальных группах. Таким
образом, элементы малых периодов
проявляют электронную аналогию, как с
элементами главных подгрупп, так и с
представителями побочны подгрупп (в
различных степенях окисления) и,
следовательно, определяют облик группы
в целом. Поэтому элементы малых периодов
называют типическими. Этот термин
был введен Д.И.Менделеевым.
Орбитали
которые появляются впервые, называются
кайносимметричными (от
греч. “кайнос” — новый, т.е. новый
тип симметрии орбиталей). К таким
орбиталям относятся 1s, 2p, 3d, 4f и т.д. Для
всех таких орбиталей и характерно
наличие единственного максимума на
кривой радиального распределения
электронной плотности.
Таким образом.
для кайносимметричных орбиталей
характерно отсутствие внутренних
заполненных орбиталей той же симметрии.
Горизонтальная
и диагональная аналогия. Своеобразным
следствием внутренней периодичности
является так называемая горизонтальная
аналогия, смысл которой заключается
в том, что в ряде случаев соседи в
горизонтальных рядах обладают заметным
химическим сходством. Наиболее известна
горизонтальная аналогия в триадах
8В-группы(Fе — Со — Ni; Ru — Rh — Рd; Оs —Iг-Рt)
Помимо
отмеченных выше видов аналогии (групповая,
типовая) в Периодической системе
существует определенное сходство
элементов, расположенных по диагонали,
– так называемая диагональная аналогия.
Наиболее известна аналогия в
диагональных парах Li — Мg, Ве — А1, В —
Si. Диагональная аналогия может проявляться
в двух формах: сходстве общего химического
характера элементов, проявляющемся во
всех однотипных соединениях, и в
возможности изоморфного замещения
диагональных аналогов в сложных
соединениях (диагональная аналогия в
узком смысле). Отметим, что диагональная
аналогия в широком смысле возможна
только для элементов начала малых
периодов и не наблюдается как при
переходе к более тяжелым групповым
аналогам, так и при дальнейшем продвижении
вправо.