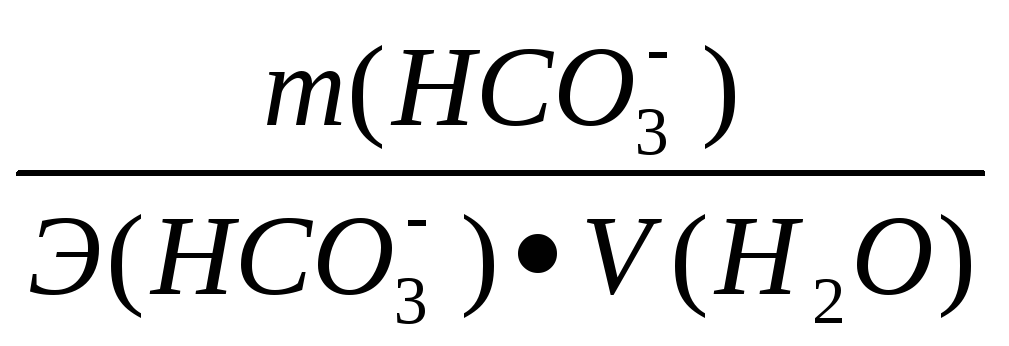Нет для человеческого организма важнее соединения на Земле, чем пресная вода. Без него невозможно существование жизни. Этот ресурс незаменим в промышленности, быту и сельском хозяйстве. Здоровье человека напрямую зависит от состава питьевой воды. По данным ВОЗ, 92% всех заболеваний человека связано с использованием для питьевых и хозяйственных нужд некачественной воды. Качество содержимого водного источника характеризуется множеством различных свойств, важное место среди которых занимает жесткость воды временная и постоянная. Повышенная жесткость воды наносит вред здоровью: способствует формированию камней в почках, сушит кожу, вызывая зуд и образование перхоти, замедляет процесс приготовления мясных продуктов. Домашние приборы и водогрейное оборудование также страдают от избытка солей карбонатной жесткости воды: при кипячении образуется накипь, а от плохо мылящихся моющих составов образуются несмываемые налеты.
Что такое карбонатная и не карбонатная жесткость в воде
Жесткость воды входит в число основных параметров, определяющих качественный состав водного источника. Эта величина отражает концентрацию в водном растворе ионов щелочноземельных металлов: Ca2+, Ba2+, Sr2+, Mg2+, Mn2+, Fe2+. Так как содержание ионов магния и кальция в подземных водах намного выше совокупного количества всех остальных ионов, общей жесткостью считают сумму ионов Ca и Mg в воде. Она в свою очередь состоит из карбонатной и некарбонатной жесткости воды. Первая зависит от насыщения водного раствора гидрокарбонатами кальция и магния, а вторая – хлоридами, нитратами, сульфатами, фосфатами и силикатами тех же металлов.
Прежде чем попасть в кран или скважину, вода проходит долгий путь по подземным водоносным горизонтам, образованным разными богатыми кальцием и магнием горными породами: известняком, доломитом. Минералы взаимодействуют с присутствующими в воде газами и обогащают водный раствор солями щелочноземельных металлов. Ветровое разрушение горных пород и биохимические реакции в почвах также способствуют насыщению природных водных пластов элементами, влияющими на жесткость. Чем глубже расположен источник, тем выше общая, временная и постоянная, жесткость воды. С изменением времени года жесткость меняется: зимой она всегда высокая, а с таянием льдов достигает минимальных отметок.
Виды жесткости воды: общая, временная и постоянная
Общее количество растворенных ионов щелочноземельных металлов составляют общую жесткость, которая складывается из временной и постоянной.
Разные соли Ca и Mg составляют разную жесткость. В воздухе в достаточной концентрации содержится CO2, и он же содержится в растворенной форме в природных источниках. При взаимодействии CO2 с водой образуются гидрокарбонат-ионы:
СO2 + H2O ↔ H2CO3 ↔ H+ + HCO3-
Эквивалентное концентрации образованного гидрокарбонат-иона количество кальциевых и магниевых ионов составляет карбонатную жесткость воды. Временная или карбонатная жесткость воды прямо зависит от содержащихся в водном растворе гидрокарбонатов Mg(HCO3)2 и Ca(HCO3)2, а постоянная жесткость воды – это находящиеся в растворе все остальные соединения Ca и Mg с кислотными остатками азотной, серной, соляной сильных кислот и менее агрессивной фосфорной и кремниевой. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды. Гидрокарбонат-ионы, отражающие карбонатную жесткость в воде, являются буферными и нивелируют кислотно-щелочной баланс водного раствора.
Наблюдая образование накипи на поверхностях и нагревательных элементах бытовых приборов, вряд ли кто-то задумывается о том, что в виде белого нароста уходит только временная жесткость из воды, а постоянная остается. От карбонатной жесткости можно практически на 100% избавиться при нагревании воды до 100°С на протяжении 50 минут. Это дает возможность называть ее временной или устранимой. Гидрокарбонаты Mg и Ca разлагаются с выпадением осадков MgCO3 и CaCO3.
Ca(HCO3)2 → CaCO3↓ + H2O + CO2↑
Mg(HCO3)2 → MgCO3↓ + H2O + CO2↑
Кипячение приводит к уменьшению общей жесткости воды путем устранения временной жесткости и перевода гидрокарбонатов в нерастворимые соединения. Постоянная жесткость воды остается неизменной. Сульфаты, хлориды, нитраты Ca и Mg остаются в растворенном виде в водном растворе и влияют на показатель мягкости.
Для правильной работы органов человека и функционирования оборудования имеет значение и постоянная, и временная жесткость воды. Здесь важно равновесие. Высокая концентрация солей магния и кальция отрицательно сказывается на состоянии сосудов и функционировании ЖКТ, способствует формированию камней в почках. Слишком мягкая вода нарушает водный и солевой баланс организма.
От высокой жесткости воды, карбонатной и не карбонатной, зависит вспенивание моющих веществ. В жесткой воде в привычном натриевом мыле Ca-ионы замещают Na-ионы при намыливании, образуя хлопья неэффективного “кальциевого мыла”. И пока кальциевая жесткость не будет удалена этим способом, формирование мыльной пены не начинается. На 1 ммоль/л общей жесткости для такого смягчения воды в теории уходит 310 мг мыла, на практике – до 540.
Высокий показатель общей карбонатной жесткости воды является причиной образования накипи на стенках водогрейных приборов, труб, отопительном оборудовании. Накипь существенно укорачивает рабочий ресурс техники, препятствуя нормальному нагреву и уменьшая производительность, засоряет сантехнику. В это же время особо мягкая вода с величиной жесткости менее 1,9 ммоль/л имеет пониженную щелочность. Это становится причиной развития коррозионных процессов в водопроводных системах. Правильно установленный баланс постоянной и временной жесткости воды поможет сохранить здоровье и продлить срок службы нагревательному оборудованию и водопроводным трубам.
Как рассчитать общую и карбонатную жесткость воды
Для определения количества растворенных ионов щелочноземельных металлов в образце воды используют несколько способов. В домашних условиях можно применить экспресс-тесты на определение карбонатной и некарбонатной жесткости, имеющиеся в свободной продаже. Они дают результат с погрешностью, но проведение эксперимента не требует дополнительных затрат и занимает минимум времени.
В соответствии с ГОСТ 31954-2012 общую временную и постоянную жесткость воды определяют комплексонометрией. При таком титриметрическом методе ионы металлов (железа, цинка, марганца, кадмия, кобальта, алюминия, свинца, меди) и часть органических веществ оказывают мешающее влияние на установление эквивалентной точки концентрации. Ортофосфат и карбонат кальция могут осаждаться в условиях проведения титрования. При невозможности устранить мешающее воздействие, измерение жесткости проводят методом атомной спектрометрии.
В основе комплексонометрии лежит титрование отобранной водной пробы в присутствии буфера – аммиачного раствора – при рН = 9 и индикатора раствором Трилона Б до изменения цвета индикатора. Наименьшая определяемая жесткость воды – 0,1 Жо. При титровании воды с повышенной жесткостью раствором динатриевой соли этилендиаминтетрауксусной кислоты образуется комплексное соединение, связывающее ионы Ca и Mg. Когда все ионы связаны, индикатор изменяет окраску. Титрование прекращается.
Общую жесткость в пробе водного раствора, Жо, высчитывают по уравнению:
Жо = С2 • V2 • 1000 / V1 [ммоль/л],
С2 – молярная концентрация эквивалента ЭДТА, моль/л;
V1 – объем воды, взятой для анализа, мл;
V2 – объем раствора ЭДТА, мл;
1000 – коэффициент пересчета моль/л в ммоль/л.
Чтобы определить карбонатную жесткость воды, применяют титрование кислотой (HCL). Индикатор метилоранж меняет окраску, когда в растворе появляется малый избыток кислоты. Способ основан на взаимодействии соляной кислоты с гидрокарбонатами:
Ca(HCO3)2 + 2HCL → CaCl2 + 2CO2↑ + 2H2O
Титрование проводят 2 – 3 раза. Для вычислений берут средний результат.
Расчет карбонатной жесткости воды осуществляют следующим образом:
Жк = Vк • Cк • 1000 / VB,
Жк – карбонатная жесткость воды, ммоль/л экв Ca2+ и Mg2+;
Vк – количество кислоты, затраченное на титрование, мл;
Ск – молярная концентрация эквивалента HCl;
VB – объем пробы воды, мл.
Постоянную жесткость воды Жнк можно найти, зная общую и карбонатную:
Жнк = Жо – Жк
В зависимости от концентрации ммоль/л ионов магния и кальция, воду разделяют на несколько типов по степени жесткости:
- Особо мягкая – ниже 1,6 ммоль/л;
- Мягкая – в пределах 1,6 – 3,9 ммоль/л;
- Средне-жесткая – в пределах 3,9 – 7,9 ммоль/л;
- Жесткая – в пределах 7,9 – 11,9 ммоль/л;
- Особо жесткая – выше 11,9 ммоль/л.
Как устранить карбонатную и некарбонатную жесткость воды
Удалить жесткость возможно бытовыми способами и профессиональной очисткой воды с помощью фильтров. Уменьшение жесткости, или умягчение, воды заключается в удалении ионов Ca и Mg. В домашних условиях, чтобы понизить временную жесткость воды, достаточно просто ее вскипятить. При кипячении гидрокарбонаты переходят в нерастворимые формы карбонатов магния и кальция и выпадают в осадок. Однако этот способ связан с временными затратами на остывание вскипяченной воды, удалением накипи с посуды и малыми объемами готовой к использованию воды.
Избавиться от жесткости в воде можно замораживанием или дистилляцией. Однако в этом случае получаем дистиллированную воду, которая непригодна для питья, поскольку вымывает полезные минералы из организма, но широко применяется во многих технологических процессах в промышленности.
Умягчить жесткую воду можно введением химических реагентов. Временную или карбонатную жесткость воды понижают добавлением гашеной извести. А при одновременном введении извести и соды можно устранить карбонатную и некарбонатную жесткость в воде. Временная жесткость удаляется известью, а постоянная – содой.
Для работы с большими объемами воды рекомендуется использовать профессиональную очистку от постоянной и временной жесткости фильтрами непрерывного умягчения воды с помощью ионообменных смол. Применяют методы Na и H-Na катионирования, Na-CL ионирования воды. Объединение в одном фильтре смешанного действия анионита и катионита оптимизирует показатели чистоты получаемого раствора.
Универсальные загрузки Экотар, Экомикс помогают не только удалить карбонатную и постоянную жесткость из воды, но и избавить водный раствор от железа и органических примесей. Вода проходит комплексную очистку в пять ступеней благодаря специально подобранной смеси загрузки ионообменных смол и сорбционных веществ. Регенерация фильтров типа Экотар, Экомикс производится с помощью солевого раствора NaCl.
Одним из эффективных и удобных в применении способов устранения жесткости является обратный осмос. Водные растворы проходят через полупроницаемые мембраны, оставляя на них практически все находящиеся в водном растворе вещества. Обратноосмотические установки отличаются простотой обслуживания, хорошей производительностью и экономичностью.
Выбираем фильтры для устранения жесткости воды
Качество воды играет определяющую роль в работе оборудования. Жесткая вода способна навредить любому технологическому процессу в каждой отрасли промышленности. Повышенное содержание солей жесткости – причина развития многих заболеваний при регулярном употреблении ее для питья. Свойства жесткой воды не дают полноценно использовать ее для бытовых нужд, увеличивают расход моющих средств и портят вещи.
Позаботьтесь о качестве воды вместе с нашей компанией. Мы предлагаем весь спектр оборудования для устранения постоянной и временной жесткости воды, включая фильтры умягчения, мультизагрузки Экотар и Экомикс, мембранные установки на основе технологии обратного осмоса. Получить подробную консультацию и сделать заказ можно по телефону или электронной почте. Оформление заявки также возможно в специальной форме обратной связи на сайте.
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
4.1. Теоретическая часть
Жесткость
воды обусловлена присутствием в ней
растворенных солей кальция и магния.
Различают
общую,
карбонатную
и некарбонатную жесткость.
Общей
жесткостью (Жо) называется
суммарная концентрация ионов Ca2+
и Mg2+
в воде, выраженная в моль/м3
или ммоль/дм3.
Общая
жесткость воды (ЖО)
равна сумме карбонатной и некарбонатной
жесткости.
ЖО
=
[Са2+]
+ [Mg2+]
= ЖК
+
ЖНК;
(ммоль/дм3)
Количественно
жесткость воды определяется суммой
молярных концентраций эквивалентов
ионов кальция и магния, содержащихся в
1 дм3
воды (ммоль/дм3,
мг – экв/дм3
).
Карбонатная
(временная)
жесткость
(ЖК)
обусловлена содержанием в воде
преимущественно гидрокарбонатов (и
карбонатов при рН > 8,3) солей кальция
и
магния:
Ca(НСО3)2,
Мg(НСО3)2,
(МgСО3).
Некарбонатная
жесткость воды (ЖНК)
обусловлена присутствием в воде сульфатов
и
хлоридов
солей кальция и магния:
СаSO4,
MgSO4,
СаС12,
MgС12.
Некарбонатная
жесткость –
часть общей жесткости, равная разности
между общей и карбонатной жесткостью:
Жнк
= Жо – Жк
По
величине жесткости природную воду делят
на: очень мягкую — до 1,5 ммоль/дм3;
мягкую — от 1,5 до 4 ммоль/дм3;
средней жесткости — от 4 до 8 ммоль/дм3;
жесткую — от 8 до 12 ммоль/дм3;
очень жесткую — свыше 12 ммоль/дм3.
В зависимости от конкретных требований
производства допускаемая жесткость
воды может быть различной. Жесткость
воды хозяйственно-питьевых водопроводов
не должна превышать 7
ммоль/дм3
(мг-экв/дм3).
4.2. Пример решения индивидуального задания
Пример.
Условие
задания: Рассчитать
карбонатную, некарбонатную и общую
жесткость воды, если в 1м3
исследуемой воды содержится 80 г Ca2+;
55
г Mg2+;
415 г HCO3–.
Дано:
m
(Са2+)
= 80 г
= 80 000 мг
m
(Mg2+)
= 55 г = 55 000 мг
m
(HCO3–)
= 415 г = 415 000 мг
V(Н2О)
= 1 м3
= 1000 дм3
Жо
-? Жк – ? Жнк – ?
Решение
1).
Жесткость общую рассчитывают по формуле:
Жо
=[Са2+]
+ [Mg2+]
=
+
;
мг – экв/дм3
где:
[Са2+],
[Mg2+]
– концентрация ионов в мг-экв/дм3;
m
(Са2+),
m (Mg2+)
– содержание ионов Са2+
и
Mg2+
в мг;
V(Н2О)
– объем воды, дм3;
Э
(Са2+),
Э (Mg2+)
– эквивалентная масса ионов Са2+
и
Mg2+,
которая равна:
Э
(Са2+)
=
Э(Mg2+)
=
Тогда:
Жо
= [Са2+]
+
[Mg2+]
=
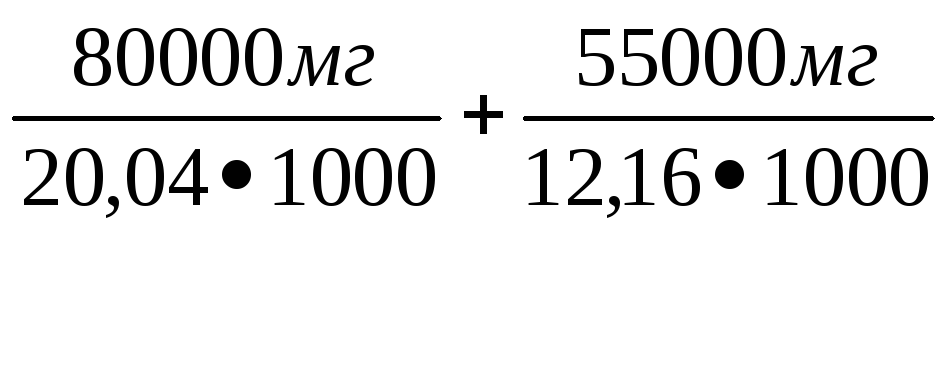
+
4,52
= 8,5 мг-экв/дм3
2).
Рассчитываем жесткость карбонатную
(Жк) по формуле:
Жк
= [НСО3–]
=
где:
[НСО3–]
– концентрация в мг-экв/дм3;
m
(НСО3–)
– содержание иона НСО3–
в
мг; V(Н2О)
– объем воды, дм3;
Э (НСО3–)
– эквивалентная масса иона НСО3–,
которая равна:
Э
(НСО3–)
=
Тогда:
Жк
= [НСО3–]
=
3).
Рассчитываем жесткость некарбонатную
(Жнк), как разность между жесткостью
общей и карбонатной:
Жнк
= Жо – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3
4).
Результаты расчетов приведены в табл.
4.6.
Таблица
4.6
Показатели жесткости исследуемой воды
|
Наименование показателя: |
Содержание |
|
|
мг-экв/дм3 |
мг/дм3 |
|
|
Са2+ |
3,99 |
3,99 |
|
Mg2+ |
4,52 |
4,52 |
|
Жесткость |
8,5 |
– |
|
Жесткость |
6,8 |
– |
|
Жесткость |
1,7 |
– |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
Данный урок – лабораторная работа разработан по
предмету “Аналитическая химия” для обучающихся
по профессии “Технология продукции
общественного питания”. В ходе лабораторной
работы в основе определения общей жесткости воды
используется один из методов титриметрического
анализа – комплексонометрический.
Вода является универсальным растворителем на
планете Земля. Как в загородных домах, так и в
городе в квартирах с централизованным
водопроводом существует проблема жесткой воды.
Жесткость воды зависит от наличия в ней солей
кальция и магния. Жесткость воды является
характеристикой конкретного источника
водоснабжения и не изменяется в процессе
подготовки питьевой воды к централизованному
водоснабжению. Как определить степень жесткости
воды?
Цель: повторить основные понятия,
используемые в титриметрическом анализе;
научить определять общую жесткость воды
комплексонометрическим методом; закрепить
навыки работы с лабораторным оборудованием;
развивать вычислительные навыки; воспитывать
чувство ответственности и дисциплинированности
при выполнении практической работы.
Оборудование: конические колбы, мерные
круглодонные колбы, бюретки для титрования,
реактивы: трилон Б, индикатор эриохром черный Т,
водопроводная вода, аммиачно-буферная смесь;
таблицы, инструкционные карты.
Ход урока
I. Организационный момент
II. Актуализация знаний учащихся
Сегодня на уроке мы с Вами будем говорить о
самом замечательном веществе на планете Земля –
воде.
Вы, как будущие технологи общественного
питания, будете использовать питьевую воду не
только в быту, но и в своей профессиональной
деятельности.
В Старом Осколе питьевая вода поступает в город
из 14 водозаборов, расположенных в разных частях
города и района.
1. Одинакова ли питьевая вода по своим
свойствам? (нет)
2.Чем она отличается? (содержанием
различных веществ – жесткостью)
Абсолютно чистой воды в природе не существует.
Она всегда содержит различные примеси как в
растворенном, так и во взвешенном состоянии. От
концентрации и природы этих примесей зависит
пригодность воды для бытовых и промышленных
нужд.
3.Что такое жесткость воды?
Жесткость воды определяется содержанием в ней
растворимых солей магния, кальция,
гидрокарбонатов, сульфатов, хлоридов.
4. Какие виды жесткости воды Вы знаете?
Жесткость временная (карбонатная)
обусловлена содержанием гидрокарбонатов
кальция и магния.
Жесткость постоянной (некарбонатной) обусловленна
присутствием в воде хлоридов, сульфатов и других
солей магния и кальция.
Общая жесткость воды представляет сумму
жесткости карбонатной и некарбонатной.
5. Почему нежелательно использовать жесткую
воду в быту?
Жесткая вода образует плотные слои накипи на
внутренних стенках паровых котлов и
кипятильников, в ней плохо развариваются пищевые
продукты, при стирке белья в жесткой воде
расходуется больше мыла.
III. Изучение нового материала
Тема нашего урока “Определение общей
жесткости воды комплексонометрическим
методом”. Запишем ее в тетради.
В ходе урока мы должны научиться
практическим путем определять общую жесткость
воды, используя титриметрический анализ, в
частности комплексонометрический метод.
Вспомним основы комплексонометрического
метода анализа.
1. В чем состоит сущность
комплексонометрического метода?
Сущность комплексонометрического метода
состоит в образовании комплексных соединений
анализируемых катионов с органическими
реагентами – комплексонами.
2.Что такое титрование?
Титрование – постепенное добавление
раствора известной концентрации до достижения
точки эквивалентности.
3. Что такое точка эквивалентности?
Точка эквивалентности – момент
окончания реакции, т.к. вещества реагируют между
собой в эквивалентных количествах.
4. С помощью чего устанавливают точку
эквивалентности? (индикатора)
5. Что такое индикатор?
Индикаторы – вещества, при помощи
которых устанавливают момент эквивалентности
между взаимодействующими растворами.
6. Что такое стандартный (рабочий) раствор?
Стандартный раствор – раствор с точно
установленной концентрацией, используемый для
титриметрических измерений.
7. Какие правила техники безопасности
необходимо соблюдать при выполнении
практической работы?
Правила техники безопасности при работе
со стеклянной посудой; жидкостями и сыпучими, а
также ядовитыми веществами.
Работу выполняем по парам. На столах имеются
инструкционные карты.
IV. Выполнение практической работы
Работу выполняем по парам. На столах имеются
инструкционные карты.
В тетради:
Цель работы: определить общую жесткость воды
методом комплексонометрии.
Оборудование: бюретки, мерный цилиндр, мерные
круглодонные колбы, конические колбы, цилиндры,
воронки, шпатель; реактивы: раствор Трилона Б,
эриохром черный Т (сухой), аммиачно-буферная
смесь, водопроводная вода.
Ход работы
1. Мерной колбой отмерить 100 мл исследуемой Н2О
и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси,
затем 7-8 капель спиртового раствора индикатора
эриохром черного Т или щепотку его смеси с NaCl или
KCl (сухую).
3. Тщательно перемешать, раствор окрасится в
винно-красный цвет.
4. Смесь оттитровать 0,05 Н раствором Трилона Б. К
концу титрования раствор Трилона Б добавлять по
каплям, встряхивая смесь в колбе после
добавления каждой капли.
5.Титрование можно считать законченным если
после добавления очередной капли окраска
раствора приобретает синий цвет с зеленоватым
оттенком и с добавлением лишней капли раствора
комплексона не изменяется.
6. Определить объем трилона Б, израсходованного
на титрование.
7.Титрование повторить 2-3 раза и для расчета
взять среднее значение.
8. Произвести расчет общей жесткости воды.
Расчет:
Величину общей жесткости воды (Ж0) в мг*экв/л
вычисляют по формуле:
где N – нормальность раствора трилона Б, г-экв/л;
V – объем раствора трилона Б, мл;
V1 – объем воды, мл.
9. Сделайте вывод о типе воды, пользуясь данными
значениями жесткости воды.
Типы воды (по жесткости):
- Очень мягкие – 0-1,5 мг-экв/л;
- Мягкие – 1,5- 3,0 мг-экв/л;
- Среднежесткие – 3,0- 4,5 мг-экв/л;
- Довольно жесткие – 4,5 – 6,5 мг-экв/л;
- Жесткие – 6,5 – 11,0 мг-экв/л;
- Очень жесткие – свыше 11,0 мг-экв/л.
V. Подведение итогов работы
Сегодня на уроке мы практическим путем
определили общую жесткость воды. Водопроводная
вода, которую мы используем, является
среднежесткой.
Какие способы устранения жесткости Вы знаете?
Способы устранения жесткости воды:
- Карбонатная (временная) жесткость – кипячение;
добавление известкового молока или соды. - Некарбонатная (постоянная) жесткость –
добавление соды.
Общая жесткость – путем ионного обмена.
Рассчитайте общую жесткость воды (ммоль/л, градусы), если в 0,25 литрах воды содержится 16,2 миллиграмм гидрокарбоната кальция (Ca(HCO3)2), 2,92 миллиграмм гидрокарбоната магния (Mg(HCO3)2), 11,1 миллиграмм хлорида кальция (CaCl2) и 9,5 миллиграмм хлорида магния (MgCl2).
Решение задачи
Напомню:
Общая жесткость воды (Ж) – это сумма временной и постоянной жесткости.
Один градус жесткости соответствует содержанию 1 г оксида кальция (CaO) в 100 л воды. Содержание других металлов пересчитывается на количество эквивалентов оксида кальция (CaO). Воду, жесткость которой равна до 4 ммоль/л, считают мягкой, свыше 12 ммоль/л – очень жесткой.
Выразим жесткость воды (моль/л) двухзарядных катионов металлов Ca2+, Mg2+, Fe2+ и соответствующих им солей, содержащихся в 1 л воды:
Где:
m1, m2,m3 – масса двухзарядных катионов металлов ( или соответствующих им солей) в воде, мг;
Mэ1, Mэ2,Mэ3 – молярная масса эквивалентов катионов металлов ( или соответствующих им солей);
V – объем воды, л.
Учитывая, молярные массы солей (смотри таблицу Менделеева), найдем их молярные массы эквивалентов:
Мэ (Ca(HCO3)2) = 162 /2 = 81 (мг/моль)
Мэ (Mg(HCO3)2) = 146 /2 = 73 (мг/моль)
Мэ (CaCl2) = 111 /2 = 55,5 (мг/моль)
Мэ (MgCl2) = 95 /2 = 47,5 (мг/моль)
Общая жесткость воды данного образца воды равна сумме временной и постоянной жесткости и обуславливается содержанием в ней солей, придающих ей жесткость.
По формуле рассчитаем общую жесткость воды:
Жобщ = 16,2 /81 ⋅ 0,25 + 2,92 /73 ⋅ 0,25 + 11,1 /55,5 ⋅ 0,25 + 9,5 /47,5 ⋅ 0,25 = 2,56 (ммоль/л).
Один градус жесткости соответствует 0,357 ммоль катионов двухзарядных металлов. Общая жесткость воды образца воды в градусах жесткости равна:
2,56 /0,357 = 7,170
Ответ:
общая жесткость воды равна 2,56 ммоль/л.