Как найти массу вещества
Массу вещества требуется найти во многих задачах. Это можно сделать с помощью специальных формул. Обычно в условии задачи присутствует реакция, с помощью которой находятся некоторые величины.
Инструкция
1. При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2. В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д. И. Менделеева по обозначение элемента) .
3. Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4. Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5. Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Как вычислить массу вещества
В химических реакциях принимают участие мельчайшие частицы (атомы, молекулы), и их число даже в небольшой порции вещества очень велико. Поэтому для упрощения расчетов была введена специальная единица измерения “количества вещества” – моль. 1 Моль содержит 6,02*1023 атомов или молекул. Как вычислить массу вещества?

Вам понадобится
- – вещество;
- – интернет;
- – таблица Менделеева.
Инструкция
Определите какой вид массы вам нужно рассчитать: обычную, молекулярную или молярную. Найдите формулу химического соединения, массу которого вам нужно вычислить. Если ее нет в задаче, запустите поиск по названию в интернете.
Подсчитайте количество химических элементов, входящих в молекулу интересующего вас вещества. Например, сульфат алюминия Al2(SO4)3 состоит из двух атомов алюминия, трех атомов серы и двенадцати атомов кислорода.
Откройте таблицу Менделеева. Атомная масса указана для каждого элемента под его буквенным обозначением, точные числа из таблицы при расчетах округляйте до ближайшего целого. Так, атомная масса алюминия = 27 (26,98154 по таблице), серы = 32 (32,06 в таблице), кислорода = 16 (15,9994). Запишите атомную массу каждого из элементов. Молекулярная масса равна сумме атомных масс всех элементов вещества, с учетом их количества в соединении.
Сложите атомные массы, умножая каждую из них на количество данного химического элемента в формуле, вы получите молекулярную массу вещества:
2Al +3S+12О = 2*27+3*32+12*16 = 342
Молекулярная масса не имеет единицы измерения.
Для определения обычной массы некоторого количества вещества нужно знать молярную массу (масса одного моля данного соединения, выражается она в граммах на моль, г/моль, и напрямую связана с молекулярной массой). Для этого к полученному значению молекулярной массы просто допишите “г/моль”. То есть молярная масса сульфата алюминия составляет 342 г/моль.
Молярная и обычная массы взаимосвязаны формулой: m = ? * M , где m – обычная масса, выраженная в граммах, ? – количество вещества в молях, М – молярная масса в г/моль. Умножьте молярную массу на количество молей и получите массу вещества. Так, 1 моль сульфата алюминия весит 342 грамма, 2 моля – 684 грамм и т.д.
Если вам известно количество вещества в молях и его обычная масса, то молярную массу рассчитывайте по формуле M = m / ?.
Видео по теме
Источники:
- молярная масса алюминия
- Четыре бруска одинаковой массы изготовлены из алюминия
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как найти массу вещества
Окружающее нас пространство наполнено разными физическими телами, которые состоят из разных веществ с различной массой. Школьные курсы химии и физики, ознакомляющие с понятием и методом нахождения массы вещества, прослушали и благополучно забыли все, кто учился в школе. Но между тем теоретические знания, приобретенные когда-то, могут понадобиться в самый неожиданный момент.
1
Вычисление массы вещества с помощью удельной плотности вещества. Пример – имеется бочка на 200 литров. Нужно заполнить бочку любой жидкостью, скажем, светлым пивом. Как найти массу наполненной бочки? Используя формулу плотности вещества p=m/V, где p – удельная плотность вещества, m – масса, V – занимаемый объем, найти массу полной бочки очень просто:
- Меры объемов – кубические сантиметры, метры. То есть бочка на 200 литров имеет объем 2 м³.
- Мера удельной плотности находится с помощью таблиц и является постоянной величиной для каждого вещества. Измеряется плотность в кг/м³, г/см³, т/м³. Плотность пива светлого и других алкогольных напитков можно посмотреть на сайте. Она составляет 1025,0 кг/м³.
- Из формулы плотности p=m/V => m=p*V: m = 1025,0 кг/м³* 2 м³=2050 кг.
Бочка объемом 200 литров, полностью наполненная светлым пивом, будет иметь массу 2050 кг.
2
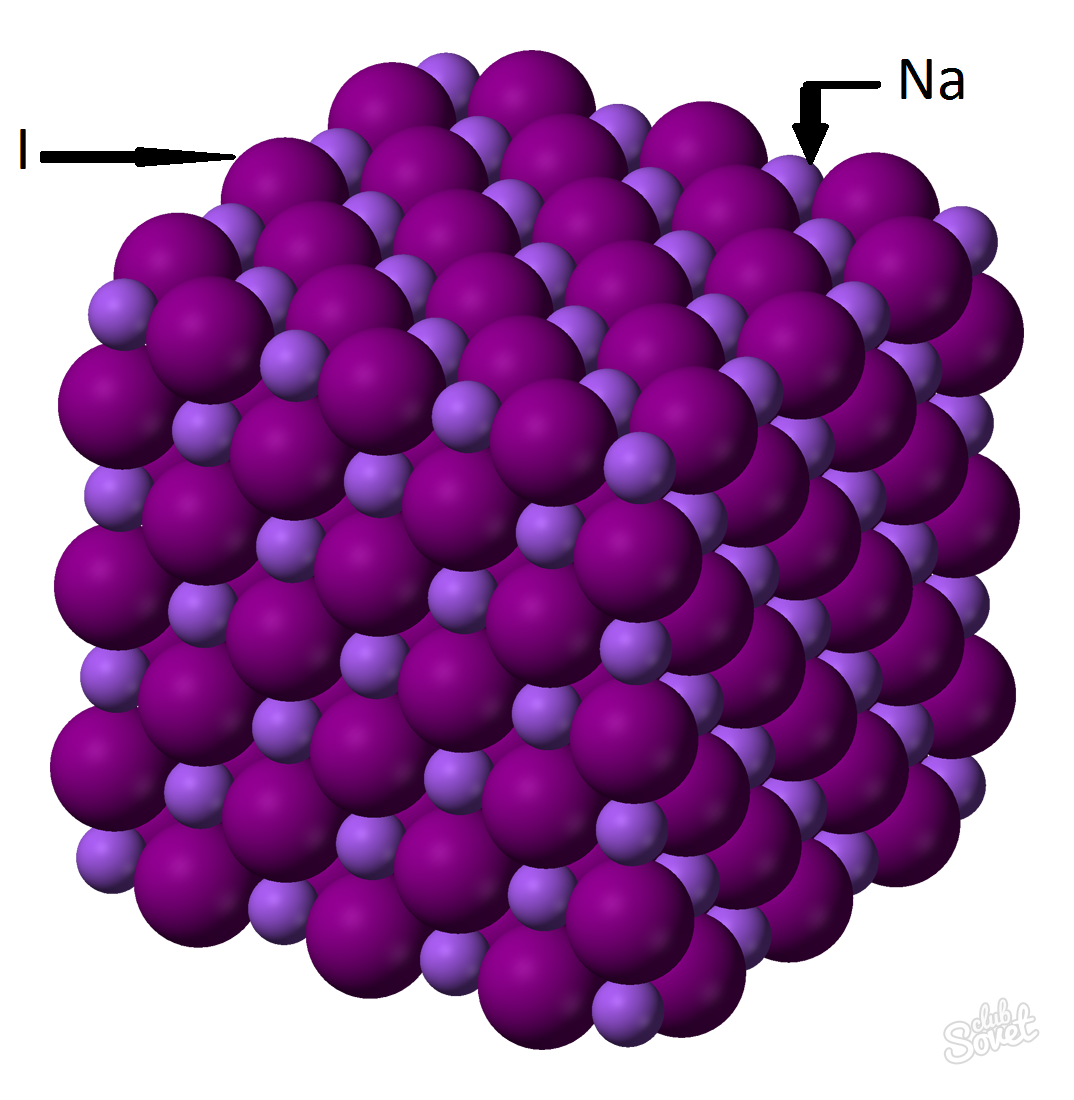
Нахождение массы вещества с помощью молярной массы. M (x)=m (x)/v (x) – это отношение массы вещества к его количеству, где M (x) – это молярная масса X, m (x) – масса X, v (x) – количество вещества X. Если в условии задачи прописывается только 1 известный параметр – молярная масса заданного вещества, то нахождение массы этого вещества не составит труда. Например, необходимо найти массу йодида натрия NaI количеством вещества 0,6 моль.
- Молярная масса исчисляется в единой системе измерений СИ и измеряется в кг/моль, г/моль. Молярная масса йодида натрия – это сумма молярных масс каждого элемента: M (NaI)=M (Na)+M (I). Значение молярной массы каждого элемента можно вычислить по таблице, а можно с помощью онлайн-калькулятора на сайте: M (NaI)=M (Na)+M (I)=23+127=150 (г/моль).
- Из общей формулы M (NaI)=m (NaI)/v (NaI) => m (NaI)=v (NaI)*M (NaI)= 0,6 моль*150 г/моль=90 грамм.
Масса йодида натрия (NaI) с массовой долей вещества 0,6 моль составляет 90 грамм.
3
Нахождение массы вещества по его массовой доле в растворе. Формула массовой доли вещества ω=[m (вещества)/m (раствора)]*100%, где ω – массовая доля вещества, а m (вещества) и m (раствора) – массы, измеряемые в граммах, килограммах. Общая доля раствора всегда принимается за 100%, иначе будут погрешности в вычислении. Несложно из формулы массовой доли вещества вывести формулу массы вещества: m (вещества)=[ω*m (раствора)] /100%. Однако есть некоторые особенности изменения состава раствора, которые нужно учитывать при решении задач на эту тему:
- Разбавление раствора водой. Масса вещества растворенного X не изменяется m (X)=m’(X). Масса раствора увеличивается на массу добавленной воды m’ (р)=m (р)+m (H2O).
- Выпаривание воды из раствора. Масса растворенного вещества X не изменяется m (X)=m’ (X). Масса раствора уменьшается на массу выпаренной воды m’ (р)=m (р)-m (H2O).
- Сливание двух растворов. Массы растворов, а также массы растворенного вещества X при смешивании складываются: m’’ (X)=m (X)+m’ (X). m’’ (р)=m (р)+m’ (р).
- Выпадение кристаллов. Массы растворенного вещества X и раствора уменьшаются на массу выпавших кристаллов: m’ (X)=m (X)-m (осадка), m’ (р)=m (р)-m (осадка).
4
Алгоритм нахождения массы продукта реакции (вещества), если известен выход продукта реакции. Выход продукта находится по формуле η=[m (x практическая)/m (x теоретическая)]*100%, где m (x практическая) – масса продукта х, которая получена в результате практического процесса реакции, m (x теоретическая) – рассчитанная масса вещества х. Отсюда m (x практическая)=[η*m (x теоретическая)]/100% и m (x теоретическая)=[m (x практическая)*100%]/η. Теоретическая масса получаемого продукта всегда больше практической, в связи с погрешностью реакции, и составляет 100%. Если в задаче не дается масса продукта, полученного в практической реакции, значит, она принимается за абсолютную и равна 100%.
Варианты нахождение массы вещества – небесполезный курс школьного обучения, а вполне применяемые на практике способы. Каждый сможет без труда найти массу необходимого вещества, применяя вышеперечисленные формулы и пользуясь предлагаемыми таблицами. Для облегчения задания прописывайте все реакции, их коэффициенты.
Курс школьной химии представляет собой вводное пособие в сложную науку. С самого начала ученики пытаются понять, как решать расчетные задачи. Пусть на первых этапах они имеют маленькое практическое применение, но если школьник узнал о том, например, как находить массу вступивших в реакцию веществ, то он вполне может претендовать на серьезные достижения.
Рассмотрим простой пример задачи, на основе которой можно научиться решать более сложные. Предположим, что на полное сгорание оксида углерода (II) вам понадобилось 11,2 литра. Сколько граммов CO2 вам удалось получить?
1. Составим уравнение реакции.
CO + O2 = CO2
2. Уравняем по кислороду. Есть некоторое правило, которое в большинстве случаев может вам помочь. Начинайте расставлять коэффициенты с того вещества, количество атомов которого нечетно. В данном случае это кислород в молекуле CO. К нему поставим коэффициент 2. Так как слева образовалось два атома углерода, а справа – один, то и перед CO2 поставим 2. Таким образом, получаем:
2CO + O2 = 2CO2
Как видите, в левой и правой частях по четыре атома кислорода. Углерод также находится в балансе. Следовательно, уравняли верно.
3. Далее необходимо найти количество O2. Определение молекулярной массы для школьников слишком громоздко и тяжко для запоминания, поэтому воспользуемся другим методом. Вспомним, что существует молярный объем, который равен 22,4 л/моль. Вам необходимо найти, сколько молей (n) вступило в реакцию: n=V/V м. В нашем случае n=0,5 моль.
4. Теперь составим пропорцию. Количество вступившего в реакцию кислорода в два раза меньше n (CO2). Это следует из того, что 0,5 моль /1 = x моль /2. Простое отношение двух величин помогло составить верное уравнение. Когда мы нашли x = 1, можем получить ответ на вопрос, как находить массу.
5. Правда для начала придется вспомнить еще одну формулу: m=M*n. Последнюю переменную нашли, но что делать с M? Молярная масса – это экспериментально установлено значение относительно водорода. Именно она обозначается буквой M. Теперь мы знаем, что m(CO2)= 12 г/моль * 1 моль = 12 г. Вот и получили ответ. Как видите, нет ничего сложного.
Эта задача весьма легкая относительно множества других. Однако главное – понять, как находить массу. Представьте себе молекулу какого-нибудь вещества. Давно известно, что моль состоит из 6*10^23 молекул. В то же время в Периодической системе существует установленная масса элемента на 1 моль. Иногда надо рассчитать молярную массу вещества. Предположим M(H20)=18 граммов/моль. То есть одна молекула водорода имеет M=1 грамм/моль. Но вода содержит в себе два атома H. Также не забываем о наличии кислорода, что дает нам еще 16 граммов. Суммируя, получаем 18 граммов/моль.
Теоретический подсчет массы впоследствии будет иметь практическое применение. Особенно для учащихся, которых ожидает химический практикум. Не стоит бояться этого слова, если вы учитесь в непрофильной школе. Но если химия – ваш профильный предмет, лучше не запускать базовые понятия. Итак, теперь вы знаете о том, как находить массу. Помните, что в химии очень важно быть последовательным и внимательным человеком, который не только знает некоторые алгоритмы, но и умеет их применять.
Тогда ускорение свободного падения (g) относительно Земли определяется действием сил: гравитационной силы относительно Земли () и инерционной силы (). Гравитация является результатом действия этих сил:
Формула массы тела
В ньютоновской механике масса тела — это скалярная физическая величина, которая является мерой его инерционных свойств и источником гравитационного взаимодействия. В классической физике масса всегда является положительной величиной.
Масса является аддитивной величиной, т.е: Масса каждой группы материальных точек (m) равна сумме масс всех отдельных частей системы (mi):
В классической механике предполагается, что:
- масса тела не является зависимой от движения тела, от воздействия других тел, расположения тела;
- выполняется закон сохранения массы: масса замкнутой механической системы тел неизменна во времени.
Инертная масса
Инерционное свойство материальной точки заключается в том, что при приложении к ней внешней силы точка имеет конечное по модулю ускорение. Когда внешняя сила не приложена, тело находится в состоянии покоя в инерциальной системе координат или движется равномерно и прямолинейно. Масса входит во второй закон движения Ньютона:
Масса определяет инерционные свойства материальной точки (инерционная масса).
Гравитационная масса
Масса материальной точки входит в закон всемирного тяготения, тем самым определяя гравитационные свойства конкретной точки; она называется гравитационной (тяжелой) массой.
Эмпирически установлено, что отношение инерционной массы к гравитационной массе одинаково для всех тел. Если значение гравитационной постоянной выбрано правильно, то из этого следует, что для каждого тела инерционная и гравитационная массы равны и относятся к гравитационной силе (Ft) выбранного тела:
Где g — ускорение свободного падения. Если наблюдения проводятся в одной и той же точке, то ускорение, вызванное гравитацией, будет одинаковым.
Энергия
Выше были приведены различные формулы для определения массы в физике. В заключение статьи я хотел бы указать на взаимосвязь между массой и энергией. Эта связь является фундаментальной и отражает пространственно-временные свойства нашей Вселенной. Соответствующая формула для массы в физике, выведенная Альбертом Эйнштейном, имеет вид:
Квадрат скорости света c является коэффициентом преобразования между массой и энергией. Это выражение показывает, что обе величины по сути являются одним и тем же свойством материи.
Написанное выражение было подтверждено экспериментально при изучении ядерных реакций и реакций элементарных частиц.
Формулы для инерции
В физике формула для определения инерционной массы имеет следующий вид:
Здесь F — сила, действующая на тело и придающая ему ускорение a. Формула показывает, что чем больше действующая сила и чем меньше ускорение, которое она придает телу, тем больше инерционная масса m.
Помимо письменного выражения, для определения массы в физике необходимо привести еще одну формулу, которая связана с инерционным эффектом. Эта формула имеет вид:
Где p — масса движения (импульс), v — скорость тела. Чем больше движение тела и чем меньше его скорость, тем больше инерционная масса тела.
Примеры решения задач
Задача 1
Имеется алюминиевый стержень со сторонами 3, 5 и 7 см. Какова его масса?
Читайте также.
Определим объем стержня:
V = 3 * 5 * 7 = 105 см3 ,
Значение таблицы плотности алюминия: 2800 кг/м 3 или 2,8 г/см 3 ,
Вычислим массу стержня:
m = 105 * 2,8 = 294 г.
Задача 2
Проблема по смежной теме.
Сколько энергии необходимо для доведения воды комнатной температуры (20 градусов Цельсия) из стакана (емкостью 200 мл) до температуры кипения?
Математическое описание явления гравитации стало возможным благодаря многочисленным наблюдениям за движением космических тел. Результаты всех этих наблюдений были обобщены в 17 веке Исааком Ньютоном в законе всемирного тяготения. Согласно этому закону, два тела с массами m1 и m2 перемещаются под действием силы F
F = G * m1 * m2 / r2
Где r — расстояние между телами, G — константа.
Если мы подставим в это выражение массу нашей планеты и ее радиус, то получим следующую формулу массы в физике:
Где F — сила тяжести, а g — ускорение, с которым тело падает на землю вблизи ее поверхности.
Хорошо известно, что наличие гравитации гарантирует, что все тела имеют вес. Многие люди путают вес и массу и считают, что это одно и то же. Хотя эти две величины связаны между собой коэффициентом g, масса является переменной величиной (она зависит от ускорения, с которым движется система). Кроме того, вес измеряется в ньютонах, а масса — в килограммах.
Читайте также: Металлоискатель ручной работы — 96 фото конструкции чувствительного прибора.
Весы, которыми человек пользуется дома (механические, электронные), показывают вес тела, но они измеряют вес тела. Пересчет между этими величинами — это просто вопрос калибровки прибора.
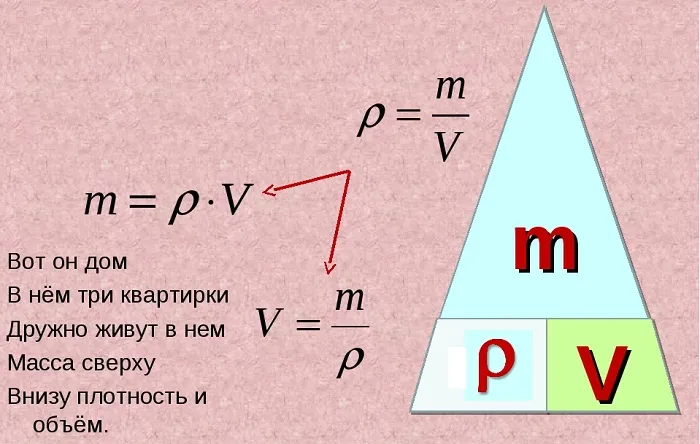
Формула зависимости массы от объема и плотности
Для определения плотности жидкости или твердого тела существует основная формула: Плотность равна массе, деленной на объем. Она записывается следующим образом: p = m / V
Отсюда можно вывести еще две формулы. Формула для объема тела: V = m / p А также формула для расчета массы: m = V * p Как видите, запомнить последнюю очень легко: это единственная формула, где нужно перемножить две единицы. Для запоминания этой зависимости можно использовать фигуру в виде «пирамиды», разделенной на три части, с массой в верхней части и плотностью и объемом в нижних углах. Ситуация с газами несколько иная. Вычислить их вес гораздо сложнее, поскольку газы не имеют постоянной плотности: Они рассеиваются и занимают весь доступный им объем. Именно здесь возникает понятие молекулярной массы, которую можно определить, сложив массы всех атомов в формуле вещества, используя данные из периодической таблицы.
Вторая необходимая нам единица — это количество вещества в молях. Это можно рассчитать с помощью уравнения реакции. Подробнее об этом вы можете узнать на уроке химии. Другой способ найти количество молей — разделить объем газа на 22,4 литра. Последнее число — это константа объема, которая называется s
Плотность многих веществ известна заранее и может быть легко получена из соответствующей таблицы. При работе с устройством важно обращать внимание на размеры и помнить, что все данные собраны при нормальных условиях: Температура в помещении 20 градусов Цельсия, а также определенное давление, влажность и так далее.
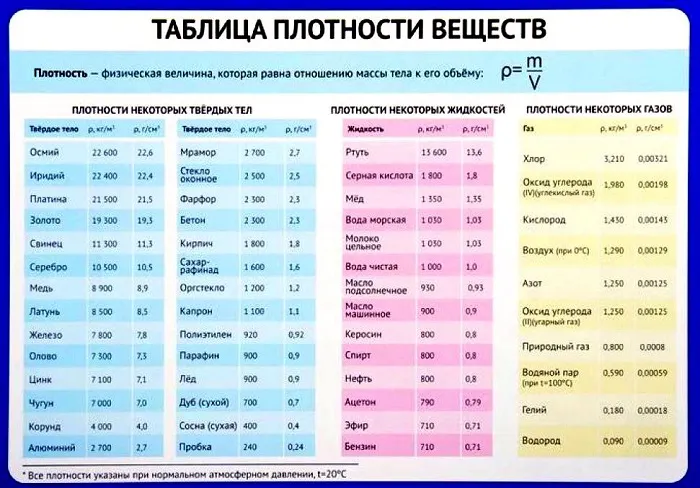
Таблица плотности некоторых веществ
Плотности других, более редких веществ можно найти в Интернете. Стоит запомнить хотя бы одно значение плотности, так как оно часто встречается в задачах. Это плотность воды — 1000 кг/м3 или 1 г/см3.
Состояние: Имеется алюминиевый стержень с длиной стороны 3, 5 и 7 см. Какова его масса? Решение. Ответ: m = 294 г.
Примеры решения задач
Задача 1
Проблема по смежной теме. Ситуация: Сколько энергии требуется, чтобы довести воду комнатной температуры (20 градусов Цельсия) из стакана (емкостью 200 мл) до температуры кипения? Решение: Найдем недостающую информацию: температура кипения воды t
Задача 2
= 100 градусов Цельсия, удельная теплоемкость воды c = 4200 Дж/кг*C, плотность воды 1 г/см 3, 1 мл воды = 1 см 3. Найти массу воды: m = V * p, m = 200 * 1 = 200 г = 0,2 кг, найти энергию: Q = c * m * (t2Q = 4200 * 0,2 * (100 — 20) = 67200 Дж = 67,2 кДж. Ответ: Q = 67,2 кДж.2– t1Проблема молекулярной массы. Условие: Определите массу CO
Задача 3
объемом 5,6 л. Решение: Определите молярную массу CO2M = 12 + 16 * 2 = 44 г/моль; определите объем вещества: n = 5,6 / 22,4 = 0,25 моль; определите массу: m = n * M; m = 0,25 * 44 = 11 г. Ответ: m = 11 г.2