| Оксид азота(II) | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Оксид азота(II) | |
| Хим. формула | NO | |
| Физические свойства | ||
| Состояние | бесцветный газ | |
| Молярная масса | 30,0061 г/моль | |
| Плотность | газ: 1,3402 кг/м³ | |
| Энергия ионизации | 9,27 ± 0,01 эВ[2] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −163,6 °C | |
| • кипения | −151,7 °C | |
| • разложения | выше +700 °C | |
| Энтальпия | ||
| • образования | 81 кДж/моль | |
| Давление пара | 34,2 ± 0,1 атм[2] | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 0,01 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | [10102-43-9] | |
| PubChem | 145068 | |
| Рег. номер EINECS | 233-271-0 | |
| SMILES |
[N]=O |
|
| InChI |
InChI=1S/NO/c1-2 MWUXSHHQAYIFBG-UHFFFAOYSA-N |
|
| RTECS | QX0525000 | |
| ChEBI | 16480 | |
| Номер ООН | 1660 | |
| ChemSpider | 127983 | |
| Безопасность | ||
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 0 OX [1] |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Окси́д азо́та(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) NO — несолеобразующий оксид азота. Молекула года (1992)[3]
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации около 17 кДж/моль. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твёрдый целиком состоит из них.
Получение[править | править код]
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах (тепловой эффект реакции −180,9 кДж):
и тотчас же реагирует с кислородом:
.
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 31 % HNO3 с некоторыми металлами, например, с медью:
.
Более чистый, не загрязнённый примесями NO можно получить по реакциям
,
.
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Rh, Cr2O3 (как катализаторов):
.
Получение NO является одной из стадий получения азотной кислоты.
Физические свойства[править | править код]
В нормальных условиях NO представляет собой бесцветный газ. Плохо растворим в воде. Имеет плотность 1,3402 кг/м³[4]. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Химические свойства[править | править код]
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
.
В результате смесь газов приобретает коричневый цвет.
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя с образованием нитрозилхлорида:
.
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
.
При температуре свыше +700 °C в присутствии оксида бария разлагается:
![{displaystyle {ce {2 NO ->[BaO, >700^oC] N2 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f576622110d6da06eb8ff51dbc93e49dff28ae1)
С водой не реагирует, является несолеобразующим оксидом.
Физиологическое действие[править | править код]
Токсичность[править | править код]
Оксид азота (II) — ядовитый газ с удушающим действием.
Действие на живые организмы[править | править код]
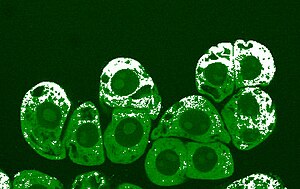
Оксид азота (белый) в цитоплазме клеток хвойных пород деревьев через час после механического воздействия. Темно-зелёные круги в клетках — ядра, в некоторых из ядер, в свою очередь, заметны ядрышки (светло-зелёные)
Оксид азота является одним из немногих известных газотрансмиттеров и, кроме того, является также химически высокореактивным свободным радикалом, способным выступать как в роли окислителя, так и в роли восстановителя. Окись азота является ключевым вторичным посредником в организмах позвоночных и играет важную роль в межклеточной и внутриклеточной передаче сигнала и, как следствие, во множестве биологических процессов.[5] Известно, что окись азота производится практически всеми типами живых организмов, от бактерий, грибов и растений до клеток животных.[6]
Окись азота, первоначально известная под именем эндотелиального сосудорасширяющего фактора (химическая природа которого тогда ещё была не известна) синтезируется в организме из аргинина при участии кислорода и НАДФ ферментом синтазой оксида азота. Восстановление неорганических нитратов также может быть использовано для производства организмом эндогенной окиси азота. Эндотелий кровеносных сосудов использует окись азота в качестве сигнала окружающим гладкомышечным клеткам расслабиться, что приводит к вазодилатации и увеличению кровотока. Окись азота является высокореактивным свободным радикалом со временем жизни порядка нескольких секунд, но при этом обладает высокой способностью к проникновению сквозь биологические мембраны. Это делает окись азота идеальной сигнальной молекулой для кратковременного аутокринного (внутри клетки) или паракринного (между близко расположенными или соседними клетками) обмена сигналами.[7]
Независимо от активности синтазы оксида азота, существует и другой путь биосинтеза окиси азота, так называемый нитрат-нитрит-оксидный путь, состоящий в последовательном восстановлении пищевых нитратов и нитритов, получаемых из растительной пищи.[8] Было показано, что богатые нитратами овощи, в особенности листовая зелень, такая, как шпинат и руккола, а также свёкла, способны повышать уровень эндогенной окиси азота и обеспечивать защиту миокарда от ишемии, а также снижать артериальное давление у лиц с предрасположенностью к артериальной гипертензии или начинающимся развитием АГ.[9][10] Для того, чтобы организм мог производить окись азота из нитратов пищи по нитрат-нитрит-оксидному пути, сначала обязательно должно произойти восстановление нитратов до нитритов с помощью сапрофитных бактерий (бактерий-комменсалов), которые обитают во рту.[11] Мониторинг содержания окиси азота в слюне позволяет обнаружить биотрансформацию растительных нитратов в нитриты и окись азота. Повышение уровня окиси азота в слюне наблюдается при диетах, богатых листовой зеленью. В свою очередь, листовая зелень — часто важнейший компонент многих антигипертензивных и «сердечных» диет, разработанных для лечения гипертонической болезни, ишемической болезни сердца, сердечной недостаточности.[12]
Выработка окиси азота повышена у людей, живущих в горах, особенно на больших высотах. Это способствует приспособлению организма к условиям пониженного парциального давления кислорода и уменьшению вероятности гипоксии за счёт увеличения кровотока как в лёгких, так и в периферических тканях. Известные эффекты окиси азота включают в себя не только вазодилатацию, но и участие в нейротрансмиссии в качестве газотрансмиттера, и активацию роста волос,[13] и образование реактивных промежуточных продуктов обмена, и участие в процессе эрекции пениса (благодаря способности окиси азота расширять сосуды полового члена). Фармакологически активные нитраты, такие, как нитроглицерин, амилнитрит, нитропруссид натрия, реализуют своё вазодилатирующее, антиангинальное (антиишемическое), гипотензивное и спазмолитическое действие благодаря тому, что из них в организме образуется окись азота. Вазодилатирующее гипотензивное лекарство миноксидил содержит остаток NO и может работать, кроме всего прочего, ещё и как агонист NO. Аналогично, силденафил и подобные ему препараты способствуют улучшению эрекции преимущественно за счёт того, что усиливают работу связанного с NO сигнального каскада в половом члене.
Окись азота способствует поддержанию гомеостаза сосудов, вызывая расслабление гладких мышц стенок сосудов и угнетая их рост и утолщение интимы сосудов (гипертензивное ремоделирование сосудов), а также угнетая адгезию и агрегацию тромбоцитов и адгезию лейкоцитов к эндотелию сосудов. У больных с атеросклерозом сосудов, сахарным диабетом или гипертензией часто имеются признаки нарушения обмена оксида азота или нарушения во внутриклеточных каскадах передачи сигнала от оксида азота.[14]
Было также показано, что высокое потребление соли снижает образование окиси азота у больных с гипертонической болезнью, хотя биодоступность окиси азота не меняется, остаётся прежней.[15]
Окись азота также образуется в процессе фагоцитоза такими способными к фагоцитозу клетками, как моноциты, макрофаги, нейтрофилы, как часть иммунного ответа на вторжение чужеродных микроорганизмов (бактерий, грибков и др.).[16] Клетки, способные к фагоцитозу, содержат индуцируемую синтазу оксида азота (iNOS), которая активируется γ-интерфероном или сочетанием фактора некроза опухоли со вторым сигналом воспаления.[17][18][19] С другой стороны, β-трансформирующий фактор роста (TGF-β) оказывает сильное угнетающее действие на активность iNOS и биосинтез оксида азота фагоцитами. Интерлейкины 4 и 10 оказывают слабое угнетающее действие на активность iNOS и биосинтез оксида азота соответствующими клетками. Таким образом, иммунная система организма обладает способностью регулировать активность iNOS и доступный фагоцитам арсенал средств иммунного ответа, что играет роль в регуляции процессов воспаления и силы иммунных реакций.[20] Оксид азота секретируется фагоцитами в процессе иммунного ответа в качестве одного из свободных радикалов и является высокотоксичным для бактерий и внутриклеточных паразитов, включая лейшманий[21] и малярийных плазмодиев.[22][23][24] Механизм бактерицидного, противогрибкового и антипротозойного действия оксида азота включает в себя повреждение ДНК бактерий, грибков и простейших[25][26][27] и повреждение железосодержащих белков с разрушением комплексов железа с серой и образованием нитрозилов железа.[28]
В ответ на это многие патогенные бактерии, грибки и простейшие эволюционно развили механизмы устойчивости к образующемуся в процессе фагоцитоза оксиду азота или механизмы его быстрого обезвреживания.[29] Поскольку повышение образования эндогенного оксида азота является одним из маркеров воспаления и поскольку эндогенный оксид азота может оказывать провоспалительное действие при таких состояниях, как бронхиальная астма и бронхообструктивные заболевания, в практической медицине наблюдается повышенный интерес к возможному использованию анализа на содержание оксида азота в выдыхаемом воздухе в качестве простого дыхательного теста при заболеваниях дыхательных путей, сопровождающихся их воспалением. Пониженные уровни эндогенного оксида азота в выдыхаемом воздухе были обнаружены у курильщиков и у велосипедистов, подвергающихся воздействию загрязнения воздуха. В то же время в других популяциях (то есть не среди велосипедистов) с воздействием загрязнения воздуха ассоциировалось повышение уровня эндогенного оксида азота в выдыхаемом воздухе.[30]
Эндогенный оксид азота может привносить свой вклад в повреждение тканей при ишемии и последующей реперфузии, поскольку в процессе реперфузии может образовываться избыточное количество оксида азота, который может реагировать с супероксидом или пероксидом водорода и образовывать сильный и токсичный окислитель, повреждающий ткани — пероксинитрит. Напротив, при отравлении паракватом вдыхание оксида азота способствует повышению выживаемости и лучшему восстановлению больных, поскольку паракват вызывает образование в лёгких больших количеств супероксида и пероксида водорода, снижение биодоступности NO вследствие его связывания с супероксидом и образования пероксинитрита и угнетение активности синтазы оксида азота.
У растений эндогенный оксид азота может производиться одним из четырёх способов:
- При помощи аргинин-зависимой синтазы оксида азота;[31][32][33] (хотя существование у растений прямых гомологов синтазы оксида азота животных всё ещё является предметом дискуссий и признаётся не всеми специалистами),[34]
- При помощи находящейся в плазматической мембране растительных клеток нитрат-редуктазы, восстанавливающей усваиваемые из почвы нитраты и нитриты;
- При помощи электронного транспорта, происходящего в митохондриях;
- При помощи неферментативного окисления аммиака или неферментативного восстановления нитратов и нитритов.
У растений эндогенный оксид азота также является сигнальной молекулой (газотрансмиттером), способствует снижению или предотвращению оксидативного стресса клеток, а также играет роль в защите растений от патогенных микроорганизмов и грибков. Было показано, что воздействие низких концентраций экзогенного оксида азота на срезанные цветы и другие растения увеличивает продолжительность времени до их увядания, пожелтения и осыпания листьев и лепестков.[35]
Два важнейших механизма, при помощи которых эндогенный оксид азота проявляет своё биологическое действие на клетки, органы и ткани — это S-нитрозилирование тиоловых соединений (включая тиоловые группы серосодержащих аминокислот, таких, как цистеин) и нитрозилирование ионов переходных металлов. S-нитрозилирование означает обратимое преобразование тиоловых групп (например, цистеиновых остатков в составе молекул белков) в S-нитрозотиолы (RSNO). S-нитрозилирование является важным механизмом динамической, обратимой посттрансляционной модификации и регуляции функций многих, если не всех, основных классов белков.[36] Нитрозилирование ионов переходных металлов подразумевает связывание NO с ионом переходного металла, такого, как железо, медь, цинк, хром, кобальт, марганец, в том числе с ионами переходных металлов в составе простетических групп или активных каталитических центров металлоферментов. В этой роли NO является нитрозильным лигандом. Типичные случаи нитрозилирования ионов переходных металлов включают в себя нитрозилирование гем-содержащих белков, таких, как цитохром, гемоглобин, миоглобин, что приводит к нарушению функции белка (в частности, невозможности гемоглобина выполнять свою транспортную функцию, или инактивации фермента). Особенно важную роль играет нитрозилирование двухвалентного железа, поскольку связывание нитрозильного лиганда с ионом двухвалентного железа особенно сильное и приводит к образованию очень прочной связи. Гемоглобин является важным примером белка, функция которого может изменяться под влиянием NO обоими способами: NO может как непосредственно связываться с железом в составе гема в реакции нитрозилирования, так и образовывать S-нитрозотиолы при S-нитрозилировании серосодержащих аминокислот в составе гемоглобина.[37]
Таким образом, существует несколько механизмов, при помощи которых эндогенный оксид азота оказывает влияние на биологические процессы в живых организмах, клетках и тканях. Эти механизмы включают окислительное нитрозилирование железосодержащих и других металлосодержащих белков, таких, как рибонуклеотид-редуктаза, аконитаза, активацию растворимой гуанилатциклазы с повышением образования цГМФ, стимуляцию АДФ-зависимого рибозилирования белков, S-нитрозилирование сульфгидрильных (тиоловых) групп белков, приводящее к их посттрансляционной модификации (активации либо инактивации), активацию регулируемых факторов транспорта железа, меди и других переходных металлов.[38] Было также показано, что эндогенный оксид азота способен активировать ядерный фактор транскрипции каппа (NF-κB) в мононуклеарных клетках периферической крови. А известно, что NF-κB является важным фактором транскрипции в регуляции процессов апоптоза и воспаления, и в частности важным фактором транскрипции в процессе индукции экспрессии гена индуцируемой синтазы оксида азота. Таким образом, продукция эндогенного оксида азота саморегулируется — повышение уровня NO угнетает дальнейшую экспрессию индуцируемой синтазы оксида азота и предотвращает чрезмерное повышение её уровня и чрезмерное повреждение тканей организма хозяина в процессе воспаления и иммунного ответа.[39]
Известно также, что вазодилатирующее действие оксида азота опосредуется в основном через стимуляцию им активности растворимой гуанилатциклазы, являющейся гетеродимерным ферментом, активирующимся при нитрозилировании. Стимуляция активности гуанилатциклазы приводит к накоплению циклического ГМФ. Увеличение концентрации в клетке циклического ГМФ приводит к повышению активности протеинкиназы G. Протеинкиназа G, в свою очередь, фосфорилирует ряд важных внутриклеточных белков, что приводит к обратному захвату ионов кальция из цитоплазмы во внутриклеточные хранилища и к открытию активируемых кальцием калиевых каналов. Снижение концентрации ионов кальция в цитоплазме клетки приводит к тому, что киназа лёгкой цепи миозина, активируемая кальцием, теряет активность и не может фосфорилировать миозин, что приводит к нарушению образования в молекуле миозина «мостиков» и нарушению его свёртывания в более компактную структуру (сокращения), а следовательно и к расслаблению гладкомышечной клетки. А расслабление гладкомышечных клеток стенок сосудов ведёт к расширению сосудов (вазодилатации) и увеличению кровотока.[40]
См. также[править | править код]
- Реактивные формы азота
Примечания[править | править код]
- ↑ NITRIC OXIDE | CAMEO Chemicals | NOAA. Дата обращения: 1 апреля 2022. Архивировано 18 июля 2022 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0448.html
- ↑ D. E. Koshland, Jr. The Molecule of the Year (англ.) // Science : journal. — 1992. — Vol. 258, no. 5090. — P. 1861. — doi:10.1126/science.1470903. — Bibcode: 1992Sci…258.1861K. — PMID 1470903.
- ↑ Азота оксиды // Химическая энциклопедия / Ред. колл.: Кнунянц И. Л. и др. — М. : Советская энциклопедия, 1988. — Т. 1 : Абл—Дар. — 623 с.
- ↑ Weller, Richard, Could the sun be good for your heart? Архивная копия от 16 февраля 2014 на Wayback Machine TedxGlasgow. Filmed March 2012, posted January 2013
- ↑ Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- ↑ Stryer, Lubert. Biochemistry, 4th Edition (англ.). — W.H. Freeman and Company (англ.) (рус., 1995. — P. 732. — ISBN 0-7167-2009-4.
- ↑ Plant-based Diets | Plant-based Foods | Beetroot Juice | Nitric Oxide Vegetables. Berkeley Test. Дата обращения: 4 октября 2013. Архивировано из оригинала 4 октября 2013 года.
- ↑ Ghosh, S. M.; Kapil, V.; Fuentes-Calvo, I.; Bubb, K. J.; Pearl, V.; Milsom, A. B.; Khambata, R.; Maleki-Toyserkani, S.; Yousuf, M.; Benjamin, N.; Webb, A. J.; Caulfield, M. J.; Hobbs, A. J.; Ahluwalia, A. Enhanced Vasodilator Activity of Nitrite in Hypertension: Critical Role for Erythrocytic Xanthine Oxidoreductase and Translational Potential (англ.) // Hypertension : journal. — 2013. — Vol. 61, no. 5. — P. 1091—1102. — doi:10.1161/HYPERTENSIONAHA.111.00933. — PMID 23589565.
- ↑ Webb, A. J.; Patel, N.; Loukogeorgakis, S.; Okorie, M.; Aboud, Z.; Misra, S.; Rashid, R.; Miall, P.; Deanfield, J.; Benjamin, N.; MacAllister, R.; Hobbs, A. J.; Ahluwalia, A. Acute Blood Pressure Lowering, Vasoprotective, and Antiplatelet Properties of Dietary Nitrate via Bioconversion to Nitrite (англ.) // Hypertension : journal. — 2008. — Vol. 51, no. 3. — P. 784—790. — doi:10.1161/HYPERTENSIONAHA.107.103523. — PMID 18250365. — PMC 2839282.
- ↑ Hezel, MP; Weitzberg, E. The oral microbiome and nitric oxide homoeostasis (англ.) // Oral Diseases. — 2013. — P. n/a. — doi:10.1111/odi.12157.
- ↑ Green, Shawn J. Turning DASH Strategy into Reality for Improved Cardio Wellness Outcomes: Part II. Real World Health Care (25 июля 2013). Дата обращения: 4 октября 2013. Архивировано 17 февраля 2015 года.
- ↑ Proctor, P. H. Endothelium-Derived Relaxing Factor and Minoxidil: Active Mechanisms in Hair Growth (англ.) // Archives in Dermatology : journal. — 1989. — August (vol. 125, no. 8). — P. 1146. — doi:10.1001/archderm.1989.01670200122026. — PMID 2757417.
- ↑ Dessy, C.; Ferron, O. Pathophysiological Roles of Nitric Oxide: In the Heart and the Coronary Vasculature (англ.) // Current Medical Chemistry – Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry : journal. — 2004. — Vol. 3, no. 3. — P. 207—216. — doi:10.2174/1568014043355348.
- ↑ Osanai, T; Fujiwara, N; Saitoh, M; Sasaki, S; Tomita, H; Nakamura, M; Osawa, H; Yamabe, H; Okumura, K. Relationship between salt intake, nitric oxide, and asymmetric dimethylarginine and its relevance to patients with end-stage renal disease (англ.) // Blood purification : journal. — 2002. — Vol. 20, no. 5. — P. 466—468. — doi:10.1159/000063555. — PMID 12207094.
- ↑ Green, SJ; Mellouk, S; Hoffman, SL; Meltzer, MS; Nacy, C. A. Cellular mechanisms of nonspecific immunity to intracellular infection: Cytokine-induced synthesis of toxic nitrogen oxides from L-arginine by macrophages and hepatocytes (англ.) // Immunology letters : journal. — 1990. — Vol. 25, no. 1—3. — P. 15—9. — doi:10.1016/0165-2478(90)90083-3. — PMID 2126524.
- ↑ Gorczyniski and Stanely, Clinical Immunology. Landes Bioscience; Austin, TX. ISBN 1-57059-625-5
- ↑ Green, SJ; Nacy, CA; Schreiber, RD; Granger, DL; Crawford, RM; Meltzer, MS; Fortier, A. H. Neutralization of gamma interferon and tumor necrosis factor alpha blocks in vivo synthesis of nitrogen oxides from L-arginine and protection against Francisella tularensis infection in Mycobacterium bovis BCG-treated mice (англ.) // Infection and immunity (англ.) (рус. : journal. — 1993. — Vol. 61, no. 2. — P. 689—698. — PMID 8423095. — PMC 302781.
- ↑ Kamijo, R; Gerecitano, J; Shapiro, D; Green, SJ; Aguet, M; Le, J; Vilcek, J. Generation of nitric oxide and clearance of interferon-gamma after BCG infection are impaired in mice that lack the interferon-gamma receptor (англ.) // Journal of inflammation : journal. — 1995. — Vol. 46, no. 1. — P. 23—31. — PMID 8832969.
- ↑ Green, SJ; Scheller, LF; Marletta, MA; Seguin, MC; Klotz, FW; Slayter, M; Nelson, BJ; Nacy, C. A. Nitric oxide: Cytokine-regulation of nitric oxide in host resistance to intracellular pathogens (англ.) // Immunology letters : journal. — 1994. — Vol. 43, no. 1—2. — P. 87—94. — doi:10.1016/0165-2478(94)00158-8. — PMID 7537721.
- ↑ Green, SJ; Crawford, RM; Hockmeyer, JT; Meltzer, MS; Nacy, C. A. Leishmania major amastigotes initiate the L-arginine-dependent killing mechanism in IFN-gamma-stimulated macrophages by induction of tumor necrosis factor-alpha (англ.) // Journal of immunology (англ.) (рус. : journal. — 1990. — Vol. 145, no. 12. — P. 4290—4297. — PMID 2124240.
- ↑ Seguin, M. C.; Klotz, FW; Schneider, I; Weir, JP; Goodbary, M; Slayter, M; Raney, JJ; Aniagolu, JU; Green, S. J. Induction of nitric oxide synthase protects against malaria in mice exposed to irradiated Plasmodium berghei infected mosquitoes: Involvement of interferon gamma and CD8+ T cells (англ.) // Journal of Experimental Medicine (англ.) (рус. : journal. — Rockefeller University Press (англ.) (рус., 1994. — Vol. 180, no. 1. — P. 353—358. — doi:10.1084/jem.180.1.353. — PMID 7516412. — PMC 2191552.
- ↑ Mellouk, S; Green, SJ; Nacy, CA; Hoffman, S. L. IFN-gamma inhibits development of Plasmodium berghei exoerythrocytic stages in hepatocytes by an L-arginine-dependent effector mechanism (англ.) // Journal of immunology (англ.) (рус. : journal. — 1991. — Vol. 146, no. 11. — P. 3971—3976. — PMID 1903415.
- ↑ Klotz, FW; Scheller, LF; Seguin, MC; Kumar, N; Marletta, MA; Green, SJ; Azad, A. F. Co-localization of inducible-nitric oxide synthase and Plasmodium berghei in hepatocytes from rats immunized with irradiated sporozoites (англ.) // Journal of immunology (англ.) (рус. : journal. — 1995. — Vol. 154, no. 7. — P. 3391—3395. — PMID 7534796.
- ↑
Wink, D.; Kasprzak, K.; Maragos, C.; Elespuru, R.; Misra, M; Dunams, T.; Cebula, T.; Koch, W.; Andrews, A.; Allen, J.; Et, al. DNA deaminating ability and genotoxicity of nitric oxide and its progenitors (англ.) // Science : journal. — 1991. — Vol. 254, no. 5034. — P. 1001—1003. — doi:10.1126/science.1948068. — PMID 1948068. - ↑
Nguyen, T.; Brunson, D.; Crespi, C. L.; Penman, B. W.; Wishnok, J. S.; Tannenbaum, S. R. DNA Damage and Mutation in Human Cells Exposed to Nitric Oxide in vitro (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1992. — Vol. 89, no. 7. — P. 3030. — doi:10.1073/pnas.89.7.3030. Free text. - ↑ Li, Chun-Qi; Pang, Bo; Kiziltepe, Tanyel; Trudel, Laura J.; Engelward, Bevin P.; Dedon, Peter C.; Wogan, Gerald N. Threshold Effects of Nitric Oxide-Induced Toxicity and Cellular Responses in Wild-Type and p53-Null Human Lymphoblastoid Cells (англ.) // Chemical Research in Toxicology (англ.) (рус. : journal. — 2006. — Vol. 19, no. 3. — P. 399—406. — doi:10.1021/tx050283e. — PMID 16544944. — PMC 2570754. free text
- ↑ Hibbs, John B.; Taintor, Read R.; Vavrin, Zdenek; Rachlin, Elliot M. Nitric oxide: A cytotoxic activated macrophage effector molecule (англ.) // Biochemical and Biophysical Research Communications (англ.) (рус. : journal. — 1988. — Vol. 157, no. 1. — P. 87—94. — doi:10.1016/S0006-291X(88)80015-9. — PMID 3196352.
- ↑ Janeway, C. A.; and others. Immunobiology: the immune system in health and disease (англ.). — 6th. — New York: Garland Science (англ.) (рус., 2005. — ISBN 0-8153-4101-6.
- ↑ Jacobs, Lotte; Nawrot, Tim S; De Geus, Bas; Meeusen, Romain; Degraeuwe, Bart; Bernard, Alfred; Sughis, Muhammad; Nemery, Benoit; Panis, Luc. Subclinical responses in healthy cyclists briefly exposed to traffic-related air pollution: An intervention study (англ.) // Environmental Health (англ.) (рус. : journal. — 2010. — Vol. 9. — P. 64. — doi:10.1186/1476-069X-9-64. — PMID 20973949. — PMC 2984475.
- ↑ Corpas, F. J.; Barroso, JB; Carreras, A; Quirós, M; León, AM; Romero-Puertas, MC; Esteban, FJ; Valderrama, R; Palma, JM; Sandalio, LM; Gómez, M; Del Río, L. A. Cellular and subcellular localization of endogenous nitric oxide in young and senescent pea plants (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2004. — Vol. 136, no. 1. — P. 2722—2733. — doi:10.1104/pp.104.042812. — PMID 15347796. — PMC 523336.
- ↑ Corpas, F. J.; Barroso, Juan B.; Carreras, Alfonso; Valderrama, Raquel; Palma, José M.; León, Ana M.; Sandalio, Luisa M.; Del Río, Luis A. Constitutive arginine-dependent nitric oxide synthase activity in different organs of pea seedlings during plant development (англ.) // Planta : journal. — 2006. — Vol. 224, no. 2. — P. 246—254. — doi:10.1007/s00425-005-0205-9. — PMID 16397797.
- ↑ Valderrama, R.; Corpas, Francisco J.; Carreras, Alfonso; Fernández-Ocaña, Ana; Chaki, Mounira; Luque, Francisco; Gómez-Rodríguez, María V.; Colmenero-Varea, Pilar; Del Río, Luis A.; Barroso, Juan B. Nitrosative stress in plants (англ.) // FEBS Lett (англ.) (рус. : journal. — 2007. — Vol. 581, no. 3. — P. 453—461. — doi:10.1016/j.febslet.2007.01.006. — PMID 17240373.
- ↑ Corpas, F. J.; Barroso, Juan B.; Del Rio, Luis A. Enzymatic sources of nitric oxide in plant cells – beyond one protein–one function (англ.) // New Phytologist (англ.) (рус. : journal. — 2004. — Vol. 162, no. 2. — P. 246—247. — doi:10.1111/j.1469-8137.2004.01058.x.
- ↑ Siegel-Itzkovich J. Viagra makes flowers stand up straight // BMJ. — 1999. — 31 июля (т. 319, № 7205). — С. 274—274. — ISSN 0959-8138. — doi:10.1136/bmj.319.7205.274a. [исправить]
- ↑ van Faassen, E. and Vanin, A. (eds.) (2007) Radicals for life: The various forms of nitric oxide. Elsevier, Amsterdam, ISBN 978-0-444-52236-8
- ↑ van Faassen, E. and Vanin, A. (2004) «Nitric Oxide», in Encyclopedia of Analytical Science, 2nd ed., Elsevier, ISBN 0-12-764100-9.
- ↑ Shami, PJ; Moore, JO; Gockerman, JP; Hathorn, JW; Misukonis, MA; Weinberg, J. B. Nitric oxide modulation of the growth and differentiation of freshly isolated acute non-lymphocytic leukemia cells (англ.) // Leukemia research : journal. — 1995. — Vol. 19, no. 8. — P. 527—533. — doi:10.1016/0145-2126(95)00013-E. — PMID 7658698.
- ↑ Kaibori M., Sakitani K., Oda M., Kamiyama Y., Masu Y. and Okumura T. Immunosuppressant FK506 inhibits inducible nitric oxide synthase gene expression at a step of NF-κB activation in rat hepatocytes (англ.) // J. Hepatol. : journal. — 1999. — Vol. 30, no. 6. — P. 1138—1145. — doi:10.1016/S0168-8278(99)80270-0. — PMID 10406194.
- ↑ Rhoades, RA; Tanner, G. A. Medical physiology 2nd edition (англ.). — 2003.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
NO + NaOH ≠
NO + KOH ≠
NO + Na2O ≠
NO + CO2 ≠
NO + HCl ≠
Окислы азота (оксиды азота) это соединения азота с кислородом, например диоксид азота NO2 — это химическое соединение, образующееся из азота и кислорода.
Это один из немногих оксидов азота, таких как монооксид азота, закись азота и т.д. Химическая формула любого соединения может быть либо эмпирической формулой, либо молекулярной формулой.
Эмпирическая формула — это простейшее отношение целого числа атомов в соединении, тогда как молекулярная формула — это та, которая определяет количество атомов каждого элемента в одной молекуле.
Эмпирическая и молекулярная формула диоксида азота — NO2 потому что он определяет количество каждого элемента, а также простейшее соотношение целых чисел, которое составляет 1 : 2 для азота и кислорода в диоксиде азота.
ОКИСЛЫ АЗОТА ЧТО ЭТО
Азот образует с кислородом шесть окислов: закись азота N2O, окись азота NO, двуокись азота NO2, четырехокись азота N2O4, азотистый ангидрид N2O3 и азотный ангидрид N2O5.
Все окислы азота могут быть получены из азотной кислоты и ее солей.
Оксид азота (NO) и диоксид азота(NO2) являются двумя наиболее значимыми токсикологически важными соединениями.
Оксиды азота проявляют различные степени окисления, варьирующиеся от + 1 до + 5 в его оксидных формах.
Оксиды азота, содержащие азот в более высокой степени окисления, являются более кислыми, чем оксиды в более низкой степени окисления.
Диоксид азота образуется в процессе производства азотной кислоты.
Большая часть азотной кислоты используется в производстве удобрений, в то время как некоторые из них используются в производстве взрывчатых веществ как для военных, так и для горнодобывающих целей.
Другими газами этой группы являются монооксид азота (или N2O) и пятиокись азота (N2O5). Ряд оксидов азота образуется в результате реакции азота с кислородом.
Закись азота N2O
Закись азота, монооксид азота, оксид азота имеет формулу N2O (веселящий газ). Закись азота получается при нагревании нитрата аммония:
NH4NO3 = N2O + 2H2O
При этой реакции один из атомов азота, входящих в состав NH4NO3, теряет электроны, а другой — приобретает их, причем оба атома азота становятся положительно одновалентными.
Монооксид азота представляет собой бесцветный газ. Его структура связи включает валентный электрон и он относится к классу двухатомных молекул.
Монооксид азота может быть получен путем восстановления разбавленной азотной кислоты медью.
3H2SO4 + 2NaNO2 + 2FeSO4 → 2NaHSO4 + Fe2(SO4)3 + 2H2O + 2NO
Закись азота что такое
Закись азота представляет собой бесцветный, не имеющий запаха газ, сгущающийся в жидкость при 0° под давлением 30 ат.
Она довольно хорошо растворима в воде: при 0° один объем воды растворяет 1,3, а при 25° — 0,6 объема N2O. При растворении закись азота никакого соединения с водой не образует.
Закись азота — эндотермическое соединение, легко разлагающееся при нагревании на азот и кислород:
2N2O = 2N2+ O2 + 19,5 ккал
поэтому она хорошо поддерживает горение.
Тлеющая лучинка, опущенная в закись азота, вспыхивает в ней, как в чистом кислороде; фосфор, сера и другие вещества также энергично сгорают в закиси азота, освобождая азот.
Закись азота для чего
Вдыхание небольших количеств закиси азота приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза при легких операциях.
Большие количества закиси азота возбуждающе действуют на нервную систему; поэтому раньше ее называли «веселящим газом».
Азот оксид

Окись азота (оксид азота) NO это газ. При обыкновенных условиях азот и кислород не вступают в реакцию друг с другом.
Но при очень высокой температуре, например при пропускании электрических искр через воздух, азот может непосредственно соединяться с кислородом, давая окись азота.
Поэтому окись азота всегда образуется в атмосфере при грозовых разрядах.
NO это несолеобразующий оксид азота, бесцветный газ, молярная масса 30,0061 г/моль. NO строение состоит из одной молекулы азота и одной молекулы кислорода.
Как получить оксид азота
NO получение зависит от зависит от условий. Образование окиси азота при электрическом разряде может быть иллюстрировано следующим опытом.
В большую колбу (рис.) через боковые горла вставляют на пробках две толстые медные проволоки и соединяют их с полюсами большой индукционной катушки.
При пропускании через катушку тока между концами проволок образуется непрерывная искра, а над ней появляется желтоватое пламя «горящего» в кислороде азота.
Реакция образования окиси азота из азота и кислорода обратима и сопровождается поглощением большого количества тепла:
N2 + О2 ⇄ 2NO — 43,2 ккал .
При низкой температуре равновесие этой реакции практически полностью сдвинуто влево, т. е, количество образующейся окиси азота ничтожно мало.
С повышением температуры равновесие начинает смещаться вправо, и о так медленно, что даже при 1000° в смеси газов содержится всего лишь около 1% окиси азота.
При понижении температуры окись азота снова разлагается на азот и кислород.
Но если очень быстро охладить газовую смесь, то равновесие не успевает сразу сместиться, а потом уже не смещается вследствие крайне малой скорости реакции при низкой температуре.
Таким образом, в смеси остается почти то же количество NO, которое образовалось при высокой температуре.
В лаборатории no получение сводиться к взаимодействию разбавленной азотной кислоты с медью:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4Н2O
или в ионной форме
3Cu + 2NO3‘ + 8H• = 3Cu•• + 2NO + 4H2O
Химические физические свойства оксида азота no
Газ no или окись азота представляет собой бесцветный газ, очень трудно сжижаемый. Жидкая окись азота кипит при —151,8° и затвердевает при —163,7°
В воде она растворима лишь незначительно один объем воды растворяет при 0° всего 0,07 объема NO газа.
По химическим свойствам окись азота относится к числу безразличных окислов, так как не образует никакой кислоты.
Окись азота труднее других окислов азота отдает свой кислород. Поэтому в ней могут гореть лишь такие вещества, которые особенно энергично соединяются с кислородом, как, например, фосфор.
Но зажженная свеча, лучинка, сера гаснут при внесении их в окись азота.
Наиболее характерным свойством окиси азота является ее способность легко, без всякого нагревания, соединяться с кислородом с образованием бурой двуокиси азота:
2NO + О2 = 2NO2 — 27 ккал.
Если, например, открыть цилиндр, наполненный окисью азота, то у отверстия его тотчас же появляется бурое облако двуокиси азота.
Двуокись азота

Диоксид азота представляет собой красновато-коричневый ядовитый газ с резким запахом.
Строение NO2 молекулы.
Бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21,3°), который в значительной степени способствует загрязнению воздуха во всем мире.
Он кислый по своей природе со степенью окисления азота +4. Диоксид азота образуется в результате термического разложения нитрата металла.
2Pb(NO3)2 → 4NO2 + 2PbO + O2
При охлаждении постепенно светлеет и при —10° замерзает, образуя бесцветную кристаллическую массу.
Наоборот, при нагревании газообразной двуокиси азота ее окраска усиливается, а при 140° становится почти черной.
Изменение окраски двуокиси азота при повышении температуры сопровождается и изменением плотности ее пара.
При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4. С повышением температуры плотность пара уменьшается и при 140° в точности соответствует формуле NО2.
Отсюда следует, что бесцветные кристаллы, существующие при —10° и ниже, состоят, вероятно, целиком из молекул N2О4 и могут быть названы четырехокисью азота.
По мере нагревания бесцветная четырехокись азота постепенно диссоциирует с образованием молекул темно-бурой двуокиси азота NО2 полная диссоциация происходит при 140°.
Поэтому при температурах от —10° до +140° всегда имеется смесь молекул NO2 и N2О4, находящихся в равновесии друг с другом:
N2О4 ⇄ 2NО2 — 13,6 ккал
Выше 140° начинается диссоциация NО2 на NO и кислород.
Химические свойства двуокиси азота
Двуокись азота очень энергичный окислитель. Многие вещества могут гореть в двуокиси азота, отнимая от нее кислород.
Сернистый газ окисляется ею в серный ангидрид, на чем основан нитрозный метод получения серной кислоты.
Пары двуокиси азота довольно ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде двуокись или, вернее, четырехокись азота вступает в реакцию с водой, образуя азотную и азотистую кислоты:
N2O4 + Н2O = HNO3 + HNО2
Но азотистая кислота очень неустойчива и быстро разлагается на азотную кислоту, окись азота и воду:
3HNO2 = HNO3 + 2NO + Н2O
Поэтому практически взаимодействие двуокиси (четырех окиси) азота с водой, особенно с теплой, идет по уравнению
3N2O4 + 2Н2O = 4HNO3 + 2NO
которое легко может быть получено сложением двух предыдущих уравнений, если предварительно первое из них умножить на 3.
В присутствии воздуха образующаяся окись азота немедленно окисляется в двуокись азота, так что в этом случае NO2 полностью переходит в азотную кислоту.
Эта реакция имеет важное техническое значение и используется в современных способах получения азотной кислоты.
Если растворять двуокись (четырехокись) азота в щелочах, то образуется смесь солей азотной и азотистой кислот:
N2O4 + 2NaOH = NaNO3 + NaNO2 + H2O
Приведенные выше реакции взаимодействия четырехокиси азота с водой и щелочами показывают, что в молекуле этого вещества один атом азота имеет валентность +5, а другой — валентность +3.
Поэтому четырехокись азота часто называют смешанным ангидридом азотистой и азотной кислот и изображают ее структурную формулу следующим образом:

Если мы подсчитаем общее число валентных электронов у всех атомов в молекулах NO и NO2, то найдем, что оно равно соответственно 11 (5 + 6) и 17 (5 + 2 • 6), т. е. выражается нечетными числами.
Окись и двуокись азота относятся к ограниченному числу молекул с нечетным числом электронов.
Такие молекулы ведут себя в химическом отношении, как свободные атомы, тоже имеющие неспаренные электроны.
Молекулы с неспаренными электронами называются свободными радикалами.
Применение двуокиси азота
Газообразный диоксид азота используется в качестве катализатора в некоторых процессах окисления.
Он используется в качестве ингибитора полимеризации акрилатов в процессе дистилляции. Он используется в качестве нитрующего агента и ведет себя как органическое соединение.
Другие области применения включают его использование в качестве окислителя, ракетного топлива и отбеливателя муки.
Для получения азотной кислоты, которая в свою очередь используется в производстве взрывчатых веществ.
Четырехокись азота
Четырехокись азота представляет собой бесцветное твердое вещество, находящееся в равновесии с диоксидом азота.
Это эффективный окислитель, который используется в качестве растворителя для производства многих химических веществ.
В смеси с легко воспламеняющимися веществами взрывоопасен.
N2O4 ⇄ 2NO2
Азотистый ангидрид N2O3
Азотистый ангидрид или триоксид азота имеет формулу NO3. Представляет собой темно-синюю жидкость, кипящую при +4° и разлагающуюся при этом на окись и двуокись азота.
Он может быть нерастворимым только при низких температурах, то есть в жидкой и твердой фазах.
При повышении температуры равновесие приводит к образованию составляющих газов.
Триоксид азота N2O3 получают путем смешивания равных частей оксида азота и диоксида азота и дальнейшего охлаждения смеси.
Смесь равных объемов окиси и двуокиси азота при охлаждении вновь образует азотистый ангидрид:
N2O3 ⇄ NO + NO2
Азотистому ангидриду соответствует азотистая кислота HNO2.
Триоксид азота представляет собой темно-синее кислотное твердое вещество.
Азотный ангидрид
Азотный ангидрид N2O5 (пентоксид динитрогена) — твердое кристаллическое вещество, плавящееся при 30°. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
2HNO3 + Р2O5 = N2O5 + 2НРО3
Азотный ангидрид является очень сильным окислителем. Многие органические вещества при соприкосновении с ним воспламеняются.
Он подвергается сублимации при незначительной температуре выше комнатной. Это неустойчивый и потенциально опасный окислитель.
Его использовали в качестве растворителя, разбавленного хлороформом для нитрования.
В воде азотный ангидрид легко растворяется с образованием азотной кислоты.
Вопросы от ответы по оксидам азота?
Каковы промышленные и природные источники выбросов оксидов азота?
Промышленные источники азота включают добычу нефти и газа, электроснабжение, горнодобывающую промышленность, обрабатывающую промышленность и производство нефти.
К естественным источникам выбросов азота относятся:
Биологическая переработка азота включает процессы, в ходе которых в качестве промежуточных продуктов образуются оксид азота и закись азота.
Тепловые процессы в атмосфере, происходящие во время молний или лесных пожаров, также приводят к образованию оксидов азота.
Каковы способы сокращения выбросов оксидов азота для устранения загрязнения воздуха?
Использование ограниченного количества азотных удобрений.
Использование каталитических нейтрализаторов в автомобилях для снижения выбросов
Это можно сделать двумя способами:
- Восстановление: Удаление кислорода из оксида азота.
- Окисление: добавление кислорода к окиси углерода с образованием углекислого газа, который менее вреден, чем окись углерода.
Каковы некоторые области применения закиси азота?
Некоторые области применения закиси азота следующие:
Используется для успокоения в стоматологии.
Используется в качестве обезболивающего средства для контроля боли.
Он чрезвычайно безопасен не вступает в реакцию с жидкостями организма. Уменьшает беспокойство, быстрое выздоровление
Каково воздействие азотной кислоты на здоровье?
Низкий уровень оксидов азота может вызвать раздражение глаз, носа, горла и легких, что, вероятно, приводит к кашлю, одышке, усталости и тошноте.
Воздействие может также привести к накоплению жидкости в легких через 1-2 дня после воздействия.
Вдыхание высоких концентраций оксидов азота может вызвать быстрое жжение, судороги и отек тканей в горле и верхних дыхательных путях, снижение насыщения кислородом и в некоторых случаях может даже привести к смерти.
Роль оксида азота в истончении кровеносных сосудов делает его важным регулятором артериального давления.
Оксид азота также вырабатывается нервными клетками и используется нервной системой для нейро-трансмиссии. Она включает в себя контрольные функции, начиная от пищеварения, кровотока, памяти и зрения.
139 140 141
Статья на тему Окислы азота
| Оксид азота(II) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
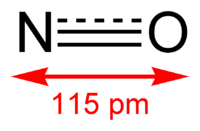
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Физиологическое действие
- 4 Применение
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
- N2 + O2 → 2NO — 180,9 кДж
и тотчас же реагирует с кислородом:
- 2NO + O2 → 2NO2.
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
- 3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O.
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
- FeCl2 + NaNO2 + 2HCl → FeCl3 + NaCl + NO↑ + H2O;
- 2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O.
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
- 4NH3 + 5O2 → 4NO + 6H2O.
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
- 2NO + O2 → 2NO2
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
- 2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
- 2SO2 + 2NO → 2SO3 + N2↑.
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
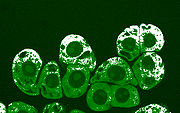
Оксид азота (белый) в цитоплазме клеток хвойных пород деревьев через час после механического воздействия.
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Оксид азота может синтезироваться несколькими путями. Растения используют неферментативную фотохимическую реакцию между NO2 и каротиноидами. У животных синтез осуществляют семейство NO-синтаз (NOS). NOS-ферменты – члены гем-содержащего суперсемейства ферментов, названных монооксигеназами. В зависимости от структуры и функций, NOS могут быть разделены на три группы: эндотелиальные (eNOS), нейрональные (nNOS) и индуцибельные (iNOS). В активный центр любой из NO-синтаз входит железопорфириновый комплекс, содержащий аксиально координированный цистеин или метионин. Хотя все изоформы NOS катализируют образование NO, все они являются продуктами различных генов, каждая из них имеет свои особенности как в механизмах действия и локализации, так и в биологическом значении для организма. Поэтому указанные изоформы принято также подразделять на конститутивную (cNOS) и индуцибельную (iNOS) синтазы оксида азота. cNOS постоянно находится в цитоплазме, зависит от концентрации ионов кальция и кальмодулина (белок, являющийся внутриклеточным посредником переноса ионов кальция) и способствует выделению небольшого количества NO на короткий период в ответ на стимуляцию рецепторов. Индуцибельная NOS появляется в клетках только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления, такими как гамма-интерферон, фактор некроза опухоли и др. Количество NO, образующегося под влиянием iNOS, может варьировать и достигать больших количеств (наномолей). При этом продукция NO сохраняется длительнее. Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. Внутри клетки он активирует одни энзимы и ингибирует другие, таким образом, участвуя в регуляции клеточных функций. По сути, монооксид азота является локальным тканевым гормоном. NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно в очаге воспаления накапливается супероксид, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет его цитотоксическое действие на клетку-мишень. Следовательно, NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой – давать провоспалительный эффект. Оксид азота способен инициировать ангиогенез (образование кровеносных сосудов). В случае инфаркта миокарда оксид азота играет положительную роль, т.к. индуцирует новый сосудистый рост, но при раковых заболеваниях тот же самый процесс вызывает развитие опухолей, способствуя питанию и росту раковых клеток. С другой стороны, вследствие этого улучшается доставка оксида азота в опухолевые клетки. Повреждение ДНК под действием NO является одной из причин развития апоптоза (запрограммированный процесс клеточного «самоубийства», направленный на удаление клеток, утративших свои функции). В экспериментах наблюдалось дезаминирование дезоксинуклеозидов, дезоксинуклеотидов и неповрежденной ДНК при воздействии раствора, насыщенного NO. Этот процесс ответственен за повышение чувствительности клеток к алкилирующим агентам и ионизирующему излучению, что используется в антираковой терапии.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
В 1998 году трое американцев – Фурчготт, Игнарро и Мюрад – были удостоены премии Нобелевского комитета по физиологии «за открытия, касающиеся окиси азота как сигнальной молекулы в сердечно-сосудистой системе».
Применение
Получение NO является одной из стадий получения азотной кислоты .
Wikimedia Foundation.
2010.
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые – изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
Формула – N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.
Свойства
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Получение
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения – термическое разложение смеси “сульфаминовая + азотная кислота”.
Применение
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
Формула – NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Свойства
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Получение
Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Применение
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)

Формула – N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.
Свойства
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных – бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Получение
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
Применение
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
Формула – NO2. Также его могут называть диоксидом азота или бурым газом.
Свойства
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Получение
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
Формула – N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.
Свойства
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС.
Получение
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Применение
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре – это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство – высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ – токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого – связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.




