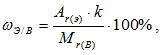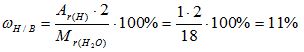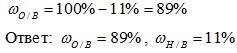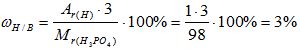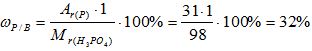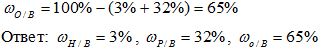Как найти омега в Химии?
Ученик
(116),
закрыт
7 лет назад
Вячек
Высший разум
(391245)
8 лет назад
Буквой “w” (греческая “омега”) в химии обычно обозначают массовую долю – или вещества в растворе, или элемента в сложном веществе. Для обоих случаев существую стандартные формулы:
1) w(в-ва) = m(в-ва) /m(р-ра)
2) w(эл-та) = n*Ar(эл-та) /M(в-ва), где n – количество атомов элемента в веществе, Аr – относительная атомная масса элемента (берётся в таблице Менделеева), Mr – относительная молекулярная масса сложного вещества
Расчёт массовой доли химических элементов по формуле вещества
Формула для вычисления массовой доли элемента в веществе
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греч. буквой «омега» – ωЭ/В и рассчитывается по формуле:
где k – число атомов этого элемента в молекуле.
Задача 1
Какова массовая доля водорода и кислорода в воде (Н2О)?
Решение:
1) Вычисляем относительную молекулярную массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Рис. 1. Оформление решения задачи 1
Задача 2
Рассчитайте массовую долю элементов в веществе H3PO4.
Решение:
1) Вычисляем относительную молекулярную массу вещества:
Mr(Н3РО4) = 3*Аr(Н) + 1*Аr(Р) + 4*Аr(О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
Последнее изменение: Воскресенье, 15 Октябрь 2017, 21:29
Назад
Приветствую вас, дорогие читатели!
В этой статье разберем такой вопрос: КАК РЕШАТЬ ЗАДАЧИ ТИПА №27?
Немного теории…
Данное задание связано с формулой определения массовой доли вещества (омега):
где
ω (омега) – массовая доля вещества (%);
m в-ва – масса вещества (г);
m р-ра – масса раствора (г).
Что это такое?
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Некоторая сложность заключается в том, что условии может быть дано несколько массовых долей, например. Классическим способом решать такие задачи будет труднее, и вы больше потратите времени при выполнении данного задания. На заметку: ЭТО ЗАДАНИЕ ОЦЕНИВАЕТСЯ В ОДИН БАЛЛ. Оно считается заданием базового уровня сложности.
Для того, чтобы упростить себе задачу, предлагаю вам «метод стаканчиков»:
Верхнюю часть дроби умножаем на нижнюю и получаем равенство:
w 1 * m 1 + w 2 * m 2 = w 3 * m 3
Массовые доли растворов будут даны в задаче, а вот некоторые необходимо запомнить:
– массовая доля H 2 O = 0%;
-массовая доля чистого вещества = 100%;
-массовая доля чистого вещества в кристаллогидрате:
Это все, что касается теории. Давайте разберем несколько примеров.
№1. К 300 г 6%-го раствора серной кислоты прилили 100 г воды. Массовая доля кислоты в полученном растворе равна__________%. (Запишите число с точностью до десятых.)
Решение
Имеется раствор серной кислоты с известной массой и массовой долей, поэтому записываем таким образом: 6%/300 г.
К нему добавляем воду. Масса воды известна, а массовая доля для воды всегда 0%, поэтому составляем второй стаканчик: 0%/100 г.
Так как воду прилили, то между этими дробями или стаканчиками ставим знак «+».
Масса раствора увеличилась, поэтому: 300 + 100 = 400 г, а массовая доля неизвестна, обозначаем за х .
В результате получается такое выражение:
которое несложно решить.
№2 . После упаривания 500 мл 10%-го раствора хлорида калия (плотность 1,11 г/мл) его масса уменьшилась на 100 г. Массовая доля соли в полученном растворе равна_______%. (Запишите число с точностью до десятых).
Решение
Особенность составления стаканчиков заключается в том, что в верхней части дроби всегда должны быть проценты, а в нижней – граммы.
Для составления первого стаканчика необходимо перевести мл в г по формуле: m 1(р-ра) = V 1(р-ра) * ρ1(р-ра) = 500 мл * 1,11 г/мл = 555 г.
Получаем: 10%/555 г.
В условии задачи есть слово «упарили» — это значит, что между дробями будет знак «-». Выпаривают воду, поэтому второй стаканчик выглядит следующим образом: 0%/100 г.
Получается раствор массой 555 – 100 = 455г, а массовая доля – x %.
Составляем выражение:
и решаем.
№3. При охлаждении 350 г 25%-го раствора сульфата меди (II) с 90 0С до 20 0С в осадок выпало 100 г осадка медного купороса CuSO4 * 5H2O . Массовая доля соли в полученном растворе равна______%. (Запишите число с точностью до десятых.)
Решение
Имеется раствор с массовой долей: 25%/350 г, затем его охладили и выпал осадок в виде кристаллогидрата CuSO4 *5H2O массой 100 г. Здесь необходимо найти массовую долю CuSO4 в кристаллогидрате по формуле:
Составляем второй стаканчик: 64%/100 г. Так как раствор охладили, то между дробями будет знак «-».
Получается раствор массой 350 – 100 = 250 г, а массовая доля – x %.
Составляем выражение:
и решаем.
Для закрепления материла предлагаю вам задачи с ответами для самопроверки.
№1. Для приготовления 2 л 37%-й аккумуляторной серной кислоты (плотностью 1,29 г/мл) потребуется 95%-я серная кислота массой_____г. (Запишите число с точностью до целых.)
Ответ: 1005 г.
№2. Масса уксусной кислоты, которую нужно растворить в 150 г столового 5%-го уксуса для получения 10%-го раствора равна_____г. (Запишите число с точностью до десятых.)
Ответ: 8,3%
№3. К 160 г 10%-го раствора хлорида натрия добавили 10 г этой соли и 200 г воды. Массовая доля соли в полученном растворе равна_____%. (Запишите число с точностью до целых.)
Ответ: 7%
№4. Массовая доля соляной кислоты в растворе, полученном при растворении 11,2 л хлороводорода в 1 л воды, равна_____%. (Запишите число с точностью до десятых.)
Ответ: 1,79%
Если данная статья понравилась и оказалась полезной, то ставьте лайк и подписывайтесь на канал!
Массовая доля химического элемента в соединении
Урок посвящен изучению понятия «массовая доля химического элемента в веществе». Вы научитесь рассчитывать массовую долю элемента в веществе.
I. Понятие “массовая доля химического элемента”
Представьте, что вам предстоит поровну разделить еще с четырьмя друзьями яблочный пирог. Вес пирога – 500г. Кусок какой массы достанется каждому? Масса каждого куска будет равна 100 г. Долю одного куска от всего пирога можно вычислить, разделив массу куска на массу всего пирога, т.е. 100/500 = 1/5 или 20%.
Массовая доля части от целого – отношение массы части к массе целого. Массовая доля обозначается буквой греческого алфавита («омега») – ω. Измеряется массовая доля в долях или %. Она принимает значения от 0 до 1 или 0 до 100%.
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
Понятие «массовая доля» применимо и в химии: можно вычислять массовую долю химического элемента в веществе.
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w(элемента) = 20% или 0,2.
II. Алгоритм решения задач
Задача: вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
|
Дано: Фосфорная кислота H3PO4 |
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты Ar(H)=1 2. Вычисляем относительную молекулярную массу соединения Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100% Подставляем значения, 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
|
Найти: w%(H) w%(P) w%(O) |
Ответ: w(H) = 3,06% w(P) = 31,63% w(O) = 65,31% |
III. Работа с тренажерами
Тренажёр 1
Тренажёр 2
Тема2.
Урок№7. Массовая доля химического элемента в веществе.
Цели:
Подвести учащихся к осознанному поиску ответа на вопрос что
такое “массовая доля элемента”?;
Задачи:
Учебная – научить определять массовую долю элемента в сложном
веществе; составлять формулы сложных веществ по массовой доле элемента;
Воспитательная – воспитывать социально активную личность через
решение проблемной ситуации на уроке.
Развивать
учебные умения и навыки самостоятельной работы. ЦЕЛЬ УРОКА: Научить вычислять массовую долю элементовв
соединении по формуле соединения и устанавливать химическую формулу
сложного вещества по известным массовымдолям химических элементов.
Основные понятия. Массовая
доля химического элемента.
Планируемые результаты обучения
Предметные. Уметь
рассчитывать массовую долю элементав соединении по его формуле и устанавливать
химическуюформулу сложного вещества по известным массовым долям химических
элементов.
Метапредметные.
Формировать умения устанавливатьаналогии, использовать алгоритмы для решения
учебных и познавательных задач.
Основные виды деятельности учащихся. Рассчитывать
массовую долю элемента в соединении по его формуле. Устанавливать химическую
формулу сложного вещества по известным массовым долям химических элементов.
Методы:
проблемный диалог, индивидуальная работа с дидактическим материалом.
Оборудование:
дидактические материалы.
Ход
урока
I.
Организация учащихся.
Привожу
слова, а школьники высказывают свое мнение, как они их понимают.
1. Не позволяй душе
лениться, Чтоб в ступе воду не толочь, Душа обязана трудиться. И день и
ночь. И день и ночь!
(М.Заболоцкий)
2.«Умение
решать задачи – это искусство, что приобретается практикой»
Д. Пойа
II. Актуализация знаний и постановка
проблемы.
1.Беседа
–
Дайте определение понятия « относительная молекулярная масса». Как ее
вычисляют?
–
Дайте определение понятия «массовая доля элемента в веществе». Как ее
вычисляют?
–
Запишите формулы для вычисления массовой доли элемента и массы элемента.
–
Какие величины необходимо знать для вычисления массовой доли элемента по
химической формуле ?
– Как
найти относительную атомную массу?
– По
каким данным записывают химические формулы?
-. Что такое вещество?
-. Что такое сложное вещество?
-. Что такое простое вещество?
-. Как можно на бумаге отобразить состав вещества?
-. Что такое химическая формула?
-. Что такое индекс?
-. Что такое коэффициент?
2.Мотивация
Составляющие нашей планеты органический и неорганический
мир, образованный органическими и неорганическими веществами. Посмотрите на
глобус. ¾ поверхности нашей планеты занимает вещество, без которого не было бы
жизни на нашей земле. Что это за вещество? (вода)
Вы уже знаете, что любое вещество можно записать с помощью
химической формулы. Вспомним формулу воды? Что вы можете определить по этой
формуле?
(качественный и количественный состав, простое или сложное
вещество, определить, что это за вещество, найти Мr).
Ребята, какие элементы входят в состав молекулы воды? А
сколько атомов каждого элемента содержится в молекуле воды? А если изменить
количество атомов кислорода или водорода в молекуле воды будет ли изменённая
формула принадлежать веществу вода (ответы учащихся)?
И так, атомы химических элементов находятся в молекуле в
определённых массовых отношениях, т.е. составляют определённую часть от общей
молекулы. А как можно вычислить – какую часть от молекулы составляет химический
элемент (предложения учащихся)?
– Какова будет тема урока?
Варианты тем, которые могут предложить учащиеся:
1. Определение содержания химического элемента в веществе.
2. Массовая доля элемента в сложном веществе связана с составом вещества
III. Изучение нового материала.
1.Вопросы, которые мы выясним на уроке.:
. Как можно определить содержание элемента в веществе?
. Что такое массовая доля элемента?
. Как рассчитывается массовая доля элемента? (записывается
формула)
2. Массовая доля части от целого
а) нахождение части от целого, решение
задачи
Представьте, что вам предстоит поровну разделить еще с четырьмя
друзьями яблочный пирог. Вес пирога – 500г. Кусок какой массы достанется
каждому? Масса каждого куска будет равна 100 г. Долю одного куска от всего
пирога можно вычислить, разделив массу куска на массу всего пирога, т.е.
100/500 = 1/5 или 20% (Рис. 1).
Рис. 1. Массовая доля куска от всего пирога
б) решение задачи по карточкам
я принесла вам пирог весом 900
граммов.
Одному я дала кусочек весом – 50
г( тому, кто сладкое не очень любит), второму – 100г,
третьему – 150,
четвертому – 200г,
а оставшимся двоим – 400г.
Рассчитай, какая часть достанется каждому? ( раздаю
карточки с кусочками разных цветов – 5 кусочков).
1-ый – 50г : 900г = 0,056 или 5,6%
2 –ой – 100г : 900г = 0,111 или
11,1%
3 –ий – 150г. : 900г = 0,167 или
16,7%
4 -ый – 200г. : 900г = 0,222 или
22,2%
5 и 6 – ой – 400г : 900г = 0,444
или 44,4% ( по 0,222 или по 22,2%)
Проверка: 0,055 + 0,111 + 0,167 +
0,222 + 0,444 = 1 или 100%
в) Вывод:
Массовая доля части от целого – отношение массы части к массе целого.
Массовая доля обозначается буквой греческого алфавита («омега») – ω. Измеряется
массовая доля в долях или %. Она принимает значения от 0 до 1 или 0 до 100%.
Понятие «массовая доля» применимо и в химии. Используя знание о
законе сохранения массы веществ, участвующих в реакции, можно вычислять
массовую долю химического элемента в веществе.
3. Массовая доля
элемента в веществе
Массовая доля химического элемента в веществе – это отношение
массы атомов данного элемента, входящих в состав вещества, к массе всего
вещества. Массовая доля не зависит от массы вещества!
Зная химическую формулу, можно вычислить массовую долю
химических элементов в веществе. Массовая доля элемента в
вещества обозначается греч. буквой «омега» – ωЭ/В и рассчитывается
по формуле:
ω=(Аr·n/Мr)·100%
4. Расчеты,
связанные с понятием «массовая доля элемента в веществе»
ПРИМЕР 1. Магний массой 4,8 г вступает в реакцию
соединения с кислородом. При этом образуется 8 г оксида магния (Таблица 1).
Чему равна масса вступившего в реакцию кислорода?
Таблица 1.
Воспользуемся законом сохранения массы веществ. Масса вступившего в
реакцию кислорода равна разности масс оксида магния и магния, т.е. равна 3,2 г.
Впишем это значение в таблицу 2.
Таблица 2.
Вычислим массовые доли магния и кислорода в продукте реакции –
оксиде магния. В соответствии с АМТ, атомы в ходе химической реакции не делятся
и не изменяются. Значит, все атомы магния, которые вступили в реакцию, вошли в
состав оксида магния. То же произошло и с атомами кислорода.
Чтобы найти массовую долю магния (части) в оксиде магния (целом),
надо массу магния (части) разделить на массу оксида магния (целого). Итак:
ω(Mg/оксид магния) = 4,8 г/8 г = 0,6 или 60%
Массовую долю кислорода можно найти аналогично, или вычесть из 100%
массовую долю магния (Таблица 3).
ω(О/оксид магния) = 100% – 60% = 40%
Таблица 3.
Проверим, изменятся ли массовые доли элементов в оксиде магния,
если в реакцию вступит 24 г магния, а получится 40 г оксида мания. По закону
сохранения массы веществ масса кислорода, вступившего в реакцию будет равна16
г. Массовая доля магния – 24г/40г=0,6 или 60%, а массовая доля кислорода тогда
равна 40% (Таблица 4).
Таблица 4.
5.работа с учебником стр.
44 – 45
IV.
Закрепление
Задача 1
Какова массовая доля водорода и кислорода в воде (Н2О)?
Решение:
1) Вычисляем относительную молекулярную
массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О)
= 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в
состав воды входят атомы только двух химических элементов, массовая
доля кислорода будет равна:
V. Домашнее задание § 10