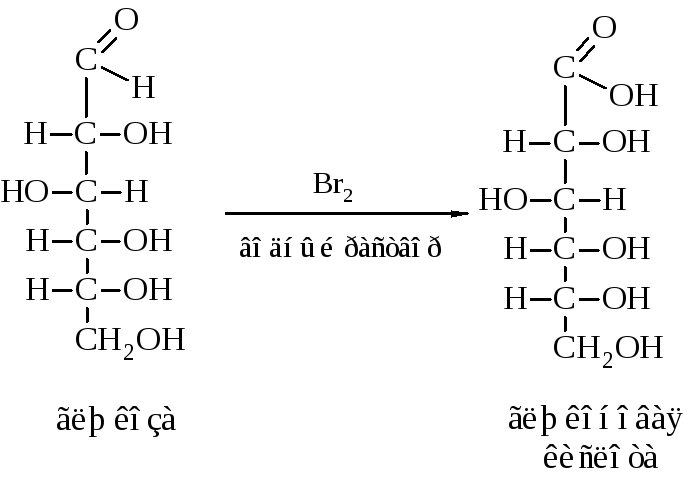
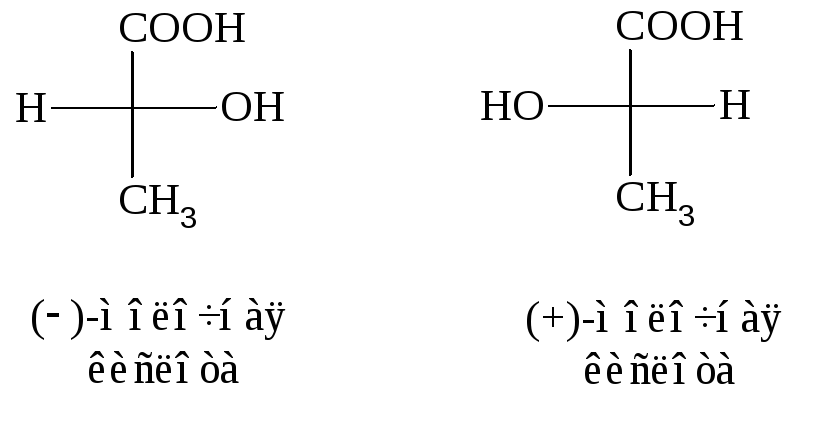Химикам уже давно известно явление изомерии — когда два вещества имеют одну и ту же брутто-формулу (отражающую только количество разных атомов в веществе), но разные свойства — из-за разного порядка соединения атомов.
Особенно богата изомерами органическая химия. К примеру, этиловый спирт и диметиловый эфир имеют одну и ту же брутто-формулу: C2H6O, но структурная формула спирта — CH3–CH2–OH, а эфира — CH3–O–CH3. Эти вещества имеют разные свойства — как химические, так и физические (температура плавления, вязкость и т. д.).
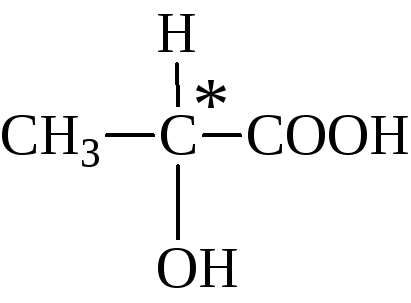
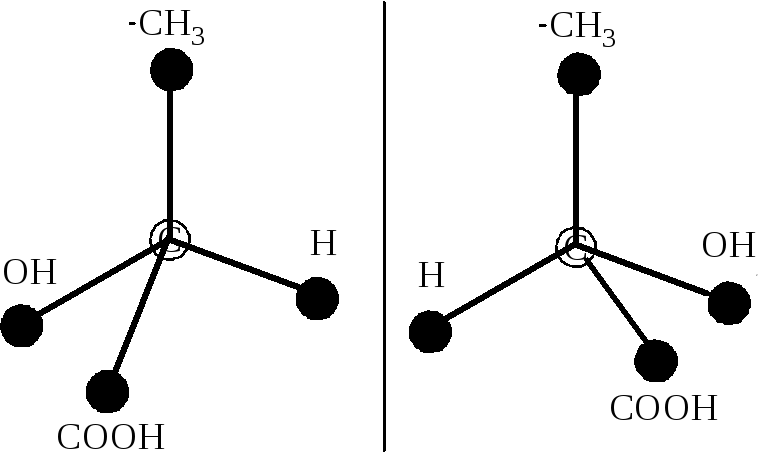
В органической химии известны и так называемые оптические изомеры — молекулы, имеющие одинаковую структурную формулу, но не совместимые со своим зеркальным отражением. Простейший пример такой молекулы — это атом углерода с четырьмя разными заместителями. К примеру, СHClBrF или аланин CH3CHNH2COOH (рис. 1). Наличие у такой молекулы двух разных конфигураций связано с тем, что у атома углерода, образующего четыре одинарные связи, эти связи направлены к вершинам тетраэдра.
Оптические изомеры имеют одинаковый цвет, температуру кипения, плотность. Однако такие вещества обладают интересным физическим свойством — они вращают плоскость поляризации пропущенного через них поляризованного света. Один изомер будет вращать ее влево, другой — вправо.
Атом углерода с четырьмя разными заместителями называется хиральным атомом (от греческого heiros «ладонь» — тот же корень, что и в слове «хиромантия»). Чем больше хиральных атомов в молекуле, тем больше у вещества может быть оптических изомеров.
Интересно, что возможны органические вещества, которые имеют оптические изомеры, хотя в них формально нет ни одного хирального атома — центра изомерии.
Задача
Приведите пример органического вещества, не имеющего хиральных атомов, но при этом имеющего оптические изомеры, с минимальным количеством атомов углерода.
Подсказка 1
Для того чтобы молекула некоторого вещества не совпадала со своим зеркальным отражением, совершенно не обязательно, чтобы у нее был хотя бы один хиральный атом. К примеру, любая молекула в форме спирали будет оптически активной.
Подсказка 2
Кроме того, вспомните, к вершинам какой геометрической фигуры направлены четыре связи в хиральном атоме углерода.
Решение
Начнем с того, что для несовместимости со своим зеркальным отражением молекуле недостаточно быть просто несимметричной. Молекула может быть не равна своему отражению «на бумаге», но совместима с ним. Скажем, молекулу HCl мы можем просто повернуть (или посмотреть на нее с другой стороны). Мы можем также вращать части молекулы вокруг одинарных связей — а вот с двойными и тройными связями так поступать нельзя, они при этом рвутся.
Итак, если структура молекулы имеет такую пространственную асимметрию, что она не совмещается со своим зеркальным отражением, то молекула и ее отражение называются оптическими изомерами. Наша цель — попробовать придумать структуру, которая бы была несовместима со своим зеркальным отражением, имела бы минимальное количество атомов углерода, и при этом сами эти атомы не были бы хиральными центрами молекулы.
На первый взгляд, такой молекулой могли бы быть замещенные этилены, где вместо атомов водорода — четыре разных заместителя:
Однако несмотря на то, что у такого вещества есть изомеры (два произвольно выбранных заместителя у разных атомов углерода могут располагаться по одну сторону двойной связи или по разные), хиральными они не будут, так как молекулы с одной двойной связью — плоские; чтобы совместить их со своим зеркальным отражением, их достаточно просто повернуть на 180° вокруг оси, лежащей в плоскости молекулы и перпендикулярной двойной связи.
Существует вариант с тремя атомами углерода, который формально уже можно назвать решением нашей задачи. Четырехзамещенные аллены RR’C=C=CR”R”’ тоже содержат двойные связи, но их молекулы уже не плоские. Дело в том, что если у одного атома углерода есть две двойные связи, то их плоскости повернуты друг относительно друга на 90 градусов:
Эта молекула уже хиральна, и можно сказать, что задачу мы решили. Однако в ней есть «хиральный центр» — центральный атом углерода. Попробуем решить задачу другим способом.
Три атома углерода можно расположить по-другому — создав из них треугольник. У нас получится вещество циклопропан, С3H6:
Это хорошо известное вещество, которое до сих пор иногда используется в медицине в качестве средства для наркоза. Атомы углерода образуют жесткую плоскость. Каждый из них связан с двумя атомами водорода — один над плоскостью, другой — под ней.
Теперь заменим у двух атомов углерода по одному атому водорода на два других заместителя — к примеру, хлор и бром — так, чтобы они оказались по разные стороны от плоскости атомов углерода. Такое положение заместителей называется транс-изомером 1,2-дизамещенного циклопропана. (Если бы эти заместители располагались по одну сторону от плоскости, у нас получился бы цис-изомер, но он нас сейчас не интересует).
Внимательно посмотрим на получившуюся молекулу и представим себе ее зеркальное отражение:
Обе структуры, как бы мы ни крутили их в пространстве, друг с другом не совмещаются, а атома — хирального центра тут нет.
А теперь попробуем создать полный аналог хирального атома углерода — но без хирального центра. Вернемся к первоначальному атому, с которого мы начали (см. условие задачи). Четыре связи его направлены к вершинам тетраэдра. Давайте попробуем расположить по атому углерода в его вершинах и соединить их связями.
У нас получится углеродный скелет вещества C4H4 — тетраэдрана. Само это вещество еще не получено химиками, но его производные уже существуют в реальности. Если заместить в нём все атомы водорода на разные заместители, то получится вполне себе хиральная молекула, «хиральный центр» которой будет располагаться внутри тетраэдра:
Послесловие
Тема изомерии — одна из самых благодатных тем для игры ума. Даже в школьных олимпиадах по химии очень часто можно встретить задания с просьбой написать все изомеры того или иного вещества (иногда сами составители задач чего-то не рассчитывают, и на решение уходит много времени и очень много бумаги; у автора этой задачи на районной олимпиаде как-то ушло полтора часа и целая тетрадка).
Оптические изомеры — всего один из вариантов изомерии в органической химии, но очень важный.
К примеру, все основные аминокислоты, которые входят в состав наших белков, имеют формулу H2N–CH(R)–COOH — то есть все (кроме глицина, у которого R тоже представляет собой атом водорода) имеют асимметрический атом углерода и имеют оптические изомеры. И в нашем организме встречаются почти исключительно L-изомеры аминокислот (если не вдаваться в тонкости номенклатуры хиральных атомов, которых существует целых три типа, то можно назвать эти молекулы «левыми»). И биохимики до сих пор гадают, почему природа выбрала именно этот изомер — ведь при всех реакциях, когда из более простых веществ получаются вещества с хиральным атомом (без присутствия специфических катализаторов) образуется смесь двух изомеров в равных частях.
Синтетики тоже любят «поиграть» с оптической изомерией и при этом уже создали множество веществ без хирального атома — но с оптической активностью.
Кстати, можно создать хиральную молекулу вообще без заместителей. И она будет достаточно небольшой. Существуют так называемые ароматические углеводороды. Самый простой из них — бензол, C6H6. Его структуру учат в школе — плоский шестигранник. Вещество посложнее — нафталин. Это уже два соединенных по одной стороне бензольных кольца:
Три кольца можно уже соединять в линию — получится антрацен, а можно — под углом, и тогда у нас получится фенантрен:
Так вот, если продолжать соединять кольца под углом и дойти до шести колец, то крайние кольца упрутся друг в друга, им не хватит места, и плоскость молекулы нарушится. Вещество из шести колец называется гексагелицен, и его молекула уже представляет собой спираль. А значит, эта молекула может быть либо левой спиралью, либо правой, и будет иметь оптические изомеры.
Кстати, химики научились получать такие спирали даже из 12 бензольных колец, в них уже есть пара витков.
Более того, и оптическими изомерами весь ассортимент разнообразия химических веществ, как ни странно, не заканчивается.
Стоит сказать о возможности так называемой топологической изомерии. Что это такое? К примеру, существует вещество в форме кольца. Две молекулы этого вещества изомерны одной, в которой одно кольцо продето в другое. И такие молекулы уже есть. Класс веществ, в которых две или более частей молекул удерживаются механически, как звенья цепи, называются катенанами — от латинского catena «цепь» (см. Catenane). Биохимики научились получать катенаны из молекул ДНК, и более короткие структуры тоже складывали в цепочки.
А если представить себе катенан из четырех колец, то возможна изомерия между молекулой, в которой три кольца продеты в четвертое, и молекулой, в которых кольца соединены последовательно.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
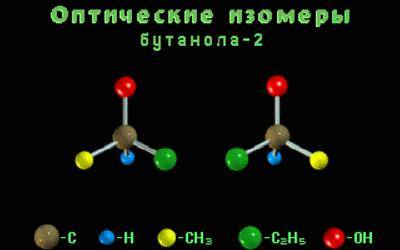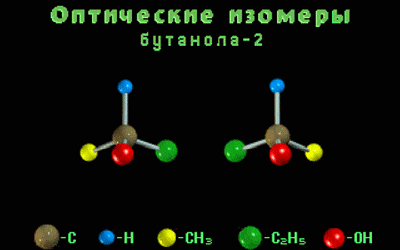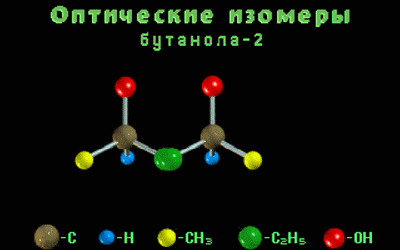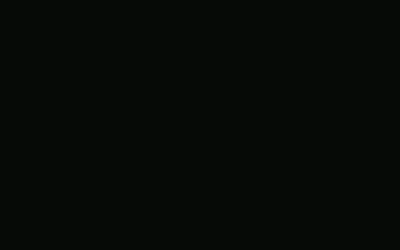
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
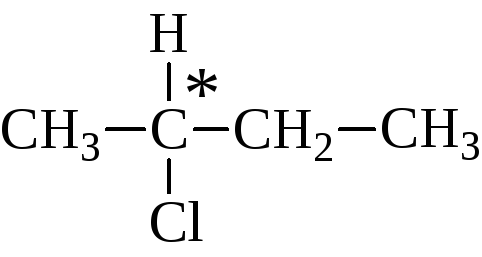
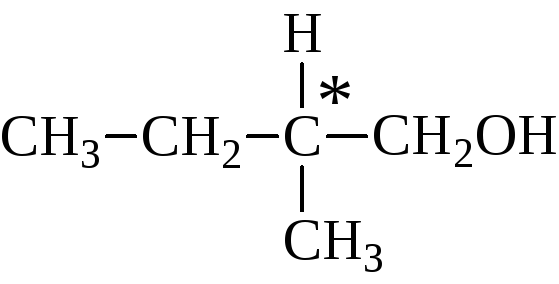
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Ранее были описаны
структурная изомерия, обусловленная
различным порядком чередования атомов
и связей в молекулах, и два вида
пространственной изомерии: поворотной
и геометрической
(цис-транс),
связанные с различным расположением
фрагментов молекул одинаковой структуры
в пространстве. Существует ещё один
вид стереоизомерии – оптическая
изомерия.
Оптические
изомеры одинаковы по всем своим физическим
и химическим свойствам и различаются
лишь в двух отношениях.
1 При кристаллизации
они образуют кристаллы, не имеющие
плоскости симметрии и относящиеся друг
к другу как предмет к своему зеркальному
отображению. Это свойство позволило
Пастеру открыть явление оптической
изомерии. При кристаллизации винной
кислоты он визуально обнаружил кристаллы
двух различных типов и разделив их,
выделил чистые стереоизомерные формы
винной кислоты.
2 Оптические изомеры
по разному относятся к поляризованному
свету.
В луче света
колебания электрического и магнитного
векторов происходят во взаимно-перпендикулярных
направлениях, а также перпендикулярно
направлению распространению луча.
Причём направление колебаний, например,
электрического вектора хаотически
меняется во времени, изменяя соответственно
направление колебания вектора магнитного.
В поляризованном
луче колебания
электрического и магнитного векторов
совершаются для каждого в
одной строго
фиксированной плоскости, плоскости
поляризации.
При прохождении поляризованного луча
через некоторые прозрачные жидкие и
кристаллические вещества плоскость
поляризации поворачивается. Соединения,
вращающие плоскость поляризации
поляризованного луча, называются
оптически деятельными или оптически
активными.
Для количественного сравнения оптической
деятельности различных веществ, вычисляют
величину удельного
вращения.
Поскольку величина угла, вращения
плоскости поляризации света помимо
природы вещества зависит еще от
температуры, длины волны света, толщины
слоя вещества, через который проходит
поляризованный свет, а для растворов
ещё от растворителя и концентрации
вещества, удельное вращение при постоянной
температуре и длине волны света равно
,
где α – угол
поворота плоскости поляризации при
толщине слоя l
и плотности вещества d,
t
– температура, D
– фиксированная длина волны желтой
линии из спектра натрия.
Для раствора
,
где С
– концентрация раствора в граммах
вещества, на 100 мл раствора.
Молочная кислота,
получаемая при ферментации сахарозы
с помощью бактерий, вращает
плоскость поляризации света влево
(против часовой стрелки). Она называется
левовращающей или левой молочной
кислотой и обозначается: (–) – молочная
кислота.
Молочная кислота,
вращающая плоскость поляризации света
вправо,
называется правой молочной кислотой и
обозначается: (+) – молочная кислота.
Эта оптическая форма молочной кислоты
выделяется из
мышц животных
и называется мясомолочной кислотой.
В кристаллической
фазе
оптическая активность вещества связана
с асимметрией
строения кристалла.
В жидкой
и газовой фазах она
связана с
асимметрией молекул.
В 1874 г. Вант-Гофф и Лебель – основоположники
стереохимической теории – почти
одновременно отметили, что оптически
активные вещества содержат в своих
молекулах хотя бы один углерод, связанный
с четырьмя
различными
группами.
Такие атомы углерода называются
асимметрическими.
Наличие в структуре молекулы
асимметрического атома углерода является
признаком асимметрии молекул соединения,
а следовательно, и оптической активности
вещества.
При рассмотрении
оптической изомерии асимметрические
атомы углерода обычно отмечают звездочкой
(*):
-
молочная
кислота3-метилгексан
2-хлорбутан
2-метилбутанол-1
и др.
Как видно из
структурных формул, соединения, содержащие
асимметрический атом углерода, не имеют
плоскости симметрии.
Оптические изомеры
молочной кислоты, т.е. (–) и (+)-формы этой
кислоты, имеют различное пространственное
расположение отдельных групп в молекуле
и являются зеркальными отображениями
друг друга. Отражение
в зеркале всякого предмета,
не имеющего плоскости симметрии, не
тождественно предмету,
а представляет собой его антипод
(энантиомер).
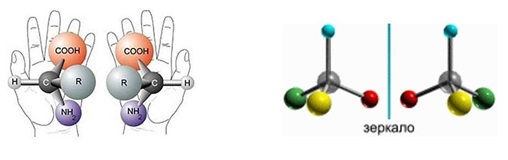
Например, отражение
человеческой фигуры в зеркале не
тождественно оригиналу. Левая сторона
человека представляется в зеркале как
правая и наоборот. Из рисунка видно, что
правая модель при наложении в пространстве
не совмещается с левой. Это свойство
объекта быть несовместимым со своим
отображением в плоском зеркале обычно
называют хиральностью.
Оптические
изомеры, являющиеся зеркальным отражением
друг друга называются
антиподами
(энантиомерами).
Они
вращают плоскость поляризации в
разные стороны на одинаковые углы.
Молочная и
мясомолочная кислоты являются антиподами
(энантиомерами). Эти стереоизомеры
вращают плоскость поляризации в разные
стороны на одинаковые углы.
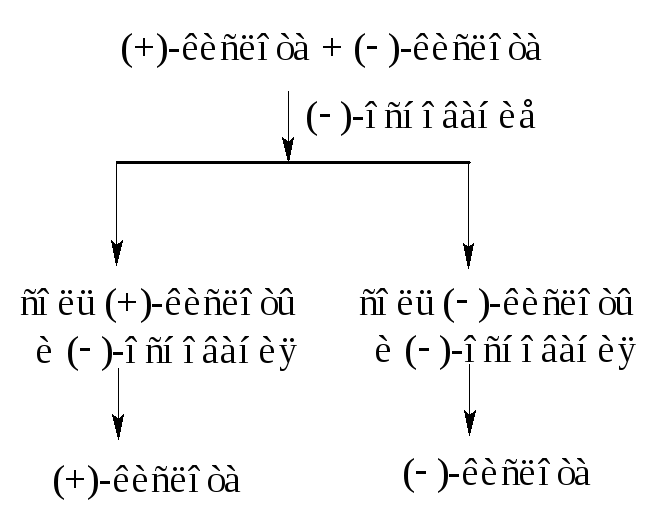
Смесь
равных количеств антиподов является
оптически недеятельной из-за компенсации
вращения и называется
рацематом.
Так, молочная
кислота, полученная синтетически, не
влияет на поляризованный свет. Она
состоит из смеси равных количеств левой
и правой форм, является оптически
недеятельной и обозначается (±)
– молочная кислота.
Для удобства
изображения пространственного строения
оптически деятельных соединений введены
так называемые проекционные
формулы, предложенные Фишером,
получаемые проецированием тетраэдрических
моделей молекул на плоскость чертежа
При пользовании
ими следует помнить, что перемещение
проекционных формул, наложение их друг
на друга разрешается только в плоскости
чертежа.
Подразумевается также, что группы сверху
и снизу находятся за плоскостью чертежа,
боковые – перед ней. Проекционные
формулы правой и левой молочных кислот
при соблюдении этих правил естественно
не совмещаются.
Очень важным
моментом оптической изомерии является
то, что величина и направление вращения
плоскости поляризации света не находятся
в прямой очевидной зависимости от
конфигурации (пространственного
строения)
соединения.
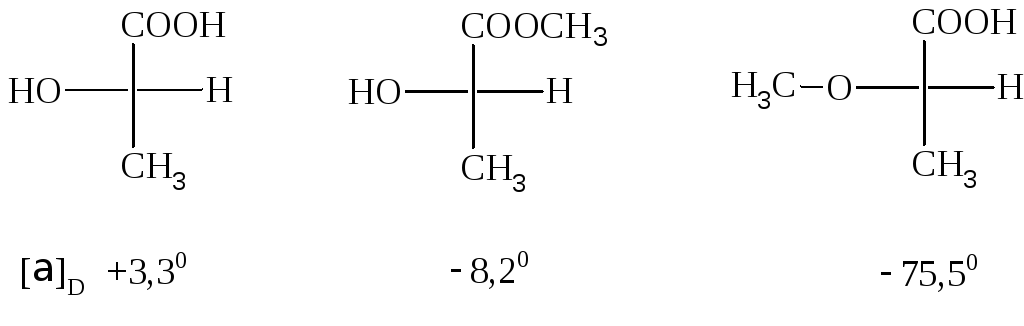
Например, сложные
и простые эфиры, правой молочной кислоты,
имея такую же конфигурацию, как и сама
кислота, обладают левым вращением.
Отсюда следует,
что знак
вращения одного из членов ряда сходных
по химическому строению веществ не
может ещё служить характеристикой
конфигурации и знака вращения остальных
его членов.
Возникает вопрос,
известны ли конфигурации оптических
изомеров для различных веществ и как
они определяются. Химические
методы не позволяют установить абсолютную
(истинную) конфигурацию антиподов из-за
тождественности химических свойств
антиподов.
В то же время этими методами можно
определить относительную конфигурацию
оптических изомеров. Оптически активные
соединения химическим путём можно
превращать друг в друга без нарушения
конфигурации. Тогда, если известна
конфигурация исходного «эталонного»
соединения, получаемое из него соединение
будет иметь ту же конфигурацию.
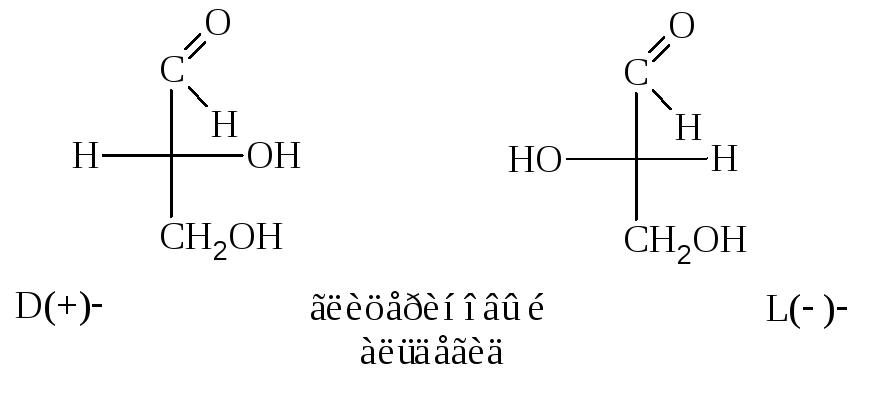
В 1891 г. Фишер, а в
1906 г. Розанов предложили использовать
в качестве такого относительного
стандарта правый (+)–глицериновый
альдегид.
Ему произвольно приписали конфигурацию
«D».
Его антиподу, (–)-глицериновому
альдегиду,
соответственно дана конфигурация «L».
При этом появилась
возможность устанавливать относительную
конфигурацию
оптических стереоизомеров химическим
путём. В этом случае производным
D(+)-глицеринового
альдегида приписывается
D-относительная
конфигурация.
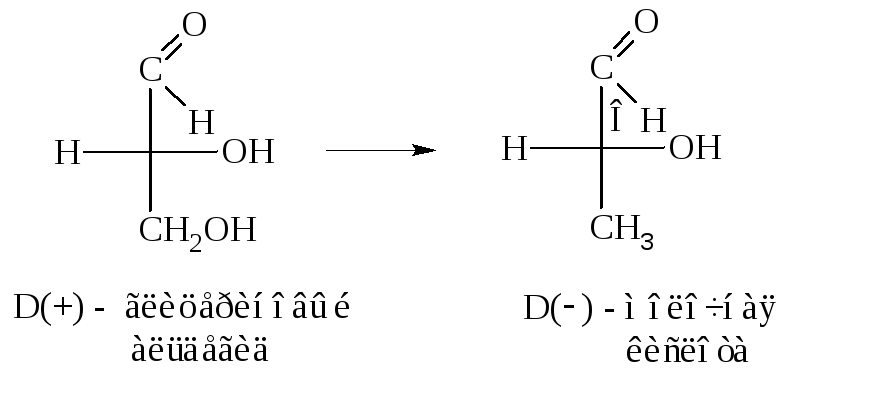
Например,
относительная конфигурация молочной
кислоты была установлена превращением
глицеринового альдегида в молочную
кислоту.
Оказалось, что
D(+)-глицериновому
альдегиду по конфигурации соответствует
левая D(–)-молочная
кислота.
Лишь в 1951 году
рентгеноскопическим анализом была
установлена абсолютная конфигурация
D-глицеринового
альдегида. Оказалось, что выбор его
конфигурации был правилен. Таким образом,
абсолютные конфигурации многих веществ
в настоящее время стали известны.
Кроме описанной
DL-номенклатуры
для обозначения конфигурации оптических
стереоизомеров используется так
называемая RS-номенклатура
Кана, Ингольда, Прелога,
не связанная с конфигурацией опорного
соединения («стандарта»). Она описана
в учебной литературе.
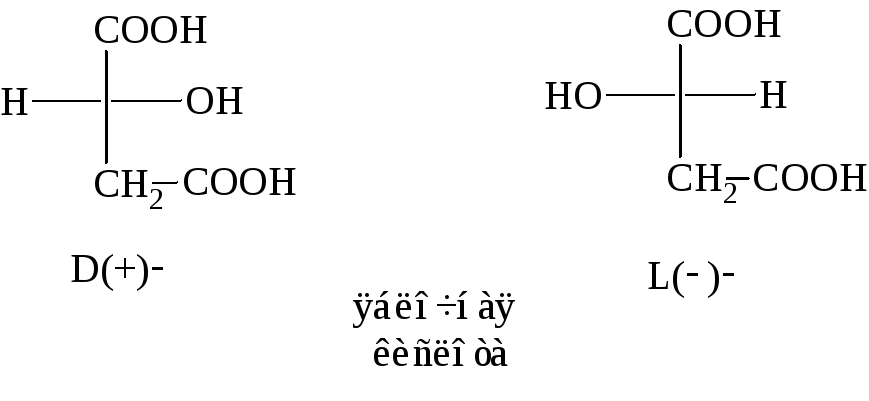
Молочная кислота,
СН3–СНОН–СООН
Молочную кислоту
получают из нитрила молочной кислоты
или молочнокислым брожением сахаристых
веществ.
Используют её в
кожевенном производстве и при крашении
тканей.
Яблочная кислота
Это двухосновная,
трёхатомная кислота. В химическом
отношении она обнаруживает свойства
α- и β-гидроксикислот, так как гидроксил
по отношению к одной кислотной группе
находится в α-положении, а по отношению
к другой – в β-положении. При восстановлении
она даёт янтарную кислоту, при дегидратации
– малеиновую или фумаровую:
HOOC –
CH – CH – COOH →
HOOC – CH = CH – COOH + H2O
׀
׀
H
OH
В яблочной кислоте
имеется один асимметрический атом
углерода, она оптически активна.
Левая и правая
яблочные кислоты плавятся при 100 °С.
Рацемат – при 130–131 °С.
В природе встречается левая форма
яблочной кислоты: в рябине, яблоках,
винограде.
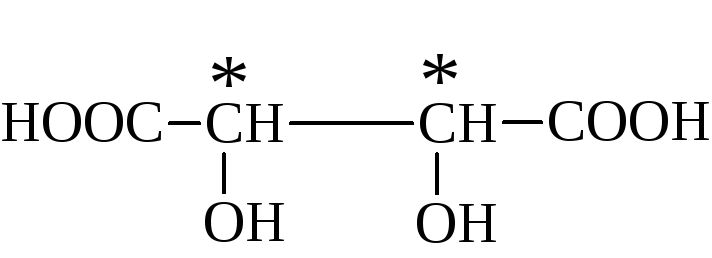
Винные кислоты
(дигидроксиянтарные)
Они имеют одинаковую
структурную формулу
и различаются
пространственным строением.
Как следует из
формулы, винная кислота имеет два
асимметрических атома углерода. Число
оптических изомеров для соединений,
имеющих в структуре молекулы несколько
асимметрических атомов углерода,
находится по формуле N=2n
, где n
– число асимметрических атомов углерода.
Следовательно,
для винной кислоты следует ожидать
существования четырёх оптических
стереоизомеров:
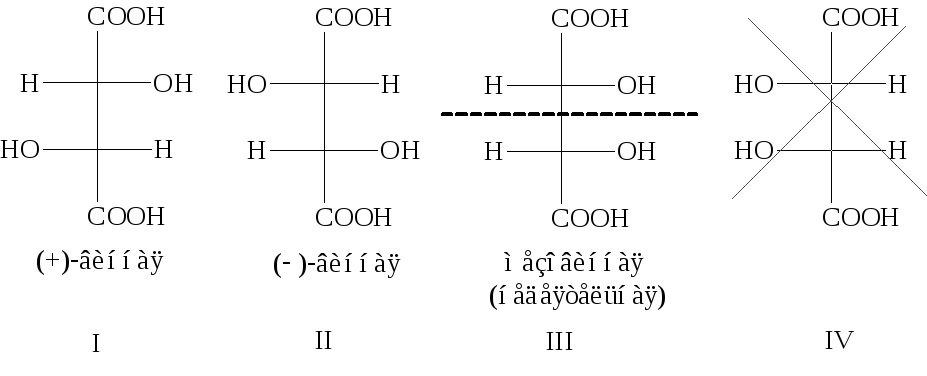
В соответствии с
правилами обращения с проекционными
формулами, при наложении последних двух
форм друг на друга они оказываются
идентичными (одну из форм следует
повернуть в плоскости чертежа на 180°).
Таким образом, вместо четырех
стереоизомерных форм винная кислота
реализуется в трех. Кроме того, третий
стереоизомер (III)
оказывается оптически недеятельным
из-за своей симметрии (на рисунке показана
плоскость симметрии): вращение плоскости
поляризации света, вызываемое верхним
тетраэдром, полностью компенсируется
равным по величине, но противоположным
по знаку вращением нижнего. Перед нами
пример стереоизомерной
формы с асимметрическими углеродными
атомами оптически недеятельной вследствие
ее симметрии. Такие стереоизомеры
называют мезоформами.
Стереоизомеры
вещества, не являющиеся зеркальным
отображением друг друга, называются
диастереоизомерами.
В соответствии с этим определением,
первая и вторая пространственные формы
винной кислоты являются диастереомерами
по отношению к мезовинной кислоте (и
наоборот).
Поскольку антиподы
имеют одинаковое (только зеркально
обратное) строение, их свойства за
исключением отношения к поляризованному
свету тоже одинаковы. Диастереомеры
не одинаковы по своему пространственному
строению, поэтому их свойства несколько
различаются.
Заключая анализ
пространственной изомерии винной
кислоты, можно сказать, что она представлена
двумя антиподами (формы I
и II),
их
рацематом, называемым виноградной
кислотой, и диастереоизомерной мезоформой
(III).
Правовращающая,
(+)-винная кислота весьма распространена
в природе, особенно её много в соке
винограда. При брожении виноградного
сока она выделяется в виде винного
камня, состоящего из кислого виннокислого
калия.
Эта соль применяется
в качестве протравы при крашении и
печатании тканей.
Другая, калий-натриевая
соль (+)-винной кислоты – так называемая
сегнетова соль,
используется в
качестве пьезокристалла в радиотехнике.
Она входит в состав фелинговой жидкости,
которая употребляется для аналитического
определения восстановителей (например,
альдегидов).
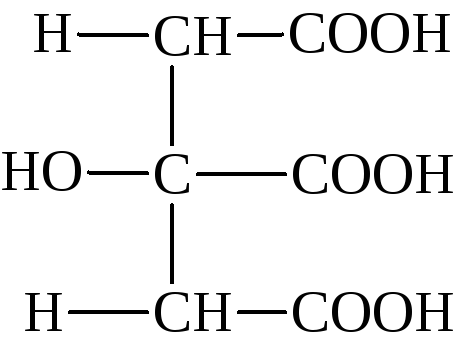
Мезовинная кислота
получается вместе с виноградной при
кипячении в течении нескольких часов
(+)-винной кислоты с избытком едкого
натра.
Лимонная кислота
Она довольно часто
встречается в природе: в свекле,
крыжовнике, винограде, лимонах, малине,
листьях табака. Оптически недеятельна.
Лимонная кислота
используется в пищевой промышленности,
при крашении, в фотографии, для
консервирования крови и т.д.
Альдоновые
кислоты
Альдоновые
кислоты
– это полигидроксикарбоновые кислоты
общей формулы HOCH2[CH(OH)]nCOOH,
формально являющиеся продуктами
окисления альдегидной группы углеводов
(альдоз). Наиболее типичным лабораторным
методом синтеза альдоновых кислот
является окисление легкодоступных
альдоз бромом в его водном растворе.
Альдоновые кислоты
и их производные играют важную роль в
синтетической химии моносахаридов.
Методы разделения
рацематов на оптически активные
компоненты
В настоящее время
стремительно растет потребность в
энантиомерно чистых веществах для
получения современных высокоэффективных
медицинских препаратов, а также нужд
сельского хозяйства и защиты лесов:
получения новых высокоактивных
инсектицидов, гербицидов, фунгицидов
и других веществ избирательного
действия для борьбы с вредными организмами.
Получение энантиомерно чистых веществ
для этих целей возможно либо на путях
разработки методик их полного химического
синтеза (ряд достижений в этой области
отмечен присуждением Нобелевских
премий по химии), либо разделением
рацемических смесей. Рассмотрим принципы
некоторых методов разделения рацематов
на оптически активные компоненты.
– Механический
отбор. При
кристаллизации рацематы иногда
кристаллизуются отдельно в виде правой
и левой форм. Причем их кристаллы по
форме относятся друг к другу как предмет
к своему зеркальному отражению. В этом
случае их можно отобрать механически
по внешнему виду.
– Биохимическое
разделение. Оно
основано на том, что микроорганизмы в
процессе своей жизнедеятельности
способны потреблять предпочтительно
лишь один из оптических изомеров. Обычно
эта оптическая форма более распространена
в природе. Поэтому при размножении и
прорастании грибков в растворе рацемата
через некоторое время остается только
одна оптически активная форма.
– Способы,
основанные на различии свойств
диастереомеров
Так, соли антиподов
оптически деятельной кислоты с одним
и тем же оптически деятельным основанием
должны давать диастереомеры различной
растворимости. Это позволяет разделить
их кристаллизацией.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
15.03.2016169.47 Кб81.doc
- #
- #
15.03.2016911.87 Кб3112.doc
- #
- #
- #
- #
- #
- #
- #
Оптическая изомерия — это явление возникновения изомерных молекул с асимметричным атомом, которые отличаются по оптической активности. Они обладают другой способностью искривлять плоскость поляризации мира. Некоторые поворачивают эту плоскость вправо, другие — влево.
Первая половина 19 века была временем поиска ответов на вопрос «Что такое поляризованный свет и оптическая активность?». А знаете ли вы ответ на этот вопрос? Если нет, то эта статья вам может помочь в этом.
Поляризация света
Свет — это пучок волн, распространяющихся в разных направлениях. Плоскости колебаний волн могут быть представлены графически с помощью векторов.
Можно изменить направление распространения электромагнитной волны. Если свет пропустить через соответствующее устройство, так называемый поляризатор, то большая часть колебаний будет погашена.
Поляризатор — это оптическое устройство, через которое получают поляризованный свет, т.е. свет, в котором волновые колебания происходят в одной плоскости.
Поляризатор действует как щелевая система и пропускает только те волны, которые распространяются параллельно щели. Плоскость колебаний электромагнитных волн после прохождения через поляризатор является так называемой плоскостью поляризованного света. Это единственная плоскость света, которая не гасится поляризатором.
Конструкция поляриметра
Для определения положения плоскости поляризованного света используется прибор, называемый поляриметром. Его схема может быть представлена следующим образом (см. рисунок 3):
На рисунке 3 обозначено цифрами:
- Окуляр для наблюдения за световым лучом.
- Анализатор. Вид поляризатора, позволяющий измерять угол (в градусах) поворота плоскости поляризации света.
- Поляриметрическая трубка. Ёмкость с испытательной жидкостью.
- Кварцевая пластина (так называемая пластина Лорана). Затемняет центральную часть луча и таким образом делит поле зрения на три части.
- Объектив.
- Поляризатор. Оптическое устройство, через которое свет распространяется в одном направлении.
- Источник света.
Если оси поляризатора и анализатора расположены под прямым углом 90º друг к другу и внутри поляриметрической трубки нет оптически активного вещества, или трубка пуста, то свет не попадает в глаз наблюдателя. Что это означает на практике? В окуляре видно полностью затемненное поле зрения. Наблюдатель должен видеть на шкале нулевое значение или это значение должно быть слегка отклонено от нуля. Показания на шкале определяются как α1 .
Что происходит, когда оптически активное вещество помещают в поляриметрическую трубку?
Плоскость поляризованного света может быть повернута на определенный угол (влево или вправо) только в том случае, если на ее пути находится оптически активное вещество, так называемый оптический изомер. Затем часть света проходит через анализатор и попадает в глаз наблюдателя через окуляр, а часть поля зрения остается затемненной. Чтобы полностью погасить световой луч, наблюдатель должен повернуть анализатор влево или вправо. Угол поворота анализатора обозначается как α2 .
Дадим пояснения некоторым терминам:
Оптический изомер — хиральное соединение, обладающее способностью поворачивать плоскость поляризованного света вправо или влево.
Оптическая активность вещества — свойство вещества, обусловленное тетраэдрической геометрией атома в молекуле (так называемый асимметричный атом), которое проявляется в искривлении плоскости поляризации линейно поляризованного света, проходящего через раствор этого вещества; если вещество не является оптически активным, оно не искривляет плоскость поляризованного света.
Угол поворота плоскости поляризации света, так называемое оптическое вращение образца, рассчитывается по формуле: α = α2 — α1 .
Поляризованный свет может быть искажен двумя способами:
- Вещество искривляет плоскость поляризованного света в право. О таком веществе говорят, что оно правостороннее. Направление кручения плоскости поляризованного света — по часовой стрелке и обозначается в названии соединения знаком (+).
- Вещество искривляет плоскость поляризованного света в лево. О таком веществе говорят, что оно левостороннее. Направление кручения плоскости поляризованного света — против часовой стрелки и обозначается знаком (-) в названии соединения.
Важно! Оптической активностью обладают как кристаллы (например, кварц, сахар), так и жидкости (например, никотина), а также растворы твердых тел в оптически неактивных жидкостях, например, раствор сахара в воде. Основной причиной искривления плоскости поляризации является взаимодействие световой волны и электронов молекулы.
Энантиомеры искривляют плоскость поляризованного света на один и тот же угол, но в противоположном направлении. Пример: если энантиомер A поворачивает плоскость поляризованного света на угол +7° (вправо), то энантиомер B той же концентрации поворачивает плоскость на угол -7° (влево).
Удельное вращение
Для того чтобы учесть все условия измерения, определяется так называемое удельное вращение. Он рассчитывается по формуле:
- λ — длина волны света;
- T — температура измерения [ K ];
- α — угол поворота плоскости поляризации света;
- с — концентрация раствора [ г / см3 ];
- l — длина поляриметрической трубки [ дм ].
Поэтому угол поворота плоскости поляризации света зависит от:
- концентрация образца;
- длина поляриметрической трубки.
Важно отметить, что удельное вращение определяется при определенной длине волны света, проходящего через образец, и при точно известной температуре измерения.
Список использованной литературы
- Горжински Смит Дж., Органическая химия, третье издание, Нью-Йорк 2011.
- Saunders N., Saunders A., Clinton S., Parsonage M., Poole E., AS Chemistry for AQA Student Book, Oxford 2007
- Рудзитис Г. Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
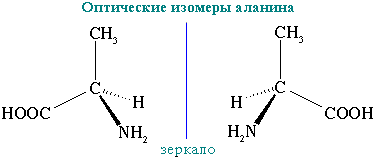
Оптические изомеры
Оптические изомеры — это стереоизомеры, представляющие собой зеркальное отражение друг друга, не совмещаемые в пространстве.
Атом углерода в оптических изомерах связан с четырьмя различными заместителями.
Молекулы оптических изомеров несовместимы в пространстве (как левая и правая рука), в них отсутствует плоскость симметрии.
Оптические изомеры аминокислоты
Их отличительным свойством является оптическая активность – способность вращать плоскость поляризации света (один из них вращает плоскость поляризованного света влево, а другой на такой же угол — вправо).
Одной структурной формуле бутанола-2 соответствует два оптических изомера.
Видеофильм «Стереоизомерия»
Изомеры
Пространственная изомерия