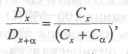Оптическая плотность – стандартный раствор
Cтраница 1
Оптические плотности стандартных растворов и раствора реагента ( холостого опыта, содержащего определенный объем добавляемого реагента) измеряют относительно растворителя. Определяют разности значений ДЛ А – А % ( где А и Лр – средние значения при разных концентрациях) и строят график или рассчитывают уравнение зависимости АЛ f ( С) ( см. разд. Этот подход наиболее применим для неустойчивых систем или реагентов и систем, содержащих примеси.
[1]
Оптические плотности стандартных растворов и раствора реагента ( холостого опыта, содержащего определенный объем добавляемого реагента) измеряют относительно растворителя. Этот подход наиболее применим для неустойчивых систем или реагентов и систем, содержащих примеси.
[3]
Оптические плотности стандартных растворов измеряют на фотоэлектроколориметре, и на основании полученных данных строят калибровочную кривую.
[4]
Оптические плотности стандартного раствора известной концентрации и исследуемого раствора измеряют, пользуясь ФЭК-56. Максимальное поглощение ионами дихромата, наблюдается при Я т 400 – 450 ммк.
[5]
Оптическую плотность стандартных растворов измеряют через 30 мин и на основании полученных результатов строят калибровочный график.
[6]
Оптическую плотность стандартных растворов измеряют через 30 мин, и на основании полученных результатов строят калибровочный график.
[7]
Оптическую плотность стандартного раствора определяют сле дующим образом.
[8]
Измеряют оптические плотности стандартных растворов с известной концентрацией. По полученным данным строят калибровочный график, откладывая на оси ординат значения оптической плотности, а на оси абсцисс – соответствующие им значения концентрации. Затем измеряют оптическую плотность исследуемых растворов и по графику находят их концентрации. Этот метод наиболее удобен для выполнения серийных определений.
[9]
Измеряют оптическую плотность стандартных растворов КМпО4 при 550 и 430 нм и оптическую плотность стандартных растворов К2Сг2О7 при 430 нм.
[10]
Измеряют оптическую плотность стандартных растворов по отношению к раствору сравнения ( в порядке возрастания концентраций) в кюветах со слоем толщиной 50 мм с синим светофильтром.
[11]
Определяют оптическую плотность стандартных растворов йода с цветным числом от 2 до 25 мг йода на электрофотоколориметре, используя синий светофильтр ( Х 450 – 480 нм) и кювету с расстоянием между рабочими гранями 20 мм. В правый пучок света помещают кювету со стандартным раствором йода, а в левый – кювету с дистиллированной водой.
[12]
Ст – оптическая плотность стандартного раствора; Уал – аликвотная часть раствора, взятая для анализа, мл; т – навеска образца, мг.
[13]
Значение величины оптической плотности стандартных растворов откладывают по оси ординат, а соответствующую этим значениям массовую концентрацию глюкозы – в мг / см3 – по оси абсцисс.
[14]
Страницы:
1
2
3
4
Метод сравнения оптических плотностей стандартного и исследуемого растворов.
Для определения
концентрации вещества берут аликвотную
часть исследуемого раствора, приготавливают
из нее окрашенный раствор для
фотометрирования и измеряют его
оптическую плотность. Затем аналогично
приготавливают 2–3 стандартных окрашенных
раствора определяемого вещества
известной концентрации и измеряют их
оптические плотности при той же толщине
слоя (в тех же кюветах).
Значение оптической
плотности исследуемого раствора равно:
Ах = ελCxlx
Значение оптической
плотности стандартного раствора равно:
Aст = ελСстlст
Разделив одно
выражение на другое получим:
Ах/Аст =
ελCxlx/(ελCстlст)
Так как lх = lст, ελ
= const, то
Сх = CстАх/Aст.
Метод сравнения
применяют при однократных определениях;
он требует обязательного соблюдения
основного закона светопоглощения.
Существует и другой
более точный способ определения
неизвестной концентрации Сх, называемый
методом ограничивающих растворов.
Приготавливают два стандартных раствора
с концентрациями C1 и С2 так, чтобы
оптическая плотность первого из них A1
была бы меньше оптической плотности Ах
исследуемого раствора, а оптическая
плотность А2 второго стандартного
раствора была бы, наоборот, больше, чем
Ах.
Неизвестную
концентрацию исследуемого вещества
рассчитывают по формуле:
Cx = C1 + (C2 – C1)(Ax –
A1)/(A2 – A1)
Задачи.
1. Используя данные,
приведенные в таблице, расчитайте
концентрации ферментов.
Фермент Оптическая
плотность Длина оптического пути, см
ελ, М–1см–1
Концентрация, моль/л
Оксигемоглобин
0,4 (405 нм) 0,5 (412 нм) 1 ε412 = 135000
Дезоксигемоглобин
0,3 (425 нм) 0,4 (430 нм) 0,5 ε430 = 119000
Карбоксигемоглобин
0,4 (410 нм) 0,5 (419 нм) 1 ε419 = 191000
Каталаза 0,2 (415 нм)
0,3 (405 нм) 0,1 ε405 = 324000
Пероксидаза хрена
0,6 (410 нм) 0,7 (403 нм) 0,5 ε403 = 109000
Примечание. В графе
“оптическая плотность” в скобках
указана длина волны, при которой
измерялась оптическая плотность.
2. Рассчитайте
концентрации ферментов с помощью метода
сравнения оптических плотностей
стандартного и исследуемого растворов.
В качестве стандартных используйте
растворы ферментов из предыдущей задачи.
3. Рассчитайте
количество фермента необходимое для
приготовления 3 мл раствора с оптической
плотностью 0,8.
4. На основании
данных, приведенных в таблице, рассчитайте
оптическую плотность раствора фермента.
5. 0,1 мл раствора
аденозина разбавили до объема 25 мл.
Оптическая плотность разбавленного
раствора при 259 нм оказалась равна 0,77.
Известно, что коэффициент молярной
экстинкции аденозина при 259 нм составляет
15400 М–1см–1. Какова концентрация исходного
раствора аденозина? Каково, пропускание
разбавленного раствора при 259 нм?
Оборудование для фотометрических измерений.
Для фотометрических
измерений используют две большие группы
приборов: фотоколориметры и спектрофотометры.
В колориметрах нужные спектральные
диапазоны выделяются при помощи
светофильтров, ограничивающих участки
спектра, в которых могут проводится
измерения. В спектрофотометрах участки
спектра выделяются при помощи призм
или дифракционных решеток, что позволяет
устанавливать любую длину волны в
заданном диапазоне.
Конкретная
последовательность операций при
измерении оптической плотности или
пропускания зависит от конструкции
спектрофотометра или колориметра.
Однако основные
принципы остаются неизменными. Сначала
устанавливают необходимую длину волны,
выбирая светофильтр на колориметре или
вращая соответствующую рукоятку на
спектрофотометре. Затем устанавливают
нуль. Для этого в световой поток помещают
кювету со стандартным раствором. Изменяя
ширину щели, добиваются того, чтобы
показания прибора соответствовали
величине, предусмотренной инструкцией.
На следующем этапе стандартный раствор
заменяют исследуемым и производят
отсчет величины оптической плотности
или пропускания.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Оптическая плотность раствора
Колориметрия
Из оптических методов анализа в практике аналитических лабораторий наиболее широко применяются колориметрические методы (от лат. color — цвет и греч. μετρεω — измеряю). Колориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор.
В колориметрическом методе используются химические реакции, сопровождающиеся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость, называемая основным законом светопоглощения (или законом Бугера—Ламберта—Бера), выражается уравнением:
I = I0 10 – ε c l
где I – интенсивность света, прошедшего через раствор; I0 – интенсивность падающего на раствор света; ε- коэффициент светопоглощения, постоянная величина для каждого окрашенного вещества, зависящая от его природы; С – молярная концентрация окрашенного вещества в растворе; l – толщина слоя светопоглощающего раствора, см.
Физический смысл этого закона можно выразить следующим образом. Растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
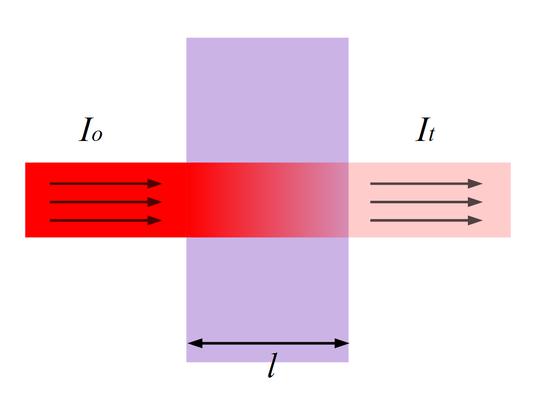
Для окрашенного раствора, заключенного в стеклянную кювету с параллельными стенками, можно сказать, что по мере увеличения концентрации и толщины слоя раствора его окраска увеличивается, а интенсивность света I, прошедшего через поглощающий раствор, уменьшается по сравнению с интенсивностью падающего света I0.
Рис.1 Прохождение света через кювету с исследуемым раствором.
Оптическая плотность раствора.
Если прологарифмировать уравнение основного закона светопоглощения и изменить знаки на обратные, то уравнение принимает вид:
Величина является очень важной характеристикой окрашенного раствора; ее называют оптической плотностью раствора и обозначают буквой A:
A = ε C l
Из этого уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Другими словами, при одинаковой толщине слоя раствора данного вещества оптическая плотность этого раствора будет тем больше, чем больше в нем содержится окрашенного вещества. Или, наоборот, при одной и той же концентрации данного окрашенного вещества оптическая плотность раствора зависит только от толщины его слоя. Отсюда может быть сделан следующий вывод: если два раствора одного и того же окрашенного вещества имеют различную концентрацию, одинаковая интенсивность окраски этих растворов будет достигнута при толщинах их слоев, обратно пропорциональных концентрациям растворов. Этот вывод очень важен, так как на нем основаны некоторые методы колориметрического анализа.
Таким образом, чтобы определить концентрацию (С) окрашенного раствора, необходимо измерить его оптическую плотность (A). Чтобы измерить оптическую плотность, следует измерить интенсивность светового потока.
Интенсивность окраски растворов можно измерять различными методами. Различают субъективные (или визуальные) методы колориметрии и объективные (или фотоколориметрические).
Визуальными называются такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом.
При объективных методах колориметрического определения для измерения интенсивности окраски испытуемого раствора вместо непосредственного наблюдения пользуются фотоэлементами. Определение в этом случае проводят в специальных приборах – фотоколориметрах, откуда и метод получил название фотоколориметрического.
Визуальные методы
К визуальным методам относятся:
1) метод стандартных серий;
2) метод дублирования (колориметрическое титрование);
3) метод уравнивания.
Метод стандартных серий. При выполнении анализа методом стандартных серий интенсивность окраски анализируемого окрашенного раствора сравнивают с окрасками серии специально приготовленных стандартных растворов (при одинаковой толщине поглощающего слоя).
Растворы в колориметрии обычно имеют интенсивную окраску, поэтому имеется возможность определять весьма небольшие концентрации или количества веществ. Однако это может сопровождаться определенными трудностями: так навески для приготовления серии стандартных растворов могут быть очень малы. Для преодоления этих трудностей готовят стандартный раствор А достаточно высокой концентрации, например 1 мг/мл. После этого путем разбавления из раствора А готовят стандартный раствор В значительно меньшей концентрации, а из него в свою очередь готовят серию стандартных растворов.
Для этого в пробирки или кюветы одинакового размера и одинакового цвета стекла пипеткой добавляются необходимые объемы растворов реагентов в нужной последовательности. Порции растворов определяемого вещества целесообразно добавлять из бюретки, т.к. их объемы будут различны для обеспечения различных концентраций в серии стандартных растворов. При этом начальный раствор должен содержать все компоненты, кроме определяемого вещества (нулевой раствор). В исследуемый раствор добавляют растворы необходимых реагентов. Все растворы доводят до постоянного объема, а затем визуально сравнивают интенсивность окраски исследуемого раствора с растворами серии стандартных растворов. Возможно совпадение интенсивности окраски с каким-либо раствором серии. Тогда считается, сто исследуемый раствор имеет такую же концентрацию или содержит столько же определяемого вещества. Если же интенсивность окраски покажется промежуточной между соседними растворами серии, концентрация или содержание определяемого компонента считают средним арифметическим между растворами серии.
Колориметрическое титрование (метод дублирования). Этот метод основан на сравнении окраски анализируемого раствора с окраской другого раствора— контрольного. Для приготовления контрольного раствора готовят раствор, содержащий все компоненты исследуемого раствора, за исключением определяемого вещества, и все употреблявшиеся при подготовке пробы реактивы, и к нему добавляют из бюретки стандартный раствор определяемого вещества. Когда этого раствора будет добавлено столько, что интенсивности окраски контрольного и анализируемого раствора уравняются, считают, что в анализируемом растворе содержится столько же определяемого вещества, сколько его было введено в контрольный раствор.
Метод уравнивания.Этот метод основан на уравнивании окрасок анализируемого раствора и раствора с известной концентрацией определяемого вещества — стандартного раствора. Существуют два варианта выполнения колориметрического определения этим методом.
По первому варианту уравнивание окрасок двух растворов с разной концентрацией окрашенного вещества проводят путем изменения толщины слоев этих растворов при одинаковой силе проходящего через растворы светового потока. При этом, несмотря на различие концентраций анализируемого и стандартного растворов, интенсивность светового потока, проходящего через оба слоя этих растворов, будет одинакова. Соотношение между толщинами слоев и концентрациями окрашенного вещества в растворах в момент уравнивания окрасок будет выражаться уравнением:
где l1 – толщина слоя раствора с концентрацией окрашенного вещества C1, а l2-толщина слоя раствора с концентрацией окрашенного вещества C2.
В момент равенства окрасок отношение толщин слоев двух сравниваемых растворов обратно пропорционально отношению их концентраций.
На основании приведенного уравнения, измерив толщину слоев двух одинаково окрашенных растворов и зная концентрацию одного из этих растворов, легко можно рассчитать неизвестную концентрацию окрашенного вещества в другом растворе.
Для измерения толщины слоя, через который проходит световой поток, можно применять стеклянные цилиндры или пробирки, а при более точных определениях специальные приборы — колориметры.
По второму варианту, для уравнивания окрасок двух растворов с различной концентрацией окрашенного вещества, через слои растворов одинаковой толщины пропускают световые потоки различной интенсивности.
В этом случае оба раствора имеют одинаковую окраску, когда отношение логарифмов интенсивностей падающих световых потоков равно отношению концентраций.
В момент достижения одинаковой окраски двух сравниваемых растворов, при равной толщине их слоев, концентрации растворов прямо пропорциональны логарифмам интенсивностей падающего на них света.
По второму варианту определение может быть выполнено только с помощью колориметра.
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.
Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10 -ε·С·ι , где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.
Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.
Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Способы расчета концентрации по величине аналитического сигнала
СПОСОБЫ РАСЧЕТА КОНЦЕНТРАЦИИ ПО ВЕЛИЧИНЕ АНАЛИТИЧЕСКОГО СИГНАЛА
МЕТОД ГРАДУИРОВОЧНОГО ГРАФИКА
Пример 1. При измерении оптической плотности в одинаковых условиях (длина волны 340 нм, толщина поглощающего слоя – 1,00 см) растворов калия дихромата с разной концентрацией хрома (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию хрома (мкг/мл) в растворе Х, имеющем оптическую плотность 0,480.
Рассчитайте массу хрома (мг) в анализируемой пробе, если ее растворили в присутствии концентрированной серной кислоты в воде дистиллированной в мерной колбе объёмом 50,00 мл (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
длина волны 340 нм
Ответ: с = 115,72А – 8,8397 (r = 0,9941); масса хрома в пробе 2,34 мг
Пример 2. При измерении оптической плотности в одинаковых условиях (длина волны 400 нм, толщина поглощающего слоя – 1,00 см) растворов никеля (II) нитрата с разной концентрацией никеля (мг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию никеля (мг/мл) в растворе Х, имеющем оптическую плотность 0,350.
Рассчитайте массу никеля (мг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и развели водой дистиллированной в присутствии азотной кислоты до метки (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
Ответ: с = 42,495А – 3,8535 (r = 0,9986); масса никеля 275 мг
Пример 3. При измерении оптической плотности в одинаковых условиях (длина волны 620 нм, толщина поглощающего слоя – 1,00 см) растворов меди (II) в виде аммиачного комплекса с разной концентрацией меди (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA; определите концентрацию меди (мкг/мл) в растворе Х, имеющем оптическую плотность 0,150.
Рассчитайте массу меди (мкг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и до метки развели водой дистиллированной в присутствии избытка аммиака (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel
2. Расчет с помощью программы Excel
Ответ: с = 34,595А (r = 0,9985); масса меди 130 мкг.
МЕТОД ОДНОГО СТАНДАРТНОГО РАСТВОРА
Измеряют величину аналитического сигнала (yст) для раствора с известной концентрацией вещества (сст). Затем измеряют величину аналитического сигнала (yx) для раствора с неизвестной концентрацией вещества (сx). Такой способ расчёта можно использовать в том случае, если зависимость аналитического сигнала от концентрации описывается линейным уравнением без свободного члена. Концентрация вещества в стандартном растворе должна быть такой, чтобы величины аналитических сигналов, полученных при использовании стандартного раствора и раствора с неизвестной концентрацией вещества, были бы как можно ближе друг к другу.
ПРИМЕР 1. При фотометрическом определении концентрации нитрит-ионов с помощью реактива Грисса (раствора сульфаниловой кислоты и α-нафтиламина в разбавленной уксусной кислоте) было установлено, что раствор с концентрацией нитрит-ионов 2,00 мкг/мл имеет в соответствующих условиях оптическую плотность 0,300. Рассчитайте концентрацию нитрит-ионов в растворе (мкг/мл), оптическая плотность которого в таких же условиях равна 0,250. Зависимость оптической плотности от содержания аналита линейна и проходит через начало координат.
Ответ: 1,67 мкг/мл
МЕТОД ДВУХ СТАНДАРТНЫХ РАСТВОРОВ
(метод ограничивающих растворов)
Измеряют величины аналитических сигналов для стандартных растворов с двумя разными концентрациями вещества, одна из которых (с1) меньше предполагаемой неизвестной концентрации (сx), а вторая (с2) – больше. Его используют, если зависимость аналитического сигнала от концентрации описывается линейным уравнением, не проходящим через начало координат.
Пример 1. Раствор с концентрацией никеля (II) 12,00 мг/мл имеет оптическую плотность 0,350 нм, а с концентрацией 16,00 мг/мл – 0,440. Определите концентрацию никеля (мг/мл) в растворе с оптической плотностью 0,380 (все измерения проводились в одинаковых условиях: длина волны 400 нм, толщина поглощающего слоя – 1,00 см, раствор в азотной кислоте).
Ответ: 13,33 мг/мл
Используют при анализе сложных матриц, когда матричные компоненты оказывают влияний на величину аналитического сигнала и невозможно точно скопировать матричный состав образца, в случае линейной зависимости, проходящей через начало координат.
Вначале измеряют величину аналитического сигнала (yx) для пробы с неизвестной концентрацией вещества. Затем к данной пробе прибавляют некоторое точное количество определяемого вещества (стандарта) и снова измеряют величину аналитического сигнала (yдоб). Концентрацию определяемого компонента в анализируемой пробе (без учета разбавления) рассчитывают по формуле:
Для учета разбавления раствора используем формулу:
ПРИМЕР 1. Раствор с неизвестной концентрацией вещества имел оптическую плотность 0,300. К 5,00 мл такого раствора прибавили 2,00 мл раствора с концентрацией этого же вещества 40,0 мг/л. Оптическая плотность полученного раствора при измерении её в таких же условиях оказалась равна 0,500. Рассчитайте концентрацию вещества (мг/л) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
ПРИМЕР 2. Оптическая плотность раствора с неизвестным содержанием вещества равна 0,400. При добавлении к анализируемому раствору 10,0 мкг этого же вещества оптическая плотность увеличилась до 0,500. Рассчитайте массу определяемого вещества (мкг) в исходном растворе.
1 способ: пропорционально
2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
[spoiler title=”источники:”]
http://fb.ru/article/378024/teoreticheskie-osnovyi-opredeleniya-opticheskoy-plotnosti-rastvora
http://pandia.ru/text/80/260/2737.php
[/spoiler]
Метод сравнения оптических плотностей стандартного и исследуемого окрашенных
растворов
Для определения концентрации вещества берут часть исследуемого раствора, приготавливают из нее окрашенный раствор для фотометрирования и измеряют его оптическую плотность. Затем аналогично приготавливают два-три стандартных окрашенных раствора определяемого вещества известной концентрации и измеряют их оптические плотности при той же толщине слоя (в тех же кюветах).
Значения оптических плотностей сравниваемых растворов будут равны:
для исследуемого раствора
для стандартного раствора
Разделив одно выражение на другое, получаем:
Так как 1Х = lСТ, Ел = const, то
Метод сравнения применяют при однократных определениях.
Метод градуированного графика
Для определения содержания вещества методом градуи-ровочного графика готовят серию из 5-8 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
• он должен охватывать область возможных изменений концентраций исследуемого раствора, желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
• желательно, чтобы в этом интервале концентраций при выбранных толщины кюветы I и аналитической длины волны л соблюдался основной закон светопоглощения, т. е. график D = /(С) был линейным;
• интервал рабочих значений D, соответствующий интервалу стандартных растворов, должен обеспечивать максимальную воспроизводимость результатов измерений.
При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости D = /(С).
Полученная кривая называется градуировочной (градуи-ровочным графиком).
Определив оптическую плотность раствора Dx, находят ее значения на оси ординат, а затем на оси абсцисс — соответствующее ей значение концентрации Сх. Этот метод применяют при выполнении серийных фотометрических анализов.
Метод добавок
Метод добавок представляет собой разновидность метода сравнения. Определение концентрации раствора этим методом основано на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества. Метод добавок обычно применяют для упрощения работы, для устранения мешающего влияния посторонних примесей, в ряде случаев для оценки правильности методики фотометрического определения. Метод добавок требует обязательного соблюдения основного закона светопоглощения.
Неизвестную концентрацию находят расчетным или графическим способами.
При соблюдении основного закона светопоглощения и постоянной толщине слоя отношение оптических плоскостей исследуемого раствора и исследуемого раствора с добавкой будет равно отношению их концентраций:
откуда
где Dx — оптическая плотность исследуемого раствора;
Dx + a — оптическая плотность исследуемого раствора с добавкой;
Сх — неизвестная концентрация исследуемого вещества в исследуемом окрашенном растворе;
Са — концентрация добавки в исследуемом растворе.