Орбитальный радиус
Атомный
радиус. За радиус свободного атома
принимают положение главного максимума
плотности внешних электронных оболочек.
Это так называемый орбитальный
радиус. При изучении строения молекул
и кристаллов атомы и ионы можно
рассматривать как имеющие некий
эффективный радиус, зависящий от типа
химической связи. Если рассматривать
только относительные величины атомных
радиусов, то легко обнаружить периодичность
их зависимости от номера элемента.
В
периодах орбитальные атомные радиусы
по мере увеличения заряда ядра Z в
общем монотонно уменьшаются из-за роста
степени взаимодействия внешних электронов
с ядром.
В
подгруппах радиусы в основном
увеличиваются из-за возрастания числа
электронных оболочек.
У s-
и p-элементов изменение радиусов как
в периодах, так и в подгруппах более
ярко, чем у d- и f-элементов,
поскольку d- и f-электроны внутренние.
Уменьшение радиусов у d- и f-элементов
в периодах называется d- и f-сжатием.
Следствием f-сжатия является то, что
атомные радиусы электронных
аналогов d-элементов пятого и шестого
периодов практически одинаковы:
|
Zn |
Nb |
|
|
rатома, |
0,160 |
0,145 |
Эти
элементы из-за близости их свойств
называются элементами-близнецами.
Образование
ионов приводит к изменению ионных
радиусов по сравнению с
атомными. При этом радиусы катионов
всегда меньше, а радиусы анионов всегда
больше соответствующих атомных радиусов.
Ковалентный радиус равняется половине
межатомного расстояния в молекулах или
кристаллах простых веществ Энергией
ионизации атома I называется
количество энергии, необходимое для
отрыва электрона от невозбужденного
атома или иона.
Энергия
ионизации
Энергия
ионизации I выражается
в кДж∙моль–1 или
эВ∙атом–1.
Значение I в электронвольтах
численно равно потенциалу ионизации,
выраженному в вольтах, поскольку E = e–·I.
Э+ –
e– = Э+, ΔH = I1 –
первый потенциал ионизации; Э – e– = Э2+, ΔH = I2 –
второй потенциал ионизации и т.
д. I1 < I2 < I3 < I4…
Энергия
ионизации определяет характер и прочность
химической связи, и восстановительные
свойства элементов.
|
Элемент |
I1, |
Элемент |
I1, |
|
H |
13,6 |
Na |
5,1 |
|
He |
24,6 |
Mg |
7,6 |
|
Li |
5,4 |
Al |
6,0 |
|
Be |
9,3 |
Si |
8,1 |
|
B |
8,3 |
P |
10,5 |
|
C |
11,3 |
S |
10,4 |
Таблица
1
Потенциалы
(энергии) ионизации I1
Энергия
ионизации изменяется периодически по
мере заполнения электронами оболочек
атомов (рис. 4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
Энергия
связи электрона с ядром пропорциональна Z и
обратно пропорциональна среднему
(орбитальному) радиусу оболочки.
Атомные радиусы d- и f-элементов с
ростом Z в периоде уменьшается
незначительно по сравнению с s-
и p-элементами, поэтому их потенциалы
ионизации растут также незначительно.
В
главных подгруппах потенциалы ионизации
с ростом Z уменьшаются вследствие
увеличения числа электронных подоболочек
и экранирования заряда ядра
электронами внутренних подоболочек.
В
побочных подгруппах d-электроны
экранируются не только электронами
заполненных оболочек, но и
внешними s-электронами. Поэтому
потенциал ионизации d-элементов с
ростом Z в подгруппе увеличивается,
хотя и незначительно.
Чем
меньше потенциал ионизации, тем легче
атом отдает электрон. Поэтому
восстановительная способность нейтральных
атомов с ростом Z в периоде
уменьшается, в главных подгруппах
растет, а в побочных – падает.
Энергия
сродства к электрону
Энергия
сродства к электрону. Другой
важной в химии характеристикой атома
является энергия сродства к электрону –
энергия, выделяющаяся при присоединении
электрона к нейтральному атому. Чем
больше электронное сродство, тем более
сильным окислителем является данный
элемент. Экспериментальное
определение энергии сродства к электрону
E значительно сложнее, чем определение
энергии ионизации. Величины E (в
эВ) для некоторых атомов приведены ниже:
Немонотонность
изменения сродства к электрону в периоде
также обусловлена сравнительной
устойчивостью полностью и наполовину
заполненных подоболочек. Самый
сильный из всех элементарных окислителей
– фтор (он
обладает и самым малым атомным радиусом
из всех элементов VII группы).
Отметим,
что в отличие от ионизации присоединение
двух и более электронов энергетически
затруднено, и многозарядные одноатомные
отрицательные ионы в свободном состоянии
не существуют.
Окислительной
способностью не обладают нейтральны
атомы с устойчивыми конфигурациями s2
и s2p6
и переходные элементы. У остальных
элементов в таблице Менделеева
окислительная способность
нейтральных атомов повышается слева
направо и снизу вверх.
В периодах
электроотрицательность
растет, а в группах уменьшается с ростом
Z, то есть растет от Cs к F по диагонали
периодической системы. Это обстоятельство
до некоторой степени определяет
диагональное сходство элементов.
В главных
и побочных подгруппах свойства элементов
меняются немонотонно, что обусловлено
так называемой вторичной периодичностью,
связанной с влиянием d- и f-электронных
слоев.
Кислотно-основные
и окислительно-восстановительные
свойства
Передача
электронов от атома к атому называется
окислением-восстановлением. Окисляется
тот атом, который отдает свои электроны,
а принимающий электроны – восстанавливается.
Если
в результате реакции получается ионное
соединение, то положительно
заряженный ион
образовался из того элемента, который
отдал
свои электроны, а отрицательный
ион – из элемента,
который электроны принял.
Благодаря
передаче электронов от атома к атому
многие ионы, образующиеся в таких
реакциях, имеют электронную конфигурацию
инертных газов. Приобретение устойчивых
“завершенных” оболочек дает большой
выигрыш в энергии. Такие одинаковые
электронные оболочки ионов
называются изоэлектронными.
В
таблице рядом с каждой частицей указана
ее степень окисления.
При образовании химических связей во
многих случаях электроны могут частично
передаваться от менее электроноакцепторных
атомов к более электроноакцепторным
атомам. Число переданных (или принятых)
электронов и называется степенью
окисления атома.
Количество
отданных или принятых атомом электронов
называется степенью окисления атома в
молекуле.
Можно
продолжить это определение:
При
связывании разных атомов степень
окисления равна заряду, который приобрел
бы атом в этом соединении, если бы оно
могло состоять из ионов.
Сложнее
обстоит дело с полярными ковалентными
соединениями. Здесь на помощь приходит
знание относительной
электроотрицательности элементов.
Например, в молекуле воды Н2О
кислород более электроотрицателен, чем
водород, поэтому электроны связей
смещены в сторону кислорода. Если бы
вода была ионным соединением, то ее
формулу можно было бы записать так
Здесь
степени окисления — это условные заряды
атомов в молекуле, если
считать, будто бы это ионная, а не полярная
ковалентная молекула. Тогда степень
окисления кислорода в воде составляет
-2, а степень окисления водорода +1.
Степень
окисления – это условный заряд атома
в молекуле или кристалле. Его определяют,
условно считая все полярные связи
полностью ионными.
Степень
окисления и валентность несут разную
информацию об атоме в его соединениях.
Валентность просто характеризует
способность атома образовывать некоторое
количество химических связей, а степень
окисления описывает смещения электронов
при образовании химических связей.
СТЕПЕНЬ
ОКИСЛЕНИЯ выражают числом частично или
полностью смещенных электронов от
одного атома к другому в их соединении.
Если
атом отдал электроны,
его степени окисления приписывается
знак “+”, а если атом принял электроны,
то знак “–”. Возможна и нулевая степень
окисления атома в молекуле, если электроны
никуда не смещались или число отданных
и принятых электронов одинаково.
Есть
несколько полезных правил, которые
касаются степеней окисления:
1)
Степень окисления атома любого элемента
в свободном состоянии равна нулю.
2)
Степень окисления любого простого
одноатомного иона равна его заряду.
3)
Степень окисления водорода в его
соединениях с другими элементами равна
+1.
4)
Степень окисления кислорода равна -2 во
всех соединениях, где кислород не
образует простой ковалентной связи
О—О.
5)
Алгебраическая сумма степеней окисления
всех атомов в формуле нейтрального
соединения всегда равна нулю.
6)
Если в ходе химической реакции степень
окисления атома повышается, то говорят,
что он ОКИСЛЯЕТСЯ. Если же степень
окисления понижается, то говорят, что
он ВОССТАНАВЛИВАЕТСЯ.
Что восстанавливается в
таких реакциях окислитель,
а окисляется –
восстановитель.
Любое
вещество в определенных условиях может
проявлять свойства кислоты и основания
по отношению к какому-либо другому
веществу, включая и растворитель.
Протонная
теория Бренстеда–Лоури применима
лишь к протоносодержащим или
протонприсоединяющим веществам. Согласно
этой теории кислотой называется
вещество, способное быть донором
протонов, а основанием – вещество,
которое может присоединить (акцептировать)
протон:
По
определению, HAn – кислота, An– –
основание, сопряженное с этой кислотой.
Любой кислоте соответствует
сопряженное с ней основание.
Любое
кислотно-основное равновесие включает
взаимодействие двух пар сопряженных
кислот и оснований.
В
определенных условиях многие вещества
могут вести себя как кислота или как
основание. Эти два понятия неразделимы,
а потому правильнее говорить о
кислотно-основных свойствах данного
вещества.
В
соответствии с законом действующих
масс константы равновесия реакций
протолиза сопряженных кислот и оснований
в воде связаны между собой простым
соотношением
Произведения
констант диссоциации сопряженных кислот
и оснований в водных растворах равно
ионному произведению воды.
Электронная
теория Льюиса допускает, что
участие в кислотно-основном равновесии
протона необязательно, поэтому ее
называют апротонной. Согласно
апротонной (электронной) теории, кислотой
называется вещество, способное
присоединять электронную пару, а
основанием – вещество, способное
отдавать электронную пару.
Ни
кислота, ни основание протонов не
содержат.
Эта
концепция расширяет границы веществ,
проявляющих кислотно-основные свойства,
включая в себя протонотдающие и
протонприсоединяющие системы.
В периоде
сила кислородсодержащей кислоты растет
с увеличением заряда и с уменьшением
радиуса иона кислотообразующего
элемента:
|
|
Для
одного и того же элемента константа
диссоциации различных кислот возрастает
по мере увеличения степени окисления
кислотообразующего элемента примерно
на пять порядков каждый раз.
|
|
В пределах
одной группы элементов сила кислоты
уменьшается по мере увеличения радиуса
кислотообразующего элемента:
|
|
Для
многоосновных кислот способность к
депротонизации уменьшается по мере
увеличения отрицательного заряда
аниона:
|
|
При этом
константа диссоциации каждой последующей
ступени уменьшается примерно на пять
порядков:
|
K1 : K2 : K3 = 1 : 10–5 : 10–10. |
На
состояние динамического равновесия, в
котором находится раствор слабого
электролита, сильно влияет присутствие
одноименного иона.
|
|
|
Следовательно,
концентрация ионов H+ этого
раствора будет определяться соотношением
концентраций кислоты и соли, взятых для
его приготовления.
Рассуждая
аналогичным образом, можно вывести
уравнения для раствора слабого основания
и его соли (NH3∙H2O и NH4Cl):
|
|
или
|
|
Концентрация
ионов водорода при разбавлении
сохраняется, ибо отношения [кислота] :
[соль], [соль] : [основание] остаются
постоянными. Добавление к такой смеси
кислоты или щелочи приводит к связыванию
избыточных ионов H+ анионами,
а OH– – катионами. Это смещает
равновесие диссоциации слабого
электролита, в результате чего концентрация
H+ практически не меняется. Растворы,
содержащие смесь слабого электролита
и его соли, сохраняющие характерные для
него значения pH при разбавлении,
добавлении сильных кислот или щелочей,
называются буферными.
Буферные
растворы сохраняют постоянство pH только
до прибавления определенного количества
сильной кислоты или щелочи, то есть
буферные растворы обладают определенной
«емкостью».
Буферная
емкость определяется количеством
эквивалентов сильной кислоты или
основания, которые необходимо добавить
к 1 л буферного раствора, чтобы изменить
его pH на единицу.
Чем
более концентрированный буферный
раствор, тем больше его буферная емкость.
РЕЗЮМЕ:
Из анализа периодичности геометрических
и энергетических параметров атомов
следует, что периодическим законом
можно пользоваться для определения
физико-химических констант, предсказывать
изменение радиусов, энергий ионизации
и сродства к электрону, и, следовательно,
кислотно-основные и окислительно-восстановительные
свойства их соединений.
Соседние файлы в папке ИЭ
- #
- #
ЛЕКЦИИ ДЛЯ УЧИТЕЛЕЙ
Конспект лекций
по общей химии
Продолжение. Начало см. в № 8, 12, 13/2004
Глава 2.
Периодический закон Д.И.Менделеева
2.1. Электронные оболочки атомов
Периодический закон – фундаментальный закон
природы – был открыт Д.И.Менделеевым в 1869 г. Закон
устанавливает определенную зависимость между
свойствами элемента (элемент – совокупность
атомов, характеризующихся одинаковым зарядом
ядра) и его важнейшей характеристикой –
порядковым номером в периодической системе
химических элементов.
Первоначально периодический закон имел
следующую формулировку: свойства простых
веществ, а также формы и свойства соединений
элементов находятся в периодической зависимости
от атомных масс элементов.
С развитием знаний о строении атома
периодический закон получил строгое
теоретическое обоснование, а с ним и новую
формулировку: свойства простых веществ, а
также формы и свойства соединений элементов
находятся в периодической зависимости от заряда
ядер их атомов. Эта формулировка не изменяет
сущность периодического закона, она только
углубляет наше понимание его.
Закономерно предположить, что свойства простых
веществ, а также свойства соединений в
значительной степени определяются свойствами
атомов, их образующих. На этом основании можно
предложить третью формулировку периодического
закона: свойства индивидуальных атомов
находятся в периодической зависимости от заряда
их ядер.
Несомненно, что свойства индивидуальных атомов
связаны прежде всего со строением их электронных
оболочек (способом распределения электронов в
атомах). Поэтому можно предложить четвертую
формулировку периодического закона: электронное
строение атомов находится в периодической
зависимости от заряда их ядер.
Рассмотрим зависимость от заряда ядра следующих
свойств индивидуальных атомов: максимального
количества электронов, способных одновременно и
устойчиво находиться в поле притяжения ядра
атома, энергий электронных уровней, орбитальных
и эффективных радиусов атомов, энергий
ионизации, сродства к электрону.
Начнем с максимального количества электронов,
способных находиться в поле притяжения ядра.
Периодичность в свойствах атомов связана прежде
всего с этой характеристикой. Так, в атомах 1-го
периода невозможно одновременное нахождение
более 2 электронов, в атомах 2-го периода – более 10
(2 электрона в первом электронном слое и 8 во
втором), а в атомах 3-го периода – более 18
электронов (рис. 2.1).
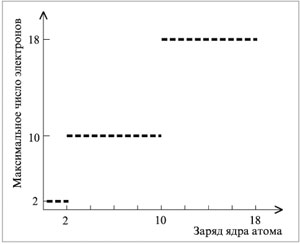 |
Рис. 2.1.
|
Один электрон не способен полностью
экранировать ядро с зарядом +1 или +2, а два
электрона прекрасно с этим справляются. Поэтому
гелий полностью инертен, не образует соединений.
Атом водорода также способен к присоединению
электрона с образованием достаточно устойчивого
гидрид-иона H–, а частица H2–
неизвестна.
С возрастанием заряда ядра до +3 (Li) двух
электронов становится недостаточно. Однако в
случае лития имеется значительное экранирование
ядра электронами первого электронного слоя
(способного содержать лишь два электрона). Третий
электрон вынужденно оказывается во втором
электронном слое (2-й период). Вследствие этого он
слабо связан с ядром, и отсюда способность лития
к легкой отдаче электрона.
Поскольку емкость второго электронного слоя
составляет восемь электронов, у ядра атома лития
в принципе может находиться одновременно десять
электронов (два в первом электронном слое и
восемь во втором). Однако такое никогда не
наблюдалось вследствие незначительного заряда
ядра лития в сравнении с общим зарядом
предполагаемого количества электронов.
Дальнейшее увеличение заряда ядра приводит к
возрастанию способности удерживать электроны во
втором электронном слое. Полное экранирование
ядра достигается при наличии во втором
электронном слое восьми электронов (атом Ne). В
случае третьего электронного слоя полное
экранирование осуществляется при наличии в нем
восемнадцати электронов, хотя уже восьми
электронам в этом слое соответствует достаточно
эффективное «метастабильное» экранирование
ядра (инертный газ Ar).
Метастабильность электронной конфигурации
аргона подтверждается его химическими
свойствами. Аргон с донорами электронов (вода,
фенол, гидрохинон, ацетон) образует соединения
включения, а с электроотрицательными атомами –
эксимеры. Гелий и аргон действительно инертны –
соединения этих газов неизвестны.
Емкость вплоть до восемнадцати электронов у
третьего электронного слоя существенно
увеличивает валентные возможности элементов 3-го
периода. Например, валентность серы в SO3
равна шести (во внешней (валентной) электронной
оболочке атома серы находится шесть электронов).
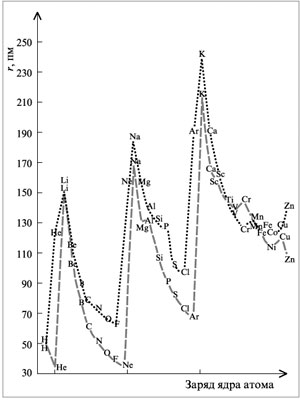
2.2. Радиусы атомов
Зависящие от радиусов атомов энергии атомных
орбиталей, точнее, энергии электронов,
находящихся на различных орбиталях (орбитальные
энергии), определяются взаимным притяжением ядра
и электронов, взаимным отталкиванием электронов
и отражают размеры и электронное строение атома.
Орбитальный радиус несвязанного атома
рассчитывается квантово-химическими методами
как расстояние от его ядра до максимума
электронной плотности, относящегося к последней
занятой электронной орбитали. Рассмотрим
изменения орбитальных радиусов для некоторых
элементов периодической системы Д.И.Менделеева
(табл. 2.1).
В группах для однотипных элементов при движении
сверху вниз наблюдается закономерный рост
орбитальных радиусов, что связано с увеличением
числа электронных оболочек. В периодах при
движении слева направо прослеживается, как
правило, уменьшение орбитальных радиусов.
Таблица 2.1
Орбитальные радиусы некоторых атомов, пм
| Периоды | Группы элементов | |||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | Н 53 |
He 29 |
||||||
| 2 | Li 159 |
Be 104 |
B 78 |
C 60 |
N 49 |
O 41 |
F 39 |
Ne 35 |
| 3 | Na 171 |
Mg 128 |
Al 131 |
Si 107 |
P 92 |
S 81 |
Cl 73 |
Ar 66 |
| 4 | K 216 |
Ca 169 |
Sc 157 |
Ti 148 |
V 140 |
Cr 145 |
Mn 128 |
Fe 123 Co Ni |
| 5 | Cu 119 Rb |
Zn 107 Sr |
Ga 125 |
Ge 109 |
As 99 |
Se 91 |
Br 84 |
Отклонение от такого закономерного
уменьшения орбитальных радиусов наблюдается,
например, при переходе от Mg к Al и объясняется тем,
что последний электрон в атоме Al уже занимает
3p-орбиталь, а это способствует увеличению
орбитального радиуса. Аналогичное возрастание
орбитального радиуса атома по той же причине
происходит и при переходе от Zn к Ga.
Приводимые ниже радиусы связанных атомов
(атомные, металлические) найдены путем деления
пополам кратчайших межатомных расстояний в
кристаллических структурах простых веществ с
координационным числом 12. При других значениях
координационные числа в соответствующие данные
внесены необходимые поправки (табл. 2.2, см. с. 10).
Обратим внимание, что в кристалле радиус атома
гелия намного больше аналогичного для атома
водорода. Объяснить это можно, если принять во
внимание запрет на перекрывание атомных
орбиталей для атомов гелия и отсутствие такого
запрета для атомов водорода.
Таблица 2.2
Атомные радиусы некоторых атомов, пм
| Периоды | Группы элементов | |||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | Н 48 |
He 122 |
||||||
| 2 | Li 155 |
Be 113 |
B 91 |
C 77 |
N 71 |
O 66 |
F 64 |
Ne 160 |
| 3 | Na 189 |
Mg 160 |
Al 143 |
Si 134 |
P 130 |
S 100 |
Cl 95 |
Ar 192 |
| 4 | K 236 |
Ca 197 |
Sc 164 |
Ti 146 |
V 134 |
Cr 127 |
Mn 130 |
Fe 126 Co Ni |
| 5 | Cu 128 Rb |
Zn 139 Sr |
Ga 139 |
Ge 139 |
As 148 |
Se 160 |
Br – |
Kr 198 |
На рис. 2.2 сопоставлены орбитальные и
атомные радиусы атомов, приведенные в табл. 2.1 и
2.2.
|
|
Рис. 2.2.
|
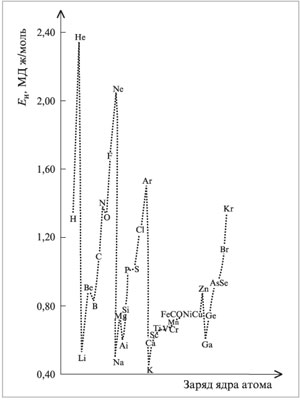
2.3. Энергия ионизации и сродство
к электрону
Различают первую, вторую, третью и т. д. энергии
ионизации атома. Первая энергия ионизации
– это минимальная энергия, необходимая для
удаления первого электрона из основного
состояния атома. Вторая энергия ионизации
– минимальная энергия, необходимая для удаления
второго электрона из основного состояния
однозарядного катиона. Аналогично определяются третья
и последующие энергии ионизации атома.
Очевидно, что для удаления второго электрона
необходимо затратить больше энергии, чем для
удаления первого электрона. Этот факт
объясняется тем, что второй электрон приходится
удалять уже из однозарядного катиона. Рассмотрим
первые энергии ионизации для некоторых
элементов периодической системы Д.И.Менделеева
(табл. 2.3).
Таблица 2.3
Первые энергии ионизации некоторых
атомов, МДж/моль
| Периоды | Группы элементов | |||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | Н 1,31 |
He 2,37 |
||||||
| 2 | Li 0,52 |
Be 0,90 |
B 0,80 |
C 1,09 |
N 1,40 |
O 1,31 |
F 1,68 |
Ne 2,08 |
| 3 | Na 0,49 |
Mg 0,74 |
Al 0,58 |
Si 0,79 |
P 1,01 |
S 1,00 |
Cl 1,25 |
Ar 1,52 |
| 4 | K 0,42 |
Ca 0,59 |
Sc 0,63 |
Ti 0,66 |
V 0,65 |
Cr 0,65 |
Mn 0,72 |
Fe 0,76 Co Ni |
| 5 | Cu 0,74 Rb |
Zn 0,91 Sr |
Ga 0,58 |
Ge 0,76 |
As 0,94 |
Se 0,94 |
Br 1,14 |
Kr 1,35 |
Анализ первых энергий ионизации атомов
показывает, что в целом наблюдается
закономерность роста этих величин в
периодической таблице при движении слева
направо и снизу вверх. Имеются и объяснимые
исключения. Например, энергия ионизации атома Be
(0,90) выше аналогичной характеристики атома B (0,80).
Этот факт легко объяснить, если принять во
внимание, что третий электрон во втором
электронном слое атома В помещается уже на 2р-орбиталь.
Здесь сказывается взаимное отталкивание этого
электрона и находящихся в предыдущем
электронном подслое. Аналогичное исключение
наблюдается и при переходе от Mg к Al.
На рис. 2.3 графически представлены первые энергии
ионизации атомов первых 36 элементов
периодической системы Д.И.Менделеева.
|
|
Рис. 2.3.
|
Сродство к электрону – это энергия,
выделяемая или поглощаемая в результате
присоединения электрона к атому (табл. 2.4).
При анализе данных в табл. 2.4 можно заметить как
положительные, так и отрицательные значения
сродства атомов к электрону. Отрицательные
значения сродства показывают, что для
присоединения еще одного электрона к атому
энергию необходимо затратить.
Таблица 2.4
Сродство атомов к электрону, кДж/моль
| Периоды | Группы элементов | |||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | Н 73 |
He < 0 |
||||||
| 2 | Li 16 |
Be < 0 |
B 27 |
C 122 |
N < 0 |
O 141 |
F 328 |
Ne < 0 |
| 3 | Na 53 |
Mg < 0 |
Al 43 |
Si 134 |
P 72 |
S 200 |
Cl 328 |
Ar < 0 |
| 4 | K 48 |
Ca < 0 |
Sc 18 |
Ti 8 |
V 51 |
Cr 64 |
Mn < 0 |
Fe 16 Co Ni |
| 5 | Cu 119 Rb |
Zn < 0 Sr |
Ga 30 |
Ge 107 |
As 78 |
Se 195 |
Br 325 |
Kr < 0 |
Примечание. По данным из
Химической энциклопедии, т. 4 (М.: БСЭ, 1995, с. 813).
Именно свойства индивидуальных атомов
определяют закономерности образования
химической связи и ее характер. Поэтому тема
периодического закона, свойств и строения атома
теснейшим образом переплетается с темой
химической связи.
2.4. Упражнения
1. В чем состоит суть периодического
закона?
2. Какие формулировки периодического
закона существуют? В чем состоит их отличие?
3. Какими особенностями электронного
строения атома обусловлена периодичность?
4. Какие экспериментальные данные
подтверждают справедливость периодического
закона?
5. Какие виды радиусов атомов вы знаете?
В чем состоит их отличие? Какие радиусы получены
из экспериментальных данных, а какие из расчетов?
6. Объясните периодичность в изменении
орбитальных и атомных радиусов атомов.
7. Объясните периодичность в изменении
энергии ионизации атомов и их сродства к
электрону.
Изображение атома гелия, где плотность вероятности нахождения электрона представлена серым цветом, более тёмные области соответствуют большей плотности.
Ра́диус а́тома — расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома. Поскольку, согласно квантовой механике, атомы не имеют четких границ, а вероятность найти электрон, связанный с ядром данного атома, на определённом расстоянии от этого ядра быстро убывает с увеличением расстояния, атому приписывают некоторый определённый радиус, полагая, что в шаре этого радиуса заключена подавляющая часть электронной плотности (порядка 90 процентов). Существуют различные определения радиуса атома[⇨], три наиболее широко используемых: радиус Ван-дер-Ваальса, ионный радиус и ковалентный радиус.
В зависимости от определения термин «радиус атома» может применяться либо только к изолированным атомам, либо также к атомам в конденсированной среде, ковалентно связанным в молекулах или в ионизированном и возбужденном состояниях; его значение может быть получено путем экспериментальных измерений или вычислено из теоретических моделей. Значение радиуса может зависеть от состояния атома и окружающей среды[1].
Электроны не имеют четко определённых орбит или границ. Скорее, их положения могут быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого сокращения. Кроме того, в конденсированном веществе и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и некоторые из электронов могут перемещаться в области, охватывающей два или более атомов («принадлежать» нескольким атомам одновременно).
Согласно большинству определений, радиусы изолированных нейтральных атомов колеблются в диапазоне от 30 до 300 пм (или от 0,3 до 3 ангстрем), в то время как радиусы атомных ядер находятся пределах от 0,83 до 10 фм[2]. Следовательно, радиус типичного атома примерно в 30 тысяч раз больше радиуса его ядра.
Во многих случаях форма атома может быть аппроксимирована сферой. Это лишь грубое приближение, но оно может дать количественные представления и выступить в качестве базовой модели для описания для многих явлений, таких как плотность жидкостей и твердых веществ, диффузия жидкостей через молекулярные сита, расположение атомов и ионов в кристаллах, а также размер и форма молекул.
Радиусы атомов изменяются, подчиняясь определённым закономерностям периодической таблицы химических элементов. Например, радиусы атомов обычно уменьшаются при перемещении слева направо вдоль каждого периода (строки) таблицы, от щелочных металлов до благородных газов, и возрастают по мере продвижения сверху вниз в каждой группе (столбце). Радиусы атомов резко возрастают при переходе между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения радиусов атомов (наряду с другими химическими и физическими свойствами элементов) могут быть объяснены с точки зрения теории электронной оболочки атома, а также представляют доказательства подтверждения квантовой теории. Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку. Следовательно, эффективный заряд атомного ядра по отношению к внешним электронам увеличивается, притягивая внешние электроны. В результате электронное облако сжимается и атомный радиус уменьшается.
История[править | править код]
В 1920 году, вскоре после того, как стало возможным определять размеры атомов с помощью рентгеноструктурного анализа, было высказано предположение, что все атомы одного и того же элемента имеют одинаковые радиусы[3]. Однако в 1923 году, когда было получено больше данных о кристаллах, было обнаружено, что аппроксимация атома сферой не всегда корректна при сравнении атомов одного и того же элемента в разных кристаллических структурах[4].
Определения[править | править код]
Широко используемые определения радиуса атома включают:
- Радиус Ван-дер-Ваальса, Вандерваальсовы радиусы[5] — эта величина соответствует половине межъядерного расстояния между ближайшими одноимёнными атомами, не связанными между собой химической связью и принадлежащими разным молекулам (например, в молекулярных кристаллах).[6].
- Ионный радиус: номинальный радиус ионов элемента в определённом состоянии ионизации, выведенный из расстояния между атомными ядрами в кристаллических солях, которые включают эти ионы. В принципе, расстояние между двумя соседними противоположно заряженными ионами (длина ионной связи между ними) должно равняться сумме их ионных радиусов[6].
- Ковалентный радиус: номинальный радиус атомов элемента, когда они ковалентно связаны с другими атомами, выводится из расстояния между атомными ядрами в молекулах. В принципе, расстояние между двумя атомами, которые связаны друг с другом в молекуле (длина этой ковалентной связи), должно равняться сумме их ковалентных радиусов[6].
- Металлический радиус: номинальный радиус атомов элемента, когда они соединены с другими атомами металлическими связями.
- Боровский радиус: радиус орбиты электрона с наименьшей энергией, предсказанный Боровской моделью атома (1913)[7][8]. Он применим только к атомам и ионам с одним электроном, таким как водород, однократно ионизованный гелий и позитроний. Хотя сама модель в настоящее время устарела, радиус Бора для атома водорода считается одной из фундаментальных физических постоянных.
Измерение радиуса атома опытным путём[править | править код]
В таблице приведены измеренные опытным путём ковалентные радиусы для элементов, опубликованные американским химиком Д.Слейтером в 1964 году[9]. Значения приведены в пикометрах (пм или 1 × 10-12 м) с точностью около 5 пм. Оттенки цвета ячеек варьируются от красного до жёлтого по мере увеличения радиуса; серый цвет — отсутствие данных.
| Группы (столбцы) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Периоды (строки) |
||||||||||||||||||
| 1 | H 25 |
He 31 |
||||||||||||||||
| 2 | Li 145 |
Be 105 |
B 85 |
C 70 |
N 65 |
O 60 |
F 50 |
Ne 38 |
||||||||||
| 3 | Na 180 |
Mg 150 |
Al 125 |
Si 110 |
P 100 |
S 100 |
Cl 100 |
Ar 71 |
||||||||||
| 4 | K 220 |
Ca 180 |
Sc 160 |
Ti 140 |
V 135 |
Cr 140 |
Mn 140 |
Fe 140 |
Co 135 |
Ni 135 |
Cu 135 |
Zn 135 |
Ga 130 |
Ge 125 |
As 115 |
Se 115 |
Br 115 |
Kr |
| 5 | Rb 235 |
Sr 200 |
Y 180 |
Zr 155 |
Nb 145 |
Mo 145 |
Tc 135 |
Ru 130 |
Rh 135 |
Pd 140 |
Ag 160 |
Cd 155 |
In 155 |
Sn 145 |
Sb 145 |
Te 140 |
I 140 |
Xe |
| 6 | Cs 260 |
Ba 215 |
* |
Hf 155 |
Ta 145 |
W 135 |
Re 135 |
Os 130 |
Ir 135 |
Pt 135 |
Au 135 |
Hg 150 |
Tl 190 |
Pb 180 |
Bi 160 |
Po 190 |
At |
Rn |
| 7 | Fr |
Ra 215 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| Лантаноиды | * |
La 195 |
Ce 185 |
Pr 185 |
Nd 185 |
Pm 185 |
Sm 185 |
Eu 185 |
Gd 180 |
Tb 175 |
Dy 175 |
Ho 175 |
Er 175 |
Tm 175 |
Yb 175 |
Lu 175 |
||
| Актиноиды | ** |
Ac 195 |
Th 180 |
Pa 180 |
U 175 |
Np 175 |
Pu 175 |
Am 175 |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||
Объяснение общих тенденций[править | править код]
Изменение радиуса атома с увеличением зарядового числа можно объяснить расположением электронов в оболочках с постоянной ёмкостью. Оболочки обычно заполнены в порядке увеличения радиуса, поскольку отрицательно заряженные электроны притягиваются положительно заряженными протонами атомного ядра. Поскольку зарядовое число увеличивается вдоль каждой строки периодической таблицы, дополнительные электроны входят в ту же самую внешнюю оболочку, а её радиус постепенно сжимается из-за увеличения заряда ядра. В атомах инертных газов внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего элемента — щелочного металла — перейдет в следующую внешнюю оболочку, что объясняет внезапное увеличение атомного радиуса.
Увеличивающийся заряд ядра частично уравновешивается ростом числа электронов, это явление известно как экранирование[en]; он объясняет, почему размер атомов обычно увеличивается в каждом столбце периодической таблицы. Из этой закономерности есть важное исключение, известное как лантаноидное сжатие: меньшие, по сравнению с ожидаемыми, величины ионных радиусов химических элементов, входящих в группу лантаноидов (атомный номер 58—71), которое происходит из-за недостаточного экранирования заряда ядра электронами 4f-орбитали.
По существу, атомный радиус уменьшается на протяжении периодов из-за увеличения количества протонов в ядре. Соответственно, большее количество протонов создает более сильный заряд и сильнее притягивает электроны, уменьшая размер радиуса атома. При движении сверху вниз по столбцам (группам) периодической таблицы атомный радиус увеличивается, поскольку есть больше энергетических уровней и, следовательно, больше расстояние между протонами и электронами. Кроме того, электронное экранирование ослабляет притяжение протонов, поэтому оставшиеся электроны могут удаляться от положительно заряженного ядра. Таким образом, размер (радиус атома) увеличивается.
В следующей таблице приведены основные факторы, влияющие радиус атома:
| Фактор | Закон | Возрастает с… | как правило | Влияние на радиус атома |
|---|---|---|---|---|
| Электронные оболочки | Квантовая механика | Главным и азимутальным квантовым числом | Увеличивает радиус атома | Возрастает сверху вниз в каждой колонке |
| Атомный заряд | Притяжение электронов протонами ядра атома | Зарядовым числом | Сокращает радиус атома | Сокращается в течение всего периода |
| Экранирование | Отталкивание внешних электронов внутренними электронами | Количеством электронов во внутренних оболочках | Увеличивает радиус атома | Снижает эффект второго фактора |
Лантаноидное сжатие[править | править код]
У химических элементов группы лантаноидов электроны в 4f-подоболочке, которая постепенно заполняется от церия (Z = 58) до лютеция (Z = 71), не особенно эффективны для экранирования увеличивающегося заряда ядра. Элементы, следующие непосредственно за лантаноидами, имеют радиусы атомов, которые меньше, чем можно было бы ожидать, и которые почти идентичны атомным радиусам элементов, находящихся непосредственно над ними[10]. Следовательно, гафний имеет практически тот же атомный радиус (и химические свойства), что и цирконий, а тантал имеет радиус атома, как у ниобия, и так далее. Эффект лантаноидного сжатия заметен вплоть до платины (Z = 78), после чего он нивелируется релятивистским эффектом, известным как эффект инертной пары[en].
Лантаноидное сжатие даёт 5 следующих эффектов:
- Размер ионов Ln3 + регулярно уменьшается с атомным номером. Согласно правилам Фаянса[en], уменьшение размера ионов Ln3+ увеличивает ковалентную связь и уменьшает основную связь между ионами Ln3+ и OH− в Ln(OH)3 до такой степени, что Yb(OH)3 и Lu(OH)3 с трудом растворяются в горячем концентрированном NaOH. Отсюда порядок размера ионов Ln3+:
La3+ > Ce3+ > …, … > Lu3+. - Наблюдается регулярное уменьшение ионных радиусов.
- Наблюдается регулярное снижение способности ионов действовать в качестве восстановителя с увеличением атомного номера.
- Второй и третий ряды переходных элементов d-блока довольно близки по свойствам.
- Эти элементы встречаются вместе в природных минералах и их трудно разделить.
d-сжатие[править | править код]
d-сжатие[en] менее выражено, чем лантаноидное сжатие, но возникает по той же причине. В этом случае плохая экранирующая способность 3d-электронов влияет на атомные радиусы и химические свойства элементов, следующих непосредственно за первым рядом переходных металлов, от галлия (Z = 30) до брома (Z = 35)[10].
Вычисленные радиусы атомов[править | править код]
В таблице приведены значения радиусов атомов, рассчитанные по теоретическим моделям, опубликованные итальянским химиком Энрико Клементи[en] и другими в 1967 году[11]. Значения даны в пикометрах (пм).
| Группы (столбцы) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Периоды (строки) |
||||||||||||||||||
| 1 | H 53 |
He 31 |
||||||||||||||||
| 2 | Li 167 |
Be 122 |
B 87 |
C 67 |
N 56 |
O 48 |
F 42 |
Ne 38 |
||||||||||
| 3 | Na 190 |
Mg 145 |
Al 118 |
Si 111 |
P 98 |
S 88 |
Cl 79 |
Ar 71 |
||||||||||
| 4 | K 243 |
Ca 194 |
Sc 184 |
Ti 176 |
V 171 |
Cr 166 |
Mn 161 |
Fe 156 |
Co 152 |
Ni 149 |
Cu 145 |
Zn 142 |
Ga 136 |
Ge 125 |
As 114 |
Se 103 |
Br 94 |
Kr 98 |
| 5 | Rb 265 |
Sr 219 |
Y 212 |
Zr 206 |
Nb 198 |
Mo 190 |
Tc 183 |
Ru 178 |
Rh 173 |
Pd 169 |
Ag 165 |
Cd 161 |
In 156 |
Sn 145 |
Sb 133 |
Te 123 |
I 115 |
Xe 108 |
| 6 | Cs 298 |
Ba 253 |
* | Hf 208 |
Ta 200 |
W 193 |
Re 188 |
Os 185 |
Ir 180 |
Pt 177 |
Au 174 |
Hg 171 |
Tl 156 |
Pb 154 |
Bi 143 |
Po 135 |
At 127 |
Rn 120 |
| 7 | Fr |
Ra |
** | Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| Лантаноиды | * | La 226 |
Ce 210 |
Pr 247 |
Nd 206 |
Pm 205 |
Sm 238 |
Eu 231 |
Gd 233 |
Tb 225 |
Dy 228 |
Ho 226 |
Er 226 |
Tm 222 |
Yb 222 |
Lu 217 |
||
| Актиноиды | ** | Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||
См. также[править | править код]
- Боровский радиус
- Ковалентный радиус
- Радиус Ван-дер-Ваальса
- Ионный радиус
- Химическая связь
Примечания[править | править код]
- ↑
Cotton, F. A.; Wilkinson, G. Advanced Inorganic Chemistry (неопр.). — 5th. — Wiley, 1988. — С. 1385. — ISBN 978-0-471-84997-1. - ↑
Basdevant, J.-L.; Rich, J.; Spiro, M. Fundamentals in Nuclear Physics (неопр.). — Springer, 2005. — С. 13, fig 1.1. — ISBN 978-0-387-01672-6. - ↑
Bragg, W. L. The arrangement of atoms in crystals (англ.) // Philosophical Magazine : journal. — 1920. — Vol. 6, no. 236. — P. 169—189. — doi:10.1080/14786440808636111. - ↑
Wyckoff, R. W. G. On the Hypothesis of Constant Atomic Radii (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1923. — Vol. 9, no. 2. — P. 33—38. — doi:10.1073/pnas.9.2.33. — Bibcode: 1923PNAS….9…33W. — PMID 16576657. — PMC 1085234. - ↑ Такое написание даёт «Русский орфографический словарь: около 200 000 слов / Российская академия наук. Институт русскоrо языка им. В. В. Виноградова / Под ред. В. В. Лопатина, О. Е. Ивановой. — Изд. 4-е, испр. и доп. — М.: АСТ-ПРЕСС КНИГА, 2013. — 896 с. — (Фундаментальные словари русскою языка). — с. 68. — ISBN 978-5-462-01272-3».
- ↑ 1 2 3
L.; Pauling. The Nature of the Chemical Bond (неопр.). — 2nd. — Cornell University Press, 1945. - ↑
Bohr, N. On the Constitution of Atoms and Molecules, Part I. – Binding of Electrons by Positive Nuclei (англ.) // Philosophical Magazine : journal. — 1913. — Vol. 26, no. 151. — P. 1—24. — doi:10.1080/14786441308634955. - ↑
Bohr, N. On the Constitution of Atoms and Molecules, Part II. – Systems containing only a Single Nucleus (англ.) // Philosophical Magazine : journal. — 1913. — Vol. 26, no. 153. — P. 476—502. — doi:10.1080/14786441308634993. - ↑
Slater, J. C. Atomic Radii in Crystals (англ.) // Journal of Chemical Physics : journal. — 1964. — Vol. 41, no. 10. — P. 3199—3205. — doi:10.1063/1.1725697. — Bibcode: 1964JChPh..41.3199S. - ↑ 1 2
W. L.; Jolly. Modern Inorganic Chemistry (неопр.). — 2nd. — McGraw-Hill Education, 1991. — С. 22. — ISBN 978-0-07-112651-9. - ↑
Clementi, E.; Raimond, D. L.; Reinhardt, W. P. Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons (англ.) // Journal of Chemical Physics : journal. — 1967. — Vol. 47, no. 4. — P. 1300—1307. — doi:10.1063/1.1712084. — Bibcode: 1967JChPh..47.1300C.
Литература[править | править код]
- Рабинович В. А., Хавин З.Я. Краткий химический справочник. Изд. 2-е, испр. и доп. — Л.: Химия, 1978. — 392 с.
Как определить радиус атома
Под радиусом атома понимается расстояние между ядром данного атома и его самой дальней электронной орбитой. На сегодняшний день общепринятой единицей измерения атомного радиуса является пикометр(пм). Определить радиус атома очень легко.

Вам понадобится
- Периодическая таблица Менделеева
Инструкция
Первым делом, под рукой должна иметься обычная таблица Менделеева, в которой по порядку расставлены все известные человечеству химические элементы. Найти эту таблицу очень легко в любом справочнике по химии, школьном учебнике, либо же ее можно приобрести отдельно, в ближайшем книжном магазине.
В правом верхнем углу у каждого из химических элементов указан его порядковый номер. Этот номер полностью совпадает с атомным радиусом данного атома.
Например, порядковый номер хлора (Cl) – 17. Это означает, что расстояние от ядра атома хлора до самой дальней его орбиты движения стабильного электрона равно 17 пм. Если требуется найти не только атомный радиус, но и распределение электронов по электронным орбитам, то эти данные можно подчеркнуть из столбика цифр, расположенного справа от названия химического элемента.
Обратите внимание
Благодаря таблице Менделеева, очень легко найти не только атомный радиус, но и атомную массу, молекулярную массу, период и ряд того или иного элемента, а также и распределение электронов по электронным орбитам вместе с количеством орбит.
Наиболее популярной моделью атома является модель, принятая в 1913 году Нильсом Бором. Также она известна как планетарная модель. Связано это с тем, что электроны, подобно планетам Солнечной системы, движутся вокруг Солнца – ядра атома. Орбиты движения электронов постоянны. Разработка данной модели дала толчок к развитию нового направления в теоретической физике – квантовой механике.
Самый первый радиус орбиты движения электрона называется боровским радиусом, а энергия электронов на первой орбите называется энергией ионизации атома.
Полезный совет
Стоит отметить, что радиус любого атома обратно пропорционален количеству протонов в его ядре, а также равен заряду его ядра.
Источники:
- как изменяется радиус атома
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.