| Ортофосфорная кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Ортофосфорная кислота | |
| Хим. формула | H3PO4 | |
| Физические свойства | ||
| Состояние | Твёрдое | |
| Молярная масса | 97,97 г/моль | |
| Плотность | 1,685 (жидкость) | |
| Динамическая вязкость | 2,4—9,4 сПуаз | |
| Термические свойства | ||
| Температура | ||
| • плавления | +42,35 °C | |
| • кипения | +158 °C | |
| Давление пара | 0,03 ± 0,01 мм рт.ст.[1] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
2,12; 7,21; 12,67 | |
| Растворимость | ||
| • в воде | 548 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 7664-38-2 | |
| PubChem | 1004 | |
| Рег. номер EINECS | 231-633-2 | |
| SMILES |
OP(O)(O)=O |
|
| InChI |
InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) NBIIXXVUZAFLBC-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E338 | |
| RTECS | TB6300000 | |
| ChEBI | 26078 | |
| Номер ООН | 1805 | |
| ChemSpider | 979 | |
| Безопасность | ||
| Краткие характер. опасности (H) |
H290, H314 |
|
| Меры предостор. (P) |
P280, P303+P361+P353, P304+P340+P310, P305+P351+P338 |
|
| Сигнальное слово | ОПАСНО! | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 0 ACID |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Ортофо́сфорная кислота́ (фо́сфорная кислота́, химическая формула — H3PO4) — неорганическая кислота средней силы, отвечающая высшей степени окисления фосфора (+5).
При стандартных условиях представляет собой твердые бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Физические свойства[править | править код]
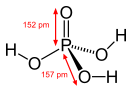
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллизуется в моноклинной сингонии.
Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
- 75 % H3PO4 (т. пл. −20 °С);
- 80 % H3PO4 (т. пл. 0 °С);
- 85 % H3PO4 (т. пл. 20 °С).
Из 85%-й фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O[2][3].
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40—50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой[3].
Химические свойства[править | править код]

Ионный состав в зависимости от pH раствора
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10–3 (pKa1 2,12); K2 = 6,2⋅10–8 (pKa2 7,20); K3 = 5,0⋅10–13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична[4].
В результате фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик[4].
1. Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты[4]:
2. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок[4]:
3. Качественная реакция на ион H2РО4− — образование ярко-жёлтого осадка молибденофосфата аммония при реакции кислоты с молибдатом аммония и азотной кислотой (выступающей в качестве среды):
Получение[править | править код]
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году[2]. Лабораторный метод получения заключается в окислении фосфора азотной кислотой[4]:
Термический способ[править | править код]
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой[5]:
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте[6].
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием[6].
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота[7]. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара[5].
Экстракционный способ[править | править код]
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау[8]). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения[9].
Разложение сырья происходит по следующей схеме (параметр x принимает значения от 0,1 до 2,2):
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами[9].
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии. Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм. Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70—80 °С, а концентрация фосфорной кислоты в системе равна 28—31 % в пересчёте на P2O5. В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40—55 % и даже до 70 % P2O5[10].
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80—100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40—48 %[10].
Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат[10].
Концентрирование и очистка[править | править код]
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50—60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6[11].
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.[12]
Экономические и экологические аспекты[править | править код]
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %[13].
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов[13].
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5—5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья[14].
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно[14].
Применение[править | править код]
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для удаления ржавчины с металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность[править | править код]
В авиационной промышленности эфиры ортофосфорной кислоты используются в составе гидрожидкости НГЖ-5У[15].
Пищевая промышленность[править | править код]
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство[править | править код]
В звероводстве (в частности, при выращивании норок) используют выпойку раствором ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Также её применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология[править | править код]
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Безопасность[править | править код]
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При проглатывании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость[16].
У добровольцев, получавших фосфорную кислоту перорально в количестве 2—4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5—1 г/л фосфорной кислоты в напитках[16].
Воздействие на кальций в костях[править | править код]
В Интернете и потребительских журналах опубликовано множество заявлений и исследований касательно вреда употребления напитков типа колы на минерализацию костной ткани[17][18][19]. Большинство из приведённых исследований являются эпидемиологическими «опросниками» и не являются достоверными доказательствами причинно-следственной связи между потреблением фосфорной кислоты в регламентируемых количествах в напитках и риском развития остеопороза, почечнокаменной болезни и прочих заболеваний.
Фосфорная кислота, используемая во многих безалкогольных напитках (в первую очередь в коле), была связана с более низкой плотностью костной ткани в большом числе эпидемиологических исследований. Например, исследование с использованием двухэнергетической рентгеновской абсорбциометрии, даёт спорные доказательства в поддержку теории о том, что употребление колы приводит к снижению плотности костной ткани[20]. Это исследование было опубликовано в Американском журнале клинического питания. В период с 1996 по 2001 год было обследовано в общей сложности 1672 женщины и 1148 мужчин. Информация о питании была собрана с помощью опросов о частоте употребления пищи, количестве порций колы и других газированных напитков в день, а также проводилось различие между напитками, не содержащими кофеина и диетическими газированными напитками. В статье приводятся статистически значимые доказательства того, что женщины, ежедневно употребляющие колу, имеют более низкую плотность костной ткани. Поскольку авторы исследования использовали метод опроса, не контролировались прочие факторы риска, которые, вероятно, во многом повлияли на снижение плотности костной ткани, например, малоподвижный образ жизни и, в целом, низкое потребление кальция из прочих жидкостей и продуктов питания[20]. Авторы исследования уточнили, что для подтверждения полученных результатов необходимы дальнейшие исследования[20].
С другой стороны, исследование, финансируемое Pepsi, предполагает, что низкое потребление фосфора приводит к снижению плотности костной ткани. В исследовании не изучается действие фосфорной кислоты, которая связывается с магнием и кальцием в пищеварительном тракте с образованием солей, которые не всасываются, а, скорее, изучается общее потребление фосфора[21].
Однако контролируемое рандомизируемое клиническое исследование, проведённое с использованием методов баланса кальция, не выявило влияния газированных безалкогольных напитков, содержащих фосфорную кислоту, на выведение кальция[22]. В исследовании сравнивалось влияние воды, молока и различных безалкогольных напитков (два напитка с кофеином и два без; два с фосфорной кислотой и два с лимонной кислотой) на баланс кальция у женщин в возрасте от 20 до 40 лет, которые обычно употребляли ~3 или более чашек (680 мл) газированного безалкогольного напитка в день. Они обнаружили, что по сравнению с водой только молоко и два безалкогольных напитка, содержащих кофеин, увеличивали содержание кальция в моче, и что потеря кальция, связанная с потреблением безалкогольных напитков с кофеином, была примерно равна той, которая была ранее обнаружена только для кофеина. Фосфорная кислота без кофеина не оказывала влияния на кальций в моче и не увеличивала потерю кальция в моче, связанную с кофеином. Поскольку исследования показали, что эффект кофеина компенсируется снижением потерь кальция в течение дня[23], авторы пришли к выводу, что чистый эффект газированных напитков, в том числе содержащих кофеин и ортофосфорную кислоту, незначителен и что скелетные эффекты потребления газированных безалкогольных напитков, вероятно, обусловлены главным образом вытеснением молока, а не влиянием фосфорной кислоты.
Другие химические вещества, такие как кофеин (также являющийся важным компонентом популярных распространённых напитков типа кола), также подозревались в качестве возможных факторов, способствующих низкой плотности костной ткани, из-за известного влияния кофеина на кальциурию. Так, ещё одно исследование, опубликованное в Американском журнале клинического питания, в котором приняли участие 30 женщин в течение недели, предполагает, что ортофосфорная кислота в тех количествах, что содержится в коле, не оказывает вредного воздействия на здоровье человека, а кофеин оказывает лишь временный эффект, который позже отменяется. Авторы этого исследования пришли к выводу, что скелетные эффекты потребления газированных напитков, вероятно, обусловлены главным образом вытеснением молока, аналогично предыдущему исследованию[22]. Другим возможным сбивающим с толку фактором может быть связь между высоким потреблением безалкогольных напитков и малоподвижным и, в целом, нездоровым образом жизни.
Европейское агентство по безопасности продуктов питания (EFSA) в 2019 году изменило дозировки пищевых добавок, являющиеся источником фосфора с учётом потребления фосфорной кислоты из газированных напитков[24][25]. По мнению EFSA, «предполагаемое общее потребление фосфатов с пищевыми продуктами может превышать безопасный уровень … EFSA пересмотрела допустимое суточное потребление (ДСП) для всей группы фосфатов, являющиеся источником фосфора … Группа экспертов пришла к выводу, что, с учётом изменения уровня ДСП, потребление фосфора в размере 40 мг/кг массы тела в день из продуктов питания и безалкогольных напитков является защитным для популяции»[24][25].
Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам (JECFA) в 1982 году счёл группу фосфатов (E338–341, E343, E450–452) безопасными пищевыми добавками при условии употребления не более 70 мг/кг массы тела[26]. Согласно мнению экспертов Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), фосфорная кислота имеет статус «общепризнанно как безопасно» (GRAS), что означает, что у экспертов FDA единогласное мнение о безопасности вещества при использовании фосфорной кислоты по назначению[27].
Примечания[править | править код]
- ↑ http://www.cdc.gov/niosh/npg/npgd0506.html
- ↑ 1 2 Ullmann, 2008, p. 679.
- ↑ 1 2 Химическая энциклопедия, 1998, с. 153–154.
- ↑ 1 2 3 4 5 Химическая энциклопедия, 1998, с. 154.
- ↑ 1 2 Ullmann, 2008, p. 681.
- ↑ 1 2 Ullmann, 2008, p. 681–682.
- ↑ Ullmann, 2008, p. 683.
- ↑ Химическая энциклопедия, 1998, с. 301.
- ↑ 1 2 Ullmann, 2008, p. 684.
- ↑ 1 2 3 Ullmann, 2008, p. 686.
- ↑ Ullmann, 2008, p. 688.
- ↑ Ullmann, 2008, p. 689–690.
- ↑ 1 2 Ullmann, 2008, p. 690.
- ↑ 1 2 Ullmann, 2008, p. 691.
- ↑ Масло НГЖ-5У – характеристики и цены. Дата обращения: 5 января 2022. Архивировано 5 января 2022 года.
- ↑ 1 2 Ullmann, 2008, p. 721.
- ↑ Сколько можно пить газировки без вреда для здоровья? — Meduza, Meduza. Архивировано 7 февраля 2022 года. Дата обращения: 7 февраля 2022.
- ↑ Жажда знаний: исследователи выяснили, вредно ли пить Кока-Колу. Медпортал. Дата обращения: 7 февраля 2022. Архивировано 7 февраля 2022 года.
- ↑ Врачи объясняют, что происходит с вашим организмом после употребления кока-колы. РЗ – Онлайн версия журнала Рубежи здоровья (4 марта 2021). Дата обращения: 7 февраля 2022. Архивировано 7 февраля 2022 года.
- ↑ 1 2 3 Katherine L. Tucker, Kyoko Morita, Ning Qiao, Marian T. Hannan, L. Adrienne Cupples. Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study // The American Journal of Clinical Nutrition. — 2006-10. — Т. 84, вып. 4. — С. 936–942. — ISSN 0002-9165. — doi:10.1093/ajcn/84.4.936. Архивировано 22 апреля 2022 года.
- ↑ S. Elmståhl, B. Gullberg, L. Janzon, O. Johnell, B. Elmståhl. Increased incidence of fractures in middle-aged and elderly men with low intakes of phosphorus and zinc // Osteoporosis international: a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. — 1998. — Т. 8, вып. 4. — С. 333–340. — ISSN 0937-941X. — doi:10.1007/s001980050072. Архивировано 7 февраля 2022 года.
- ↑ 1 2 Robert P Heaney, Karen Rafferty. Carbonated beverages and urinary calcium excretion // The American Journal of Clinical Nutrition. — 2001-09-01. — Т. 74, вып. 3. — С. 343–347. — ISSN 1938-3207 0002-9165, 1938-3207. — doi:10.1093/ajcn/74.3.343.
- ↑ M J Barger-Lux, R P Heaney, M R Stegman. Effects of moderate caffeine intake on the calcium economy of premenopausal women // The American Journal of Clinical Nutrition. — 1990-10-01. — Т. 52, вып. 4. — С. 722–725. — ISSN 1938-3207 0002-9165, 1938-3207. — doi:10.1093/ajcn/52.4.722.
- ↑ 1 2 Re-evaluation of phosphoric acid–phosphates – di-, tri- and polyphosphates (E 338–341, E 343, E 450–452) as food additives and the safety of proposed extension of use | EFSA (англ.). www.efsa.europa.eu. Дата обращения: 7 февраля 2022. Архивировано 7 февраля 2022 года.
- ↑ 1 2 EFSA issues new EU phosphates limits advice, warns that safe levels may be being exceeded (англ.). .foodingredientsfirst.com/. Дата обращения: 26 марта 2022.
- ↑ World Health Organization. Phosphoric acid. Joint FAO/WHO Expert Committee on Food Additives. Дата обращения: 7 февраля 2022. Архивировано 7 февраля 2022 года.
- ↑ CFR – Code of Federal Regulations Title 21. www.accessdata.fda.gov. Дата обращения: 7 февраля 2022. Архивировано 7 февраля 2022 года.
Литература[править | править код]
- Букколини Н. В. Фосфорная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 153–156. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Schrödter K., Bettermann G., Staffel T., Wahl F., Klein T., Hofmann T. Phosphoric Acid and Phosphates (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2008. — doi:10.1002/14356007.a19_465.pub3.
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия. 1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter. — Vol.24,№ 11. — 2000. —P.1—2.
Кислота средней силы. Ее соли – фосфаты плохо растворимы в воде, кроме фосфатов щелочных металлов и аммония.
Альтернативные названия
Ортофосфорная кислота, гидроксид фосфора (V)
Формула
H3PO4
Свойства фосфорной кислоты
Физические свойства
Фосфорная кислота самая устойчивая при комнатной температуре фосфорных кислот. Кроме ортофосфорной кислоты H3PO4 существует метафосфорная кислота HPO3, пирофосфорная H4P2O7, трифосфорная H3P3O9 и тетрафосфорная H4P4O12. Последние три намного сильнее ортофосфорной кислоты (K1 = 7 ⋅cdot 10-3).
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветная жидкость в водном растворе, в чистом виде – гигроскопичные кристаллы |
| Молярная масса, г/моль | 98,0 |
| Плотность при 20°С, г/см3 | 1,83 |
| Температура плавления, °С | +42,35 |
| Температура кипения, °С | 213 (разл.) |
Химические свойства
В водных растворах фосфорная кислота диссоциирует на ионы:
H3PO4 ⇄rightleftarrows H+ + H2PO4–, ⇄rightleftarrows 2H+ + HPO42- ⇄rightleftarrows 3H+ + PO43-.
K1 = 7,1·10-3,
K2 = 6,2·10-8,
K3 = 5,0·10-13.
При комнатной температуре фосфорная кислота реагирует лишь с активными металлами, оксидами и гидроксидами:
6Li + 2H3PO4 = 2Li3PO4 + 3H2↑,
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O,
3KOH + H3PO4 = K3PO4 + 3H2O.
При нагревании она более активна:
3Zn + 2H3PO4 = 2Zn3(PO4)2 ↓+ 3H2↑,
Fe2O3 +2H3PO4 = 2FePO4↓+ 3H2O.
Фосфорная кислота разлагается при нагревании:
4H3PO4 = 2H4P2O7 + 2H2O.
Фосфорная кислота вступает в реакцию с хлорной кислотой, образуя соли фосфорила:
H3PO4 + HClO4= P(OH)4ClO4.
Поэтому можно считать фосфорную кислоту амфотерным гидроксидом фосфора (V) с преобладанием кислотных свойств.
Получение
Лабораторные способы получения
Фосфорную кислоту в лабораторных условиях получают из оксида фосфора (V):
P2O5 + 3H2O = 2H3PO4.
Реакция протекает бурно, поэтому ее лучше получать таким способом в промышленности.
Можно получить фосфорную кислоту из фосфатов действием соляной или серной кислоты:
Na3PO4 + 3HCI = 3NaCI + H3PO4.
Наконец, можно подвергнуть гидролизу хлорид фосфора (V):
2PCl5+ 8H2O = 2H3PO4 + 10HCl.
Получение в промышленности
В промышленности наиболее чистую фосфорную кислоту получают термическим способом, для чего фосфор сжигают:
4P +5O2 = 2P2O5.
Фосфорный ангидрид взаимодействует с водой слишком бурно, поэтому фосфорный ангидрид смешивают с нагретой до 200°С фосфорной кислотой в концентрации 50-60%. Полученную кислоту разводят и частично запускают вновь в процесс.
Есть экстракционный метод получения фосфорной кислоты непосредственно из руд, например, из апатита:
Ca5(PO4)3F + 5H2SO4 + n H3PO4 + 3H2O = (n+3) H3PO4+ 5CaSO4·H2O + HF.
Применение
Фосфорная кислота используется при производстве высококонцентрированных фосфорных удобрений, полифосфатов, синтетических моющих средств, умягчителей воды, а также в качестве катализатора.
В стекольном производстве ее добавляют при варке специальных стекол.
В медицине ее применяют при производстве многих лекарственных препаратов.
В химическом анализе из фосфорной кислоты и фосфатов готовят буферные растворы.
Пример решения задачи
Осуществите следующие превращения:
Na3PO4 → H3PO4 → HPO3 → KPO3→ AgPO3.
Решение
Na3PO4+3HCI = 3NaCI+H3PO4;
H3PO4 + P2O5 = 3HPO3;
HPO3 + KOH = KPO3 + Н2О,
KPO3 + AgNO3 = AgPO3↓ + KNO3.
Тест по теме «Фосфорная кислота»
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.

Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.

При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.

Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3

Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
| Ортофосфорная кислота | |
|---|---|
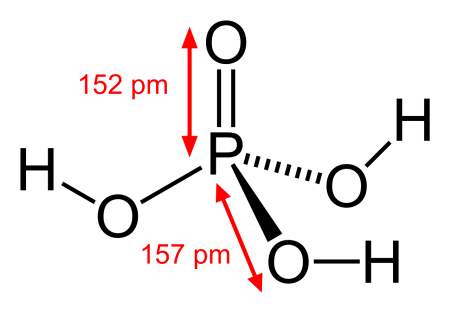 |
|
 |
|
| Систематическое наименование |
Ортофосфорная кислота |
| Хим. формула | H3PO4 |
| Состояние | твёрдое |
| Молярная масса | 98,0 г/моль |
| Плотность | 1,685 (жидк) |
| Динамическая вязкость | 2,4-9,4 сПуаз |
| Т. плав. | +42,35 °C |
| Т. кип. | +158 °C |
| Давление пара | 0,03 ± 0,01 мм рт.ст. |
| pKa | 2,12; 7,21; 12,67 |
| Растворимость в воде | 548 г/100 мл |
| ГОСТ | ГОСТ 10678-76 ГОСТ 6552-80 |
| Рег. номер CAS | 7664-38-2 |
| PubChem | 1004 |
| Рег. номер EINECS | 231-633-2 |
| SMILES |
OP(O)(O)=O |
| InChI |
1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) NBIIXXVUZAFLBC-UHFFFAOYSA-N |
| Кодекс Алиментариус | E338 |
| RTECS | TB6300000 |
| ChEBI | 26078 |
| Номер ООН | 1805 |
| ChemSpider | 979 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Термический способ
- 3.2 Экстракционный способ
- 3.3 Концентрирование и очистка
- 3.4 Экономические и экологические аспекты
- 4 Применение
- 4.1 Авиационная промышленность
- 4.2 Пищевая промышленность
- 4.3 Сельское хозяйство
- 4.4 Стоматология
- 5 Безопасность

Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
- 75 % H3PO4 (т. пл. –20 °С);
- 80 % H3PO4 (т. пл. 0 °С);
- 85 % H3PO4 (т. пл. 20 °С).
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
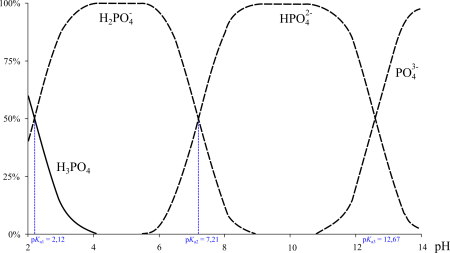
Ионный состав в зависимости от pH раствора.
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10–3 (pKa1 2,12); K2 = 6,2⋅10–8 (pKa2 7,20); K3 = 5,0⋅10–13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
-
H3PO4(aq) + H2O(l) ⇌ H3O(aq)+ + H2PO4(aq)− H2PO4(aq)− + H2O(l) ⇌ H3O(aq)+ + HPO4(aq)2− HPO4(aq)2− + H2O(l) ⇌ H3O(aq)+ + PO4(aq)3−
Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
- 2H3PO4 → H2O + H4P2O7 ;
- H4P2O7 → H2O + 2HPO3
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
- H3PO4 + 3AgNO3 → Ag3PO4 + 3HNO3
Качественной реакцией на ион H2PO4− является образование ярко-жёлтого осадка молибденофосфата аммония:
- H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O

Получение
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
- 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
- P4 + 5O2 → P4O10 ;
- P4O10 + 6H2O → 4H3PO4
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
- Ca5(PO4)3F + 5H2SO4 + 5xH2O → 5CaSO4 ⋅ xH2O + 3H3PO4 + HF
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии. Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм. Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70-80 °С, а концентрация фосфорной кислоты в системе равна 28-31 % в пересчёте на P2O5. В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40-55 % и даже до 70 % P2O5.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья.
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Безопасность
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
|
Неорганические соединения фосфора |
|
|---|---|
| Оксиды |
|
| Фосфорные кислоты |
|
| Соли |
|
| Соединения фосфония |
|
| Прочее |
|
From Wikipedia, the free encyclopedia
This article is about orthophosphoric acid. For other acids commonly called “phosphoric acid”, see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 42.35 °C (108.23 °F; 315.50 K) anhydrous[12] 29.32 °C (84.78 °F; 302.47 K) hemihydrate[13] |
|
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[14] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [15] [15]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[15] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[15] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[16] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[17]
The name “orthophosphoric acid” can be used to distinguish this specific acid from other “phosphoric acids”, such as pyrophosphoric acid. Nevertheless, the term “phosphoric acid” often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[18][19][20]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[21]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[22]
Properties[edit]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Eutectic system[edit]
The phase diagram of the H3PO4·H2O system is complicated. Solutions up to 62.5% H3PO4 are eutectic, exhibiting freezing-point depression as low as -85°C. Beyond this freezing-point increases, reaching 21°C by 85% H3PO4 (w/w) and a local maximum at 91.6% which corresponds to the hemihydrate 2H3PO4•H2O, freezing at 29.32°C.[23][24] There is a second smaller eutectic depression at a concentration of 94.75% with a freezing point of 23.5°C. At higher concentrations the freezing point rapidly increases.
Concentrated phosphoric acid tends to supercool before crystallization occurs, and may be relatively resistant to crystallisation even when stored below the freezing point.[13] For many industrial uses 85% represents a practical upper limit, where higher concentrations risk the entire mass freezing solid when transported inside of tankers and having to be melted out, although partial crystallisation can still occur in sub-zero temperatures.
Self condensation[edit]
Phosphoric acid is commercially available as aqueous solutions of various concentrations, not usually exceeding 85%. If concentrated further it undergoes slow self-condensation, forming an equilibrium with pyrophosphoric acid:
- 2 H3PO4 ⇌ H2O + H4P2O7
Even at 90% concentration the amount of pyrophosphoric acid present is negligible, but beyond 95% it starts to increase, reaching 15% at what would have otherwise been 100% orthophosphoric acid.[25]
As the concentration is increased higher acids are formed, culminating in the formation of polyphosphoric acids.[26] It is not possible to fully dehydrate phosphoric acid to phosphorus pentoxide, instead the polyphosphoric acid becomes increasingly polymeric and viscous. Due to the self-condensation, pure orthophosphoric acid can only be obtained by a careful fractional freezing/melting process.[13][12]
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[27]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[28]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[29] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[30] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[31]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[32]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[33]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[34]
- in microfabrication to etch aluminium
- as a pH adjuster in cosmetics and skin-care products[35]
- as a sanitizing agent in the dairy, food, and brewing industries[36]
Phosphoric acid may also be used for chemical polishing (etching) of metals like aluminium or for passivation of steel products in a process called phosphatization.[37]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[38]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[39]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). “Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C”. Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ “CAMEO Chemicals Datasheet – Phosphoric Acid”. Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ “Phosphoric acid”. www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). “Vapor Pressure of Phosphoric Acids”. Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ Haynes, p. 4.80
- ^ “phosphoric acid_msds”. Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. “#0506”. National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). “Refractive Index of Phosphoric Acid Solutions at 25 C.”. J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ a b Greenwood, N. N.; Thompson, A. (1959). “701. The mechanism of electrical conduction in fused phosphoric and trideuterophosphoric acids”. Journal of the Chemical Society (Resumed): 3485. doi:10.1039/JR9590003485.
- ^ a b c Ross, Wm. H.; Jones, R. M.; Durgin, C. B. (October 1925). “The Purification of Phosphoric Acid by Crystallization”. Industrial & Engineering Chemistry. 17 (10): 1081–1083. doi:10.1021/ie50190a031. ISSN 0019-7866.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ “Phosphoric acid”. Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). “Why nature chose phosphates”. Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Gilmour, Rodney (2014). Phosphoric acid: purification, uses, technology, and economics. Boca Raton: CRC Press. pp. 44–61. ISBN 9781439895108.
- ^ Jupp, Andrew R.; Beijer, Steven; Narain, Ganesha C.; Schipper, Willem; Slootweg, J. Chris (2021). “Phosphorus recovery and recycling – closing the loop”. Chemical Society Reviews. 50 (1): 87–101. doi:10.1039/D0CS01150A. PMID 33210686.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). “Let’s Make White Phosphorus Obsolete”. ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Ross, William H.; Jones, Russell M. (August 1925). “The Solubility and Freezing-Point Curves of Hydrated and Anhydrous Orthophosphoric Acid”. Journal of the American Chemical Society. 47 (8): 2165–2170. doi:10.1021/ja01685a015.
- ^ “Purified Phosphoric Acid H3PO4 Technical Information Bulletin” (PDF). PotashCorp. Retrieved 11 February 2023.
- ^ Korte, Carsten; Conti, Fosca; Wackerl, Jürgen; Lehnert, Werner (2016), Li, Qingfeng; Aili, David; Hjuler, Hans Aage; Jensen, Jens Oluf (eds.), “Phosphoric Acid and its Interactions with Polybenzimidazole-Type Polymers”, High Temperature Polymer Electrolyte Membrane Fuel Cells, Cham: Springer International Publishing, pp. 169–194, doi:10.1007/978-3-319-17082-4_8, ISBN 978-3-319-17081-7, retrieved 12 February 2023
- ^ Jameson, R. F. (1 January 1959). “151. The composition of the “strong” phosphoric acids”. Journal of the Chemical Society (Resumed): 752–759. doi:10.1039/JR9590000752.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). “Phosphoric Acid and Phosphates”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ “Current EU approved additives and their E Numbers”. Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ “Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB”. www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). “Dietary advice in dental practice”. British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). “Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians”. Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). “Production of activated carbons from a washington lignite using phosphoric acid activation”. Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ “Ingredient dictionary: P”. Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ “Star San” (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ “Phosphates – Metal Finishing” (PDF). Phospates for Americas. February 2021.
- ^ “Phosphoric Acid, 85 wt.% SDS”. Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). “Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study”. American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards





![{displaystyle {mathsf {H_{3}PO_{4}+12(NH_{4})_{2}MoO_{4}+21HNO_{3}rightarrow [NH_{4}]_{3}PMo_{12}O_{40}cdot 6H_{2}Odownarrow +21NH_{4}NO_{3}+6H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7d4ebe672265107f93332c8398a49c464923f26)






