Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 февраля 2020 года; проверки требуют 11 правок.
| Хлорид серебра(I) | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Хлорид серебра(I) | |
| Традиционные названия | Хлорид серебра | |
| Хим. формула | AgCl | |
| Рац. формула | AgCl | |
| Физические свойства | ||
| Состояние | Твёрдое | |
| Молярная масса | 143,32 г/моль | |
| Плотность | 5,56[1] | |
| Твёрдость | 2,5[2] | |
| Термические свойства | ||
| Температура | ||
| • плавления | 455[1] | |
| • кипения | 1554[3] °C | |
| Мол. теплоёмк. | 50,79[4] Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −127[3] кДж/моль | |
| Удельная теплота испарения | 1,28⋅106[4] | |
| Удельная теплота плавления | 9,2⋅104[4] | |
| Давление пара | 1 Па[6], 10 Па[6], 100 Па[6], 1 кПа[6], 10 кПа[6] и 100 кПа[6] | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 1,91⋅10−5 г/100 мл | |
| • в этаноле | 1,5·10−5 г/л | |
| • в метаноле | 6·10−5 г/л | |
| • в ацетоне | 1,3·10−5 г/л | |
| • в пиридине[5] | 19,5 г/л | |
| Оптические свойства | ||
| Показатель преломления | 2,071[2] | |
| Структура | ||
| Дипольный момент | 6,08 ± 0,06 Д[7] | |
| Классификация | ||
| Рег. номер CAS | 7783-90-6 | |
| PubChem | 24561 | |
| Рег. номер EINECS | 232-033-3 | |
| SMILES |
Cl[Ag] |
|
| InChI |
InChI=1S/Ag.ClH/h;1H/q+1;/p-1 HKZLPVFGJNLROG-UHFFFAOYSA-M |
|
| RTECS | VW3563000 | |
| ChEBI | 30341 | |
| ChemSpider | 22967 | |
| Безопасность | ||
| NFPA 704 |
0 2 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Хлори́д серебра́(I) (хло́ристое серебро́, химическая формула — AgCl) — неорганическая бинарная серебряная соль соляной кислоты.
В нормальных условиях, хлорид серебра — это белый порошок или бесцветные кристаллы.
Встречается в природе в виде минерала хлораргирита.
Молекулярная и кристаллическая структура[править | править код]
Кристаллическая структура AgCl
Хлорид серебра имеет следующий элементный состав: Серебро (Ag) — 75,26 %, хлор (Cl) — 24,74 %. Атом серебра в молекуле находится в состоянии sp3d2-гибридизации.
Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм[8].
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4.
Центральный атом образует с соседями октаэдр, координационное число равно 6[9].
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера[9].
Физические свойства[править | править код]
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро»[10].
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10−10. С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10−8[11]. Нерастворим в минеральных кислотах, этиловом и метиловом спиртах, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке[4][12].
Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
Термодинамические константы:
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль[13];
- Стандартная энтропия, S°298: 96 Дж/(моль·K)[13];
- Стандартная энергия Гиббса, ΔG°298: −110 кДж/моль[13].
- Стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K)[4];
- Энтальпия плавления, ΔHпл: 13,2 кДж/моль [4];
- Энтальпия кипения, ΔHкип: 184 кДж/моль [4].
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением[14]:
Химические свойства[править | править код]
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра[15]:
- Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов[16]:[стр. 233]: :
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении[17]:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах[18]:
Получение[править | править код]
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Применение[править | править код]
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl−;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии[19];
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды[16]:[с. 167]:
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность[править | править код]
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
См. также[править | править код]
- Бромид серебра(I)
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
Примечания[править | править код]
- ↑ 1 2 Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 73. — ISBN 5-7107-8085-5.
- ↑ 1 2 Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 8—9. — ISBN 0-07-049439-8.
- ↑ 1 2 Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 88.
- ↑ 1 2 3 4 5 6 7 [www.xumuk.ru/spravochnik/863.html Серебра хлорид]. Справочник по веществам. XuMuK.ru. Дата обращения: 1 марта 2010.
- ↑ Ю. Ю. Лурье. Справочник по аналитической химии. — М.: Химия, 1979. — С. 88. — 480 с. — 80 000 экз.
- ↑ 1 2 3 4 5 6 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—122, 6—122. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9—65, 9—65. — ISBN 978-1-4987-5428-6
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть III. Глава 5. Энергия и длина связи для двухатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 378. — ISBN 5-7107-8085-5.
- ↑ 1 2 Серебра галогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1995. — Т. 4. — С. 635—636. — ISBN 5-85270-092-4.
- ↑ Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — М.: «Химия», 1981. — С. 591.
- ↑ Произведения растворимости. Новый справочник химика. Химическое равновесие. Свойства растворов. ChemAnalytica.Com (1 апреля 2009). Дата обращения: 4 марта 2010.
- ↑ Таблица неорганических и координационных соединений. Новый справочник химика. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.Com (31 марта 2009). Дата обращения: 4 марта 2010.
- ↑ 1 2 3 Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть IV. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 440. — ISBN 5-7107-8085-5.
- ↑ Silver Chloride. Phase change data (англ.). NIST Chemistry WebBook. National Institute of Standads and Technology. Дата обращения: 17 марта 2010. Архивировано 20 апреля 2012 года.
- ↑ Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / 3-е изд., под редакцией Р.А. Лидина. — М.: «Химия», 2000. — С. 296. — ISBN 5-7245-1163-0.
- ↑ 1 2 Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3: Химия переходных элементов. Кн. 2. — 368 с. — ISBN 5-7695-2533-9.
- ↑ Пятницкий И.В., Сухан В.В. Аналитическая химия серебра. — М.: «Наука», 1975. — С. 23.
- ↑ Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 178. — ISBN 5-7695-1436-1.
- ↑ Silver Chloride (AgCl) (англ.). Products. Crystran Ltd. Дата обращения: 18 марта 2010. Архивировано 20 апреля 2012 года.
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Как найти массу выпавшего осадка?
Мастер
(1476),
закрыт
10 лет назад
Алекс- 89
Гений
(85771)
10 лет назад
1. Находим количество вещества NaCl:
20 г : 58,5 г/моль = 0,342 моль.
2. Находим количество вещества AgNO3:
20 г : 186 г/моль = 0,108 моль.
3. Теперь мы видим, что хлорид натрия у нас в избытке. Следовательно, полностью он не прореагирует. Нужно вести расчёты по веществу, которое находится в недостатке, а именно по AgNO3.
4. ню (AgCl) = ню (AgNO3) = 0,108 моль.
5. Находим массу AgCl:
0,108 моль * 143,5 г/моль = 15,498 г = примерно 15,5 г.
Ответ: m (AgCl) = 15,5 г.
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: “Таблицы качественных реакций”
(Правила комментирования)
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
а с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba2+ | SO42- |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| Cu2+ |
1) OH− 2) S2- |
1) Выпадение осадка голубого цвета: Cu2+ + 2OH− = Cu(OH)2↓ 2) Выпадение осадка черного цвета: Cu2+ + S2- = CuS↓ |
| Pb2+ | S2- |
Выпадение осадка черного цвета: Pb2+ + S2- = PbS↓ |
| Ag+ | Cl− |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O: Ag+ + Cl− → AgCl↓ |
| Fe2+ |
1) OH− 2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6] |
1) Выпадение белого осадка, зеленеющего на воздухе: Fe2+ + 2OH− = Fe(OH)2↓ 2) Выпадение синего осадка (турнбулева синь): K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
| Fe3+ |
1) OH− 2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) Роданид-ион SCN− |
1) Выпадение осадка бурого цвета: Fe3+ + 3OH− = Fe(OH)3↓ 2) Выпадение синего осадка (берлинская лазурь): K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ 3) Появление интенсивно-красного (кроваво-красного) окрашивания: Fe3+ + 3SCN− = Fe(SCN)3 |
| Al3+ | Щелочь (амфотерные свойства гидроксида) |
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи: OH− + Al3+ = Al(OH)3 и его растворение при дальнейшем приливании: Al(OH)3 + NaOH = Na[Al(OH)4] |
| NH4+ | OH−, нагрев |
Выделение газа с резким запахом: NH4+ + OH− = NH3↑ + H2O Посинение влажной лакмусовой бумажки |
| H+ (кислая среда) |
Индикаторы: − лакмус − метиловый оранжевый |
Красное окрашивание |
Качественные реакции на анионы
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO42- | Ba2+ |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| NO3− |
1) Добавить H2SO4 (конц.) и Cu, нагреть 2) Смесь H2SO4 + FeSO4 |
1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| PO43- | Ag+ |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
| CrO42- | Ba2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
| S2- | Pb2+ |
Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
| CO32- |
1) Ca2+ 2) H+ |
1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
| CO2 | Известковая вода Ca(OH)2 |
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| SO32- | H+ |
Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
| F− | Ca2+ |
Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
| Cl− | Ag+ |
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.): Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
| Br− | Ag+ | Выпадение светло-желтого осадка, не растворимого в HNO3:
Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
| I− | Ag+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.):
Ag+ + I− = AgI↓ (осадок темнеет на свету) |
| OH− (щелочная среда) |
Индикаторы: — лакмус — фенолфталеин |
— синее окрашивание — малиновое окрашивание |
|
Осадок |
Содержание |
|
|
в
мг |
в |
|
|
Интенсивный хлопьевидный |
>10 |
0,1 |
|
Сильная |
5–10 |
0,01–0,1 |
|
Опалесценция |
1–0,1 |
0,001–,01 |
♦ Опыт
№ 3. Определение сульфат-ионов (SO42-)
В
пробирку налить 1 мл водной вытяжки,
добавить несколько капель HCl
и 1 мл раствора BaCl2,
если осадок сразу не выпадает – нагреть
до кипения и кипятить 1 мин. При наличии
сульфат-ионов (SO42-)
протекает реакция: Ba2+
+ SO42-
= BaSO4↓,
образуется белый мелкокристаллический
осадок. По характеру осадка определить
приблизительное содержание сульфат-ионов
в водной вытяжке и почве (табл. 16).
Таблица
16
Характеристика осадка BaSo4 и содержание сульфат-ионов
|
Осадок |
Содержание |
|
|
в
мг |
в |
|
|
Интенсивный быстрооседающий |
50 |
0,1 |
|
Муть, |
10–1 |
0,01–0,1 |
|
Медленно |
1–0,5 |
0,001–,01 |
♦ Опыт
№ 4. Определение нитрат-ионов (NO3–)
Перенести
в пробирку 1 мл водной вытяжки и добавить
несколько капель раствора дифениламина
в серной кислоте. (Внимание!
С раствором работать осторожно, не
капать на стол и одежду!) При
наличии нитрат-ионов NO3–
раствор окрашивается в синий цвет
различных оттенков и различной
степени устойчивости. Пользуясь данными
табл. 11, определить приблизительное
содержание нитратов в почве.
♦ Опыт
№ 5. Определение ионов железа
(Fe3+)
Поместить
в пробирку 1 мл водной вытяжки, добавить
2–3 капли раствора KSCN.
При наличии ионов (Fe3+)
протекает реакция: Fe3+
+
3SCN–
= Fe(SCN)3,
и раствор окрашивается в красно-коричневый
цвет. По интенсивности окраски качественно
судят о наличии ионов Fe3+:
мало, много, очень много.
♦ Опыт
№ 6. Определение ионов свинца (Pb2+)
Поместить
в пробирку 1 мл водной вытяжки, добавить
несколько капель раствора KJ.
При наличии ионов свинца (Pb2+)
протекает реакция: Pb2+
+ 2J–
= PbJ2↓,
выпадает осадок желтого цвета. По
интенсивности образовавшегося осадка
качественно судят о наличии ионов Pb2+:
мало, много, очень много.
Результаты
опытов представить в виде табл. 17.
Таблица
17
Результаты анализа водной вытяжки почвы
|
Показатель |
рН |
Катионы |
Анионы |
|||
|
Fe2+ |
Pb2+ |
Cl– |
SO42- |
NO3– |
||
|
Количественная
(качественная) |
Сделать
заключение о степени загрязненности
образца почвенного слоя.
2. Экозащитные техники и технологии
2.1. Теоретическая часть
Затраты
на ликвидацию последствий от применения
неэкологичных технологий в десятки раз
превышают затраты, которые потребовались
бы для разработки их экологически чистых
аналогов. Результаты социологического
опроса Института Д. Гэллапа в 22-х наиболее
развитых странах мира показали, что
главными причинами современного
глобального экологического кризиса
являются плохие технологии, бизнес и
индустрия.
Новые
природоохранные и ресурсосберегающие
технологии связаны с инновационно-экологической
деятельностью.
Последняя представляет собой совокупность
научно-технических, производственных
и коммерческих мероприятий, которые
посредством практического использования
идей и изобретений приводят к созданию
и развитию лучших по своим свойствам,
в том числе и экологическим, изделий,
технологий, любых технических и
организационных решений.
В
настоящее время в России экологический
фактор стал занимать достойное место
в инновационном предпринимательстве.
В частности, введена обязательная
государственная экологическая экспертиза
образцов техники и технологий,
обязательная сертификация всех видов
продукции на соответствие экологическим
требованиям, применяются экологические
санкции (штрафы) за использование
экологически опасных технологий и
загрязнение окружающей природной среды
ОПС в сочетании с экологическими
льготами за разработку и внедрение
экозащитных техник и технологий.
Экозащитные
техники и технологии классифицируются
по двум направлениям:
– мероприятиям,
проводимым с целью предотвращения или
снижения негативных воздействий на
ОПС;
– мероприятиям,
направленным на ликвидацию вредных
воздействий на ОПС.
2.1.1.
Техники и технологии, снижающие негативное
воздействие на ОПС
К
техникам и технологиям подобного типа
относятся:
1)
совершенствование технологических
процессов (сгорание, очистка, переработка
отходов и пр.), приводящее к уменьшению
выбросов в окружающую среду, а также
разработка и внедрение малоотходных и
безотходных технологий;
2)
установка очистных сооружений на
газопылевых выбросах или сточных
водах с последующей утилизацией
улавливаемых загрязнителей;
3)
разработка технологий, приводящих к
снижению потребления природных
ресурсов, комплексное использование и
переработка отходов других производств
(изготовление строительных блоков из
золы ТЭС, использование мусора в
качестве топлива для получения горячей
воды и пр.);
4)
устройство санитарно-охранных зон
вокруг промышленных предприятий,
озеленение городов и посёлков;
5)
оптимизация расположения объектов
промышленных предприятий, железнодорожных
и автодорожных магистралей, увеличение
высоты труб котельных и пр. с целью
сведения к минимуму их отрицательного
воздействия на ОПС.
Пример
№ 1.
Обязательная
экологическая паспортизация объектов
и технологий, в том числе и железнодорожного
транспорта. Экологический паспорт
включает:
• описание
технологической схемы производства,
характеристики основных видов
выпускаемой продукции, видов загрязнителей,
попадающих в природные объекты;
• полное
описание и характеристики действующих
очистных сооружений, с определением
эффективности их работы, расчётом
ПДВ (предельно-допустимых выбросов в
атмосферу от отдельных источников)
и ПДС (предельно-допустимых сбросов в
водоемы, на рельеф местности), сведения
о количестве и видах твёрдых отходов
предприятия, а также прогноз
динамики
выбросов и изменения состояния ОПС;
• сведения
о существующих (разрабатываемых) в
стране (мире) технологиях или
мероприятиях, обеспечивающих достижение
наилучших показателей в рассматриваемой
области охраны ОПС;
• перечень
планируемых мероприятий, направленных
на снижение антропогенной нагрузки
на ОПС данным предприятием, с указанием
сроков их выполнения, объёмов затрат,
удельных и общих объёмов выбросов, до
и после выполнения каждого мероприятия.
Пример
№ 2.
Разработка и внедрение малоотходных
или безотходных производств, обеспечивающих
круговорот сырья, отходов производства,
или их полную утилизацию (рис. 4). Подобные
технологии разрабатываются по
принципам, заимствованным из природы:
отходы одних организмов являются
ресурсом существования для других.
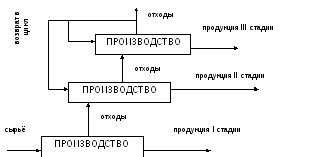
Рис.
4. Принципиальная схема безотходных и
малоотходных технологий
Примеры
подобных технологий.
1.
Зола ТЭС используется как сырье в
производстве строительных блоков,
для мощения дорог, в качестве основного
и вспомогательного реагента для
сорбционной и коагуляционной очистки
сточных вод.
2.
Полные и локальные
круговороты
воды при очистке сточных вод, позволяющие
снизить объём потребляемой свежей воды,
а также расходы реагентов внутри
предприятия (циклы водооборота на
моечных машинах в локомотивных и вагонных
депо и пр.).
3.
Доокисление токсичных компонентов
выхлопных газов в дизельных установках
(тепловозные дизели). Угарный газ (CO),
несгоревшие углеводороды (CnHm)
окисляются в избытке воздуха до СО2
и Н2О,
для увеличения скорости процесс
осуществляется на катализаторах: CuO,
Cr2O3,
MnO2,
CoO,
Pt,
Pd:
CnHm
+ gO2
nCO2
+ m/2 H2O.
Взаимная
нейтрализация токсичных компонентов
выхлопных газов двигателей внутреннего
сгорания на катализаторе: металлическая
вата из нержавеющей стали или сплавов
никеля:
2NO
+ 2CO
N2
+ 2CO2
+ 690 кДж.
2.1.2.
Техники и технологии, ликвидирующие
последствия
негативного
воздействия на ОПС
К
мероприятиям подобного типа относятся
следующие:
1)
биологическая чистка почвы и воды
водоёмов от нефтепродуктов с применением
различных биопрепаратов (путидойл и
пр.);
2)
глубокая доочистка сточных вод
биологическими методами в естественных
условиях, при этом применяются два типа
процессов: аэробные
(микроорганизмы и кислород) и анаэробные
(только микроорганизмы, без кислорода);
3)
очистка русла реки механическим,
химическим, биологическим способами
при антропогенном эфтрофировании
водоемов;
4)
создание полигонов твёрдых отходов,
переработка отходов термическим,
физико-химическим, биотехнологическими
(компостирование, сбраживание и пр.)
методами.
Пример:
доочистка
сточных вод в естественных условиях.
В этих процессах принимают участие
сложные ассоциаты живых организмов:
бактерии, одноклеточные организмы,
микроорганизмы, высшая водная
растительность (ботанические площадки,
биопруды с посадками, искусственные
болота). Часто при доочистке сточных
вод применяются последовательно как
анаэробный, так и аэробный методы.
Загрязнённые
сточные воды поступают в пруды-накопители,
где происходит первая стадия анаэробной
очистки, т. е. бескислородное окисление
с участием особых бактерий – анаэробов:
CxHуOzN
+ H2OСH4
+ CO + C5H7NO2
+ NH4+
+ HCO3–.
Остаточные
загрязнители
Образуются
и другие продукты распада органических
веществ: NO2–,
CO2,
N2,
OH–.
Далее
в естественных условиях в биологических
прудах, на полях орошения или
биофильтрах протекает аэробный процесс
окисления с участием микроорганизмов
и кислорода:
CxHуOzN
+ O2xCO2
+ у/2H2O
+ NH3
+ Q.
Контрольные
вопросы
1.
Что подразумевается под
инновационно-экологической деятельностью?
2.
Что понимается под экозащитными техниками
и технологиями?
3.
Перечислите основные техники и технологии,
снижающие негативное воздействие
на ОПС.
4.
Как вы представляете процессы безотходных
и малоотходных технологий?
5.
Перечислите основные техники и технологии,
направленные на ликвидацию последствий
негативного воздействия на ОПС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #






![{displaystyle {mathsf {AgCl+2NH_{3}cdot H_{2}O=[Ag(NH_{3})_{2}]Cl+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec038a662c1aa73f2049b3b309bdfe5e9c02ddf7)
![{displaystyle {mathsf {AgCl+2Na_{2}SO_{3}S=Na_{3}[Ag(SO_{3}S)_{2}]+NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7155220cc5ad3d6c965fac8bca9320214bf14833)
![{displaystyle {mathsf {AgCl+2KCN=K[Ag(CN)_{2}]+KCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/acb56aaf4100af6c43720143f546d1041007d03b)





![{displaystyle {mathsf {AgCl+Cl^{-}=[AgCl_{2}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78c1b767d0f9ed85706a3a7f5686ffed3fcda8f4)