Как найти массу осадка
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?

Инструкция
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммов осадка образовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Источники:
- как найти массу осадка в растворе
- Вычисление молярной массы эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание
- Вычисление массовой доли вещества в растворе.
- Вычисление массы раствора.
- Вычисление массы вещества или объёма.
- Как решать задачи на нахождение осадка по химии
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- Задачи на применение условия выпадения осадка
Вычисление массовой доли вещества в растворе.
После пропускания через раствор гидроксида натрия 6,72 л оксида углерода (IV) (н.у.) получили 159 г раствора карбоната натрия. Вычислите массовую долю соли в полученном растворе.
Молярный объём 1 моля любого газа при н.у. = 22,4 л/моль
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
- Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
Молярная масса численно равна относительной молекулярной массе, поэтому её можно найти путём складывания относительных атомных масс элементов с учёт индексов
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или молярные
объёмы под формулами веществ
Vm =22,4 л/моль M =106 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
Vm =22,4 л/моль M =106 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим массу
Записываем ответ: w (Na2CO3) = 20%
Вычисление массы раствора.
- Внимательно читаем условия задачи.
Массовую долю из процентов переводим в целое число, разделив на 100.
К раствору с массовой долей гидроксида калия 3% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 5,3 г. Определите массу исходного раствора щёлочи.
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
Молярную массу или молярный объём находим с учётом коэффициента перед формулой
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём. Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или
молярные объёмы под формулами веществ
M =112 г/моль M =98 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массу раствора, то над веществом пишем массу и находим её.
M =112 г/моль M =98 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим массу
- Находим массу раствора по формуле
Записываем ответ: m(KOH) = 200 г.
Вычисление массы вещества или объёма.
- Внимательно читаем условия задачи.
Вычислите массу осадка, который образуется при действии раствора нитрата серебра на 117 г 30 %-ного раствора хлорида меди (II).
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
Относительную атомную массу хлора принято считать равной 35,5, у остальных элементов она округляется до целого числа.
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
- Подписываем молярные массы или
молярные объёмы под формулами веществ
M =135г/моль М=287г/моль
- Если по условию задачи дан раствор и массовая доля, то находим массу вещества
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти.
- =35,1 г. m -?
M =135г/моль М=287г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим ответ
Источник
Как решать задачи на нахождение осадка по химии
Ключевые слова конспекта: задачи на количества исходных веществ, задачи на количества продуктов реакции,
По химическим уравнениям можно рассчитать количество вещества, массу и объем реагирующих веществ и продуктов реакции. Для этого прежде всего необходимо составить уравнение химической реакции и верно расставить коэффициенты.
Расчеты по химическим уравнениям удобнее всего вести с использованием количеств веществ реагирующих и образующихся веществ. Количества вещества соединений, вступающих в химическую реакцию и образующихся в ее результате, пропорциональны друг другу и относятся друг к другу как коэффициенты перед формулами этих веществ в количественном уравнении. Например, реакции, которая описывается уравнением 2Fe + 3Сl2 = 2FeCl3, соответствует следующее соотношение между количествами веществ железа, хлора и хлорида железа (III):
v(Fe) : v(Cl2): v(FeCl3) = 2 : 3 : 2.
Таким образом, зная количество вещества одного из реагирующих веществ или продуктов реакции, можно найти количества вещества других участников данной реакции, а по количеству вещества нетрудно рассчитать их массу или объем.
Следует отметить, что объемы вступивших в реакцию газообразных веществ и объемы газообразных продуктов реакции, измеренные при одинаковых условиях, также относятся друг к другу, как коэффициенты перед соответствующими формулами в уравнении химической реакции. Например, в реакции, уравнение которой 3Н2 + N2 = 2NH3, объемы реагирующих азота и водорода и объем образовавшегося аммиака связаны следующим соотношением:
V(Н2): F(N2): F(NH3) = 3:2:1.
Однако эти соотношения выполняются только между веществами, участвующими в одной и той же химической реакции. Если реагент участвует в двух параллельных реакциях, то его количества веществ в этих реакциях никак не связаны друг с другом и могут находиться в любых соотношениях.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Какой объем кислорода (н. у.) потребуется для сжигания 22,4 г серы?
Ответ. V(O2) = 15,68 л.
Задача № 2. Какую массу оксида фосфора (V) требуется растворить в воде для получения 117,6 г фосфорной кислоты?
Ответ. m(Р2O5) = 85,2 г.
Задача № 3. Вычислите массу осадка, образующегося при добавлении 100 мл 10%-ного раствора хлорида меди (II) (р = 1,08 г/мл) к избытку раствора гидроксида калия.
Ответ. m(Cu(OH)2) = 7,84 г.
Задача № 4. Какой объем соляной кислоты с массовой долей НС1 20% (р = 1,1 г/мл) потребуется для растворения 42,5 г оксида алюминия, содержащего 4% примесей?
Ответ. Vp-pa(HCl) = 398,2 мл.
Задача № 5. Какой объем хлора (н. у.) прореагирует с 112 г смеси железа и меди, массовая доля железа в которой 65% ?
Ответ. V(C12) = 57,34 л.
Задача № 6. 80 г смеси оксидов железа (II) и (III) восстановили водородом. Вычислите массу образовавшегося металла, если массовая доля оксида железа (III) в исходной смеси равна 70%.
О т в е т. m(Fe) = 57,68 г.
Задача № 7. Газ, образовавшийся при сгорании 18,6 г угля в избытке кислорода, пропустили через избыток раствора гидроксида кальция. Какова масса образовавшегося при этом осадка?
Ответ. m(CaCO3) = 155 г.
Задача № 8. Смесь оксида и сульфида цинка массой 114,9 г обработали избытком соляной кислоты. При этом выделилось 13,44 л (н. у.) газа. Определите массовую долю оксида цинка в смеси (в %).
Ответ. ω(ZnO) = 49,3%.
Задача № 9. На растворение смеси оксида и карбоната магния было затрачено 520,65 мл 15%-ного раствора хлороводорода (р = 1,075 г/мл). При этом выделилось 8,96 л (н. у.) газа. Какова масса исходной смеси?
Ответ. m(смеси) = 63,6 г.
Задача № 10. При взаимодействии 200 г раствора, содержащего карбонаты натрия и аммония, с избытком раствора гидроксида калия выделяется 6,72 л газа (н. у.), а при взаимодействии такой же массы раствора солей с избытком соляной кислоты — 8,96 л газа (н. у.). Вычислите массовые доли каждой из солей в растворе.
Ответ. ω((NH4)2CO3) = 7,2%, ω(Na2CO3) = 13,25%.
Задачи на количества исходных веществ и продуктов реакции (ответы и решения). Выберите дальнейшие действия:
Источник
Задачи на применение условия выпадения осадка
Задачи на условия выпадения осадка бывают двух типов. В задачах № 19–21 необходимо рассчитать концентрацию ионов, при которой происходит образование осадка, а в задачах № 22–29 – установить, будет ли выпадать осадок при определенных концентрациях ионов.
Пример 4 поможет Вам при решении задач № 20–21.
Пример 4. При какой молярной концентрации хромата натрия начнется выпадение осадка из 0,001 М раствора нитрата свинца?
Решение. Составим уравнения диссоциации хромата натрия и нитрата свинца:
Na2CrO4 → 2Na + +
Pb(NO3)2 → Pb 2+ + 2
Следовательно, молярные концентрации ионов Pb 2+ и 
Составим уравнение диссоциации хромата свинца:
PbCrO4↓D Pb 2+ +


Следовательно, [ 



При решении задач № 20–21 необходимо рассчитать концентрацию осадителя, при которой начнется образование каждого осадка, а затем сравнить их между собой.
При решении задачи № 19 нужно решить систему уравнений для ПР двух малорастворимых соединений и определить отношение концентраций ионов.
Пример 5 поможет Вам при решении задач № 22–29.
Пример 5. Выпадет ли осадок при сливании 100 мл фильтрата, оставшегося от осаждения иодида свинца, с 200 мл 0,1 М раствора хромата натрия?
Решение. 
Химическое равновесие в насыщенном растворе PbI2 описывается уравнением
Если растворимость PbI2 равна x моль/л, то [Pb 2+ ] = x моль/л, а
[I – ] = 2x моль/л. Следовательно,

x = 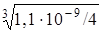
После сливания растворов объем составит
V = 100 + 200 = 300 мл,
а концентрация ионов Pb 2+ уменьшится:

Соответственно, уменьшится и концентрация иона 

Для ответа на вопрос о возможности выпадения осадка найдем произведение концентраций (ПС) ионов Pb 2+ и 

ПС = 2,17 ∙ 10 –4 ∙ 0,067 = 1,45 ∙ 10 –5 > 1,8 ∙ 10 –14 .
Следовательно, осадок выпадет.
Расчет растворимости осадков в присутствии
Одноименных ионов
Пример 6 поможет Вам при решении задач № 30–43.
Пример 6. Вычислить концентрацию ионов серебра в насыщенном растворе хлорида серебра, к 1 л которого прибавлено:
а) 1 ∙ 10 –4 моля КС1; б) 0,1 моля KCl.
a) Хлорид-ионы образуются при диссоциации хлорида серебра и при диссоциации хлорида калия. Тогда будем иметь:
Так как [Ag + ] = [Cl – ]AgCl, то
[Ag + ] 2 + [С1 – ]КСl ∙ [Аg + ] – 1,56 ∙ 10 –10 = 0
Подставляя значение концентрации КСl и решая квадратное уравнение, получим:
[Ag + ] = –10 –4 /2 + 
б) В данном случае значение [С1 – ]КС1 существенно превышает величину [Cl – ]AgCl, поэтому величиной [Cl – ]AgCl можно пренебречь. Тогда будем иметь
Расчет растворимости осадка в присутствии
Источник
Как найти массу осадка (формула), если известна масса раствора и массовая доля?
Химия 9 класс
Марья Орлова
13 ноября 2018 · 13,3 K
ОтветитьУточнить
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
скрыт(Почему?)
Как вычислить массу осадка
В ходе химической реакции могут образоваться самые разные вещества: газообразные, растворимые, малорастворимые. В последнем случае они выпадают в осадок. Часто возникает необходимость узнать, какова точная масса образовавшегося осадка. Каким образом это можно вычислить?
Можете действовать опытным путем. То есть, проведите химическую реакцию, тщательно отделите образовавшийся осадок от фильтрата с помощью обычной стеклянной воронки и бумажного фильтра, например. Более полное отделение достигается с помощью вакуумной фильтрации (на воронке Бюхнера).
После этого осадок высушите – естественным путем или под вакуумом, и взвесьте с возможно большей точностью. Лучше всего, на чувствительных лабораторных весах. Вот так будет решена поставленная задача. К этому методу прибегают, когда неизвестны точные количества исходных веществ, вступивших в реакцию.
Если же вам известны эти количества, тогда задачу можно решить гораздо проще и быстрее. Предположим, необходимо вычислить, сколько хлористого серебра образовалось при взаимодействии 20 грамм хлористого натрия – поваренной соли – и 17 грамм азотнокислого серебра.Прежде всего, напишите уравнение реакции:NaCl+AgNO3 = NaNO3 + AgCl.
В ходе этой реакции образуется очень мало растворимое соединение – хлорид серебра, выпадающий в виде белого осадка.
Подсчитайте молярные массы исходных веществ. Для хлористого натрия она примерно составляет 58,5 г/моль, для азотнокислого серебра – 170 г/моль. То есть, изначально по условиям задачи вы имели 20/58,5 = 0,342 моля хлористого натрия и 17/170 = 0,1 моля азотнокислого серебра.
Таким образом, получается, что хлористый натрий изначально был взят в избытке, то есть, реакция по второму исходному веществу пройдет до конца (прореагируют все 0,1 моля азотнокислого серебра, «связав» те же 0,1 моля поваренной соли). Сколько же образуется хлористого серебра? Для ответа на этот вопрос, найдите молекулярную массу образовавшегося осадка: 108 + 35,5 = 143,5. Умножив изначальное количество азотнокислого серебра (17 грамм) на соотношение молекулярных масс продукта и исходного вещества, получите ответ: 17* 143,5/170 = 14,3 грамма.Вот такова будет точная масса осадка, образовавшегося в ходе реакции.
Определение осадка и пример в химии
На чтение 4 мин. Просмотров 170 Опубликовано 27.05.2021
В химии осаждение означает образование нерастворимого соединения либо путем реакции двух солей, либо путем изменения температуры, чтобы повлиять на растворимость соединения. Кроме того, «осадок» – это название твердого вещества, которое образуется в результате реакции осаждения.
Осаждение может указывать на то, что произошла химическая реакция. , но это также может произойти, если концентрация растворенного вещества превышает его растворимость. Осаждению предшествует событие, называемое зародышеобразованием, когда небольшие нерастворимые частицы объединяются друг с другом или образуют границу раздела с поверхностью, такой как стенка контейнера или затравочный кристалл.
Содержание
- Ключевые выводы: определение осадка в химии
- Precipitate vs Precipitant
- Пример осаждения
- Использование осадков
- Как извлечь осадок
- Преципитатное старение или переваривание
- Источники
Ключевые выводы: определение осадка в химии
- В химии осадок – это и глагол, и существительное .
- Осаждение означает образование нерастворимого соединения либо за счет уменьшения растворимости соединения, либо за счет реакции двух солевых растворов.
- Твердое вещество, которое образуется в результате осаждения. Реакция называется осадком.
- Реакции осаждения выполняют важные функции. Они используются для очистки, удаления или извлечения солей, для изготовления пигментов и для определения веществ при качественном анализе.
Precipitate vs Precipitant
Терминология может показаться немного запутанной. Вот как это работает: образование твердого вещества из раствора называется осаждением . Химическое вещество, которое вызывает образование твердого вещества в жидком растворе, называется осадителем . Образовавшееся твердое вещество называется осадком . Если размер частиц нерастворимого соединения очень мал или сила тяжести недостаточна для притягивания твердого вещества ко дну контейнера, осадок может быть равномерно распределен по жидкости, образуя суспензию . Осаждение относится к любой процедуре, которая отделяет осадок от жидкой части раствора, которая называется супернатантом . Распространенным методом осаждения является центрифугирование. После извлечения осадка полученный порошок можно назвать «цветком».
Пример осаждения
Смешивание серебра нитрат и хлорид натрия в воде вызовут выпадение хлорида серебра из раствора в виде твердого вещества. В этом примере осадок представляет собой хлорид серебра.
При написании химической реакции присутствие осадка может быть указано стрелкой по химической формуле. направленный вниз:
Ag + + Cl – → AgCl ↓
Использование осадков
Осадки могут использоваться для идентификации катиона или аниона в соли в рамках качественного анализа. В частности, известно, что переходные металлы образуют осадки разного цвета в зависимости от их элементной идентичности и степени окисления.. Реакции осаждения используются для удаления солей из воды, выделения продуктов и приготовления пигментов. В контролируемых условиях реакция осаждения дает чистые кристаллы осадка. В металлургии осаждение используется для упрочнения сплавов.
Как извлечь осадок
Есть несколько методов, используемых для восстановления осадок:
Фильтрация : при фильтрации раствор, содержащий осадок, выливается через фильтр. В идеале осадок остается на фильтре, а жидкость проходит через него. Контейнер можно промыть и вылить на фильтр для облегчения восстановления. Всегда наблюдается некоторая потеря осадка, которая может быть вызвана растворением в жидкости, прохождением через фильтр или прилипанием к фильтрующей среде.
Центрифугирование : при центрифугировании раствор быстро вращается. Чтобы техника работала, твердый осадок должен быть плотнее жидкости. Уплотненный осадок, называемый гранулой, может быть получен путем слива жидкости. Обычно при центригации потери меньше, чем при фильтрации. Центрифугирование хорошо работает с небольшими размерами образцов.
Декантация : при декантации слой жидкости сливается или отсасывается от осадок. В некоторых случаях для отделения раствора от осадка добавляют дополнительный растворитель. Декантацию можно использовать для всего раствора или после центрифугирования.
Преципитатное старение или переваривание
Процесс, называемый преципитатным старением или перевариванием происходит, когда в растворе остается свежий осадок. Обычно температура раствора повышается. В результате пищеварения могут образовываться более крупные частицы с более высокой чистотой. Процесс, который приводит к этому результату, известен как созревание Оствальда.
Источники
- Адлер, Алан Д .; Лонго, Фредерик Р .; Кампас, Франк; Ким, Жан (1970). «О препарате металлопорфиринов». Журнал неорганической и ядерной химии . 32 (7): 2443. DOI: 10.1016/0022-1902 (70) 80535-8
- Дхара, С. (2007). «Формирование, динамика и характеристика наноструктур с помощью ионно-лучевого облучения». Критические обзоры по твердому телу и материаловедению . 32 (1): 1-50. DOI: 10.1080/10408430601187624
- Зумдал, Стивен С. (2005). Химические принципы (5-е изд.). Нью-Йорк: Хоутон Миффлин. ISBN 0-618-37206-7.






















