Содержание
- Вычисление массовой доли вещества в растворе.
- Вычисление массы раствора.
- Вычисление массы вещества или объёма.
- Как решать задачи на нахождение осадка по химии
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- Задачи на применение условия выпадения осадка
Вычисление массовой доли вещества в растворе.
После пропускания через раствор гидроксида натрия 6,72 л оксида углерода (IV) (н.у.) получили 159 г раствора карбоната натрия. Вычислите массовую долю соли в полученном растворе.
Молярный объём 1 моля любого газа при н.у. = 22,4 л/моль
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
- Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
Молярная масса численно равна относительной молекулярной массе, поэтому её можно найти путём складывания относительных атомных масс элементов с учёт индексов
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или молярные
объёмы под формулами веществ
Vm =22,4 л/моль M =106 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
Vm =22,4 л/моль M =106 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим массу
Записываем ответ: w (Na2CO3) = 20%
Вычисление массы раствора.
- Внимательно читаем условия задачи.
Массовую долю из процентов переводим в целое число, разделив на 100.
К раствору с массовой долей гидроксида калия 3% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 5,3 г. Определите массу исходного раствора щёлочи.
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
Молярную массу или молярный объём находим с учётом коэффициента перед формулой
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём. Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или
молярные объёмы под формулами веществ
M =112 г/моль M =98 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массу раствора, то над веществом пишем массу и находим её.
M =112 г/моль M =98 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим массу
- Находим массу раствора по формуле
Записываем ответ: m(KOH) = 200 г.
Вычисление массы вещества или объёма.
- Внимательно читаем условия задачи.
Вычислите массу осадка, который образуется при действии раствора нитрата серебра на 117 г 30 %-ного раствора хлорида меди (II).
- Составляем молекулярное уравнение.
- Расставляем коэффициенты в уравнении.
- Подчёркиваем вещества, о которых идёт речь.
Относительную атомную массу хлора принято считать равной 35,5, у остальных элементов она округляется до целого числа.
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
- Подписываем молярные массы или
молярные объёмы под формулами веществ
M =135г/моль М=287г/моль
- Если по условию задачи дан раствор и массовая доля, то находим массу вещества
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти.
- =35,1 г. m -?
M =135г/моль М=287г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Подставляем данные и находим ответ
Источник
Как решать задачи на нахождение осадка по химии
Ключевые слова конспекта: задачи на количества исходных веществ, задачи на количества продуктов реакции,
По химическим уравнениям можно рассчитать количество вещества, массу и объем реагирующих веществ и продуктов реакции. Для этого прежде всего необходимо составить уравнение химической реакции и верно расставить коэффициенты.
Расчеты по химическим уравнениям удобнее всего вести с использованием количеств веществ реагирующих и образующихся веществ. Количества вещества соединений, вступающих в химическую реакцию и образующихся в ее результате, пропорциональны друг другу и относятся друг к другу как коэффициенты перед формулами этих веществ в количественном уравнении. Например, реакции, которая описывается уравнением 2Fe + 3Сl2 = 2FeCl3, соответствует следующее соотношение между количествами веществ железа, хлора и хлорида железа (III):
v(Fe) : v(Cl2): v(FeCl3) = 2 : 3 : 2.
Таким образом, зная количество вещества одного из реагирующих веществ или продуктов реакции, можно найти количества вещества других участников данной реакции, а по количеству вещества нетрудно рассчитать их массу или объем.
Следует отметить, что объемы вступивших в реакцию газообразных веществ и объемы газообразных продуктов реакции, измеренные при одинаковых условиях, также относятся друг к другу, как коэффициенты перед соответствующими формулами в уравнении химической реакции. Например, в реакции, уравнение которой 3Н2 + N2 = 2NH3, объемы реагирующих азота и водорода и объем образовавшегося аммиака связаны следующим соотношением:
V(Н2): F(N2): F(NH3) = 3:2:1.
Однако эти соотношения выполняются только между веществами, участвующими в одной и той же химической реакции. Если реагент участвует в двух параллельных реакциях, то его количества веществ в этих реакциях никак не связаны друг с другом и могут находиться в любых соотношениях.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Какой объем кислорода (н. у.) потребуется для сжигания 22,4 г серы?
Ответ. V(O2) = 15,68 л.
Задача № 2. Какую массу оксида фосфора (V) требуется растворить в воде для получения 117,6 г фосфорной кислоты?
Ответ. m(Р2O5) = 85,2 г.
Задача № 3. Вычислите массу осадка, образующегося при добавлении 100 мл 10%-ного раствора хлорида меди (II) (р = 1,08 г/мл) к избытку раствора гидроксида калия.
Ответ. m(Cu(OH)2) = 7,84 г.
Задача № 4. Какой объем соляной кислоты с массовой долей НС1 20% (р = 1,1 г/мл) потребуется для растворения 42,5 г оксида алюминия, содержащего 4% примесей?
Ответ. Vp-pa(HCl) = 398,2 мл.
Задача № 5. Какой объем хлора (н. у.) прореагирует с 112 г смеси железа и меди, массовая доля железа в которой 65% ?
Ответ. V(C12) = 57,34 л.
Задача № 6. 80 г смеси оксидов железа (II) и (III) восстановили водородом. Вычислите массу образовавшегося металла, если массовая доля оксида железа (III) в исходной смеси равна 70%.
О т в е т. m(Fe) = 57,68 г.
Задача № 7. Газ, образовавшийся при сгорании 18,6 г угля в избытке кислорода, пропустили через избыток раствора гидроксида кальция. Какова масса образовавшегося при этом осадка?
Ответ. m(CaCO3) = 155 г.
Задача № 8. Смесь оксида и сульфида цинка массой 114,9 г обработали избытком соляной кислоты. При этом выделилось 13,44 л (н. у.) газа. Определите массовую долю оксида цинка в смеси (в %).
Ответ. ω(ZnO) = 49,3%.
Задача № 9. На растворение смеси оксида и карбоната магния было затрачено 520,65 мл 15%-ного раствора хлороводорода (р = 1,075 г/мл). При этом выделилось 8,96 л (н. у.) газа. Какова масса исходной смеси?
Ответ. m(смеси) = 63,6 г.
Задача № 10. При взаимодействии 200 г раствора, содержащего карбонаты натрия и аммония, с избытком раствора гидроксида калия выделяется 6,72 л газа (н. у.), а при взаимодействии такой же массы раствора солей с избытком соляной кислоты — 8,96 л газа (н. у.). Вычислите массовые доли каждой из солей в растворе.
Ответ. ω((NH4)2CO3) = 7,2%, ω(Na2CO3) = 13,25%.
Задачи на количества исходных веществ и продуктов реакции (ответы и решения). Выберите дальнейшие действия:
Источник
Задачи на применение условия выпадения осадка
Задачи на условия выпадения осадка бывают двух типов. В задачах № 19–21 необходимо рассчитать концентрацию ионов, при которой происходит образование осадка, а в задачах № 22–29 – установить, будет ли выпадать осадок при определенных концентрациях ионов.
Пример 4 поможет Вам при решении задач № 20–21.
Пример 4. При какой молярной концентрации хромата натрия начнется выпадение осадка из 0,001 М раствора нитрата свинца?
Решение. Составим уравнения диссоциации хромата натрия и нитрата свинца:
Na2CrO4 → 2Na + +
Pb(NO3)2 → Pb 2+ + 2
Следовательно, молярные концентрации ионов Pb 2+ и 
Составим уравнение диссоциации хромата свинца:
PbCrO4↓D Pb 2+ +


Следовательно, [ 



При решении задач № 20–21 необходимо рассчитать концентрацию осадителя, при которой начнется образование каждого осадка, а затем сравнить их между собой.
При решении задачи № 19 нужно решить систему уравнений для ПР двух малорастворимых соединений и определить отношение концентраций ионов.
Пример 5 поможет Вам при решении задач № 22–29.
Пример 5. Выпадет ли осадок при сливании 100 мл фильтрата, оставшегося от осаждения иодида свинца, с 200 мл 0,1 М раствора хромата натрия?
Решение. 
Химическое равновесие в насыщенном растворе PbI2 описывается уравнением
Если растворимость PbI2 равна x моль/л, то [Pb 2+ ] = x моль/л, а
[I – ] = 2x моль/л. Следовательно,

x = 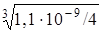
После сливания растворов объем составит
V = 100 + 200 = 300 мл,
а концентрация ионов Pb 2+ уменьшится:

Соответственно, уменьшится и концентрация иона 

Для ответа на вопрос о возможности выпадения осадка найдем произведение концентраций (ПС) ионов Pb 2+ и 

ПС = 2,17 ∙ 10 –4 ∙ 0,067 = 1,45 ∙ 10 –5 > 1,8 ∙ 10 –14 .
Следовательно, осадок выпадет.
Расчет растворимости осадков в присутствии
Одноименных ионов
Пример 6 поможет Вам при решении задач № 30–43.
Пример 6. Вычислить концентрацию ионов серебра в насыщенном растворе хлорида серебра, к 1 л которого прибавлено:
а) 1 ∙ 10 –4 моля КС1; б) 0,1 моля KCl.
a) Хлорид-ионы образуются при диссоциации хлорида серебра и при диссоциации хлорида калия. Тогда будем иметь:
Так как [Ag + ] = [Cl – ]AgCl, то
[Ag + ] 2 + [С1 – ]КСl ∙ [Аg + ] – 1,56 ∙ 10 –10 = 0
Подставляя значение концентрации КСl и решая квадратное уравнение, получим:
[Ag + ] = –10 –4 /2 + 
б) В данном случае значение [С1 – ]КС1 существенно превышает величину [Cl – ]AgCl, поэтому величиной [Cl – ]AgCl можно пренебречь. Тогда будем иметь
Расчет растворимости осадка в присутствии
Источник
Лучший ответ
Глеб
Мастер
(1871)
11 лет назад
не формула, а соединение. Смотрите таблицу растворимости. На пересечении ионов будет буква “Р” – растворим. “Н” – не растворим (ваш осадок) .
Таблица растворимости есть на корке вашего учебника.
Источник: головной мозг
Остальные ответы
юрий дидык
Высший разум
(107342)
11 лет назад
Формула не выпадает в осадок! Выпадает вещество. Определить можно по таблице растворимости
Сельдерея Сельдеревна))
Оракул
(68680)
11 лет назад
Это нуужно в табличку растворимости кислот, солей, оснований смотреть. К тому же, не формулу, а вещество
NiNa Martushova
Искусственный Интеллект
(153334)
11 лет назад
Это я сейчас выпаду в осадок, а не формула.
Как найти массу осадка
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?

Инструкция
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммов осадка образовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Источники:
- как найти массу осадка в растворе
- Вычисление молярной массы эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Качественные реакции
О чем эта статья:
Что такое качественная реакция
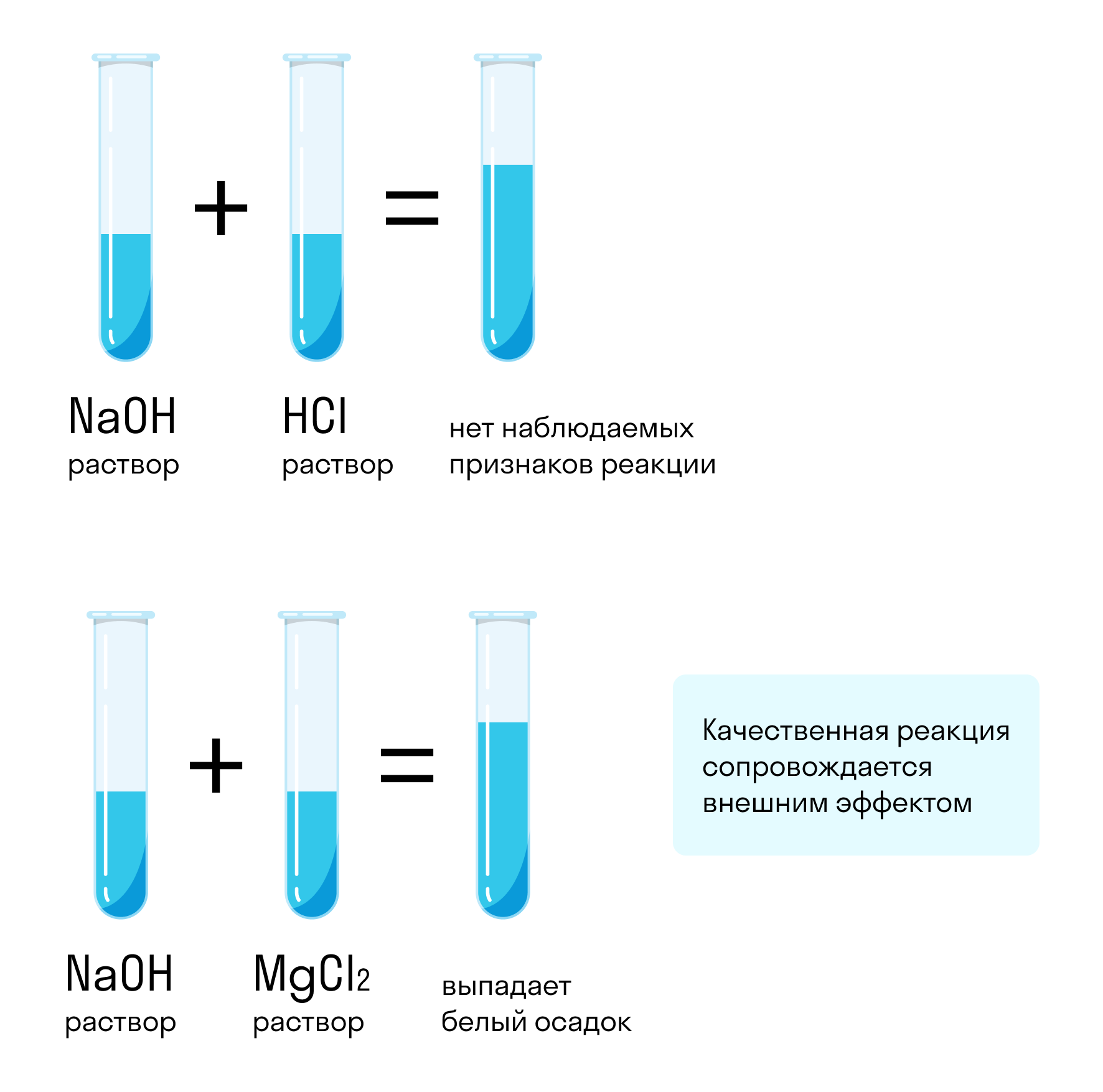
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
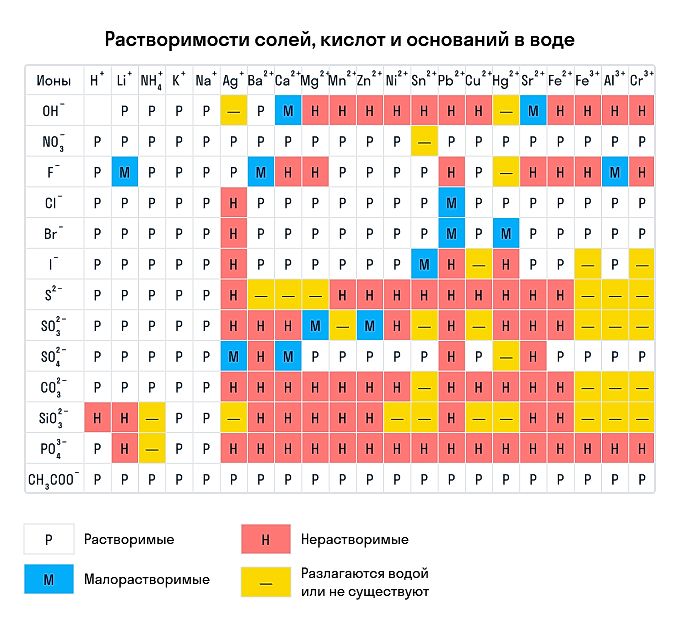
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
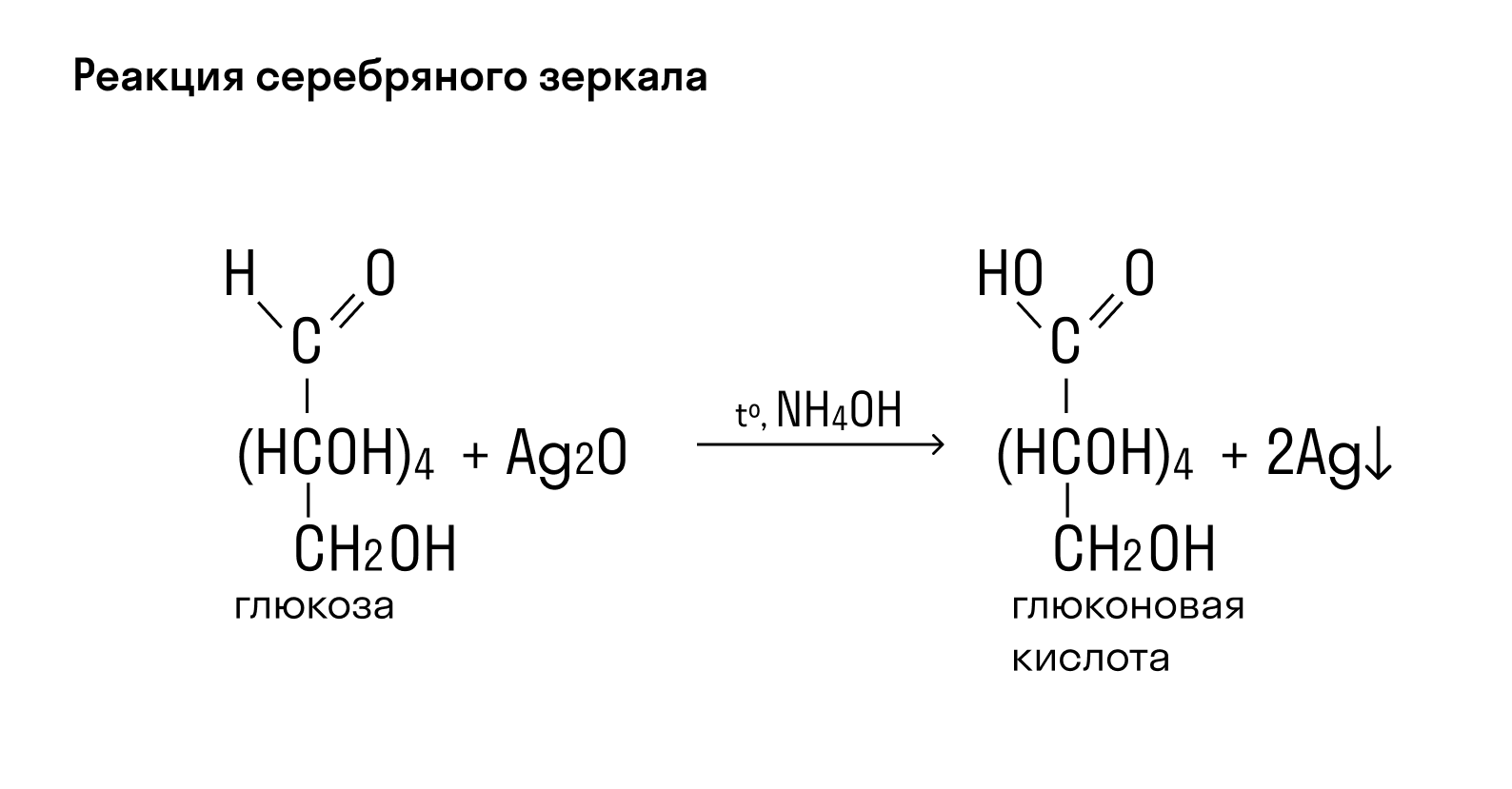
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
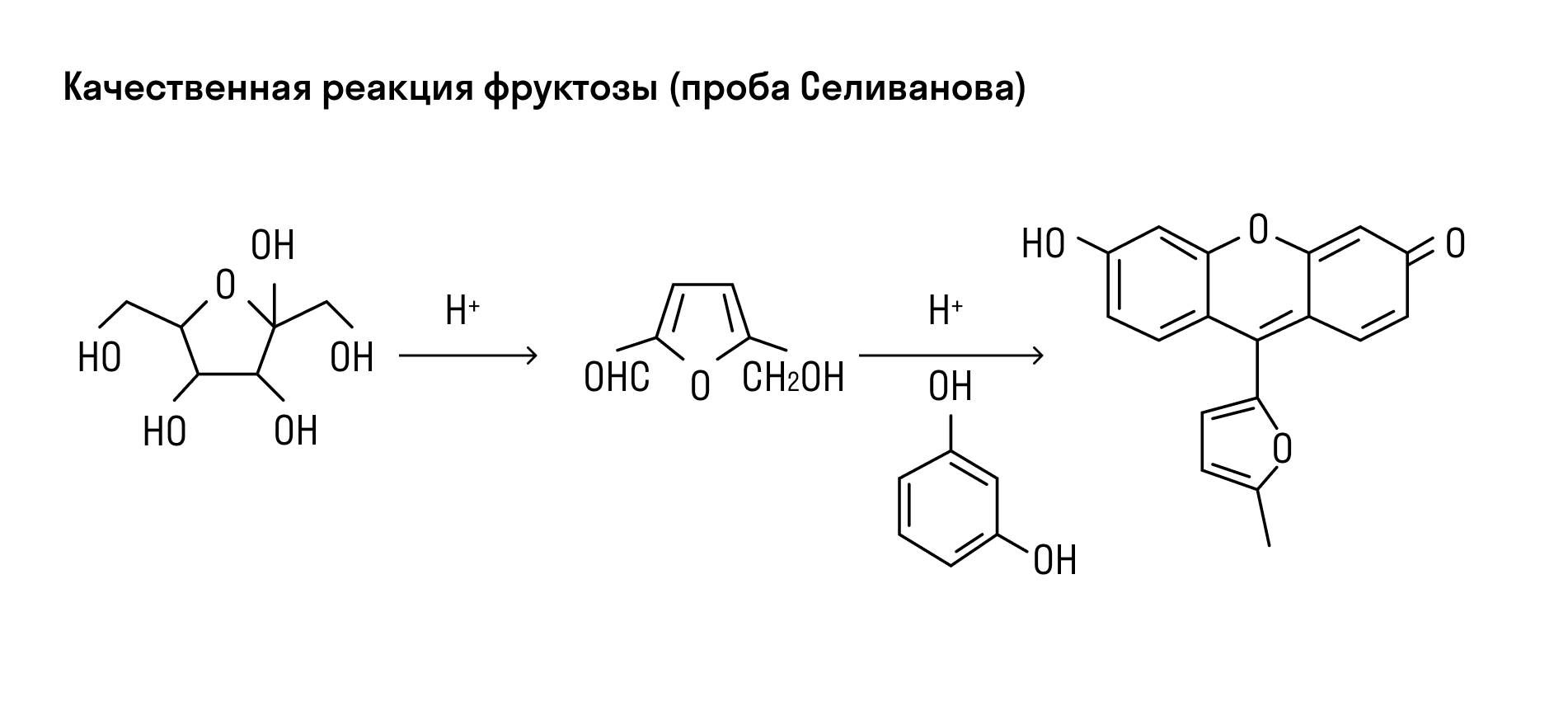
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
Выпадение белого осадка, не растворимого в кислотах:
1) Выпадение осадка голубого цвета:
2) Выпадение осадка черного цвета:
Выпадение осадка черного цвета:
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O:
2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6]
1) Выпадение белого осадка, зеленеющего на воздухе:
2) Выпадение синего осадка (турнбулева синь):
2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6]
3) Роданид-ион SCN −
1) Выпадение осадка бурого цвета:
2) Выпадение синего осадка (берлинская лазурь):
3) Появление интенсивно-красного (кроваво-красного) окрашивания:
Fe 3+ + 3SCN − = Fe(SCN)3
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи:
и его растворение при дальнейшем приливании:
Выделение газа с резким запахом:
Посинение влажной лакмусовой бумажки
| Катион | Реактив | Признак реакции |
| Ba 2+ | SO4 2- | |
| Al 3+ | Щелочь (амфотерные свойства гидроксида) | |
| NH4 + | OH − , нагрев | |
| H + (кислая среда) |
Красное окрашивание |
Качественные реакции на анионы
Выпадение белого осадка, не растворимого в кислотах:
1) Образование раствора синего цвета, содержащего ионы Cu 2+ , выделение газа бурого цвета (NO2)
2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO] 2+ . Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
1) Выпадение белого осадка, растворимого в кислотах:
2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды:
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2:
Выделение газа SO2 с характерным резким запахом (SO2):
Выпадение белого осадка:
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.):
[spoiler title=”источники:”]
http://4ege.ru/gia-po-himii/60744-cveta-osadkov-i-gazov-v-neorganicheskoj-himii.html
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/4-1-4-kachestvennye-reakcii-na-neorganicheskie-veshhestva-i-iony
[/spoiler]
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO4 2- | Ba 2+ | |
| CrO4 2- | Ba 2+ | |
| CO2 | Известковая вода Ca(OH)2 |
Как найти массу осадка (формула), если известна масса раствора и массовая доля?
Химия 9 класс
Марья Орлова
13 ноября 2018 · 13,4 K
ОтветитьУточнить
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
скрыт(Почему?)