Основания


4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.

Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
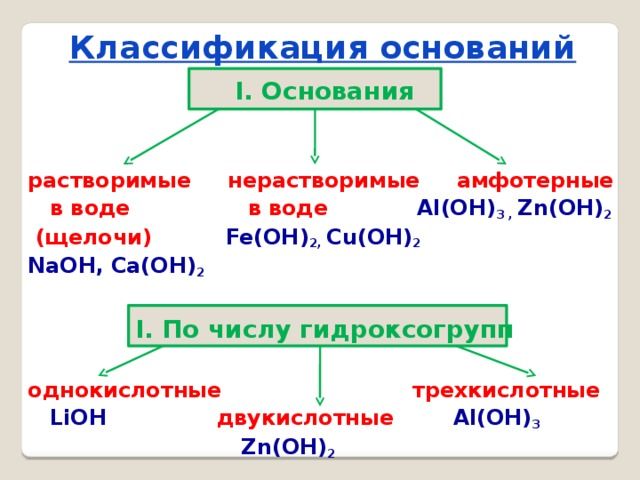
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
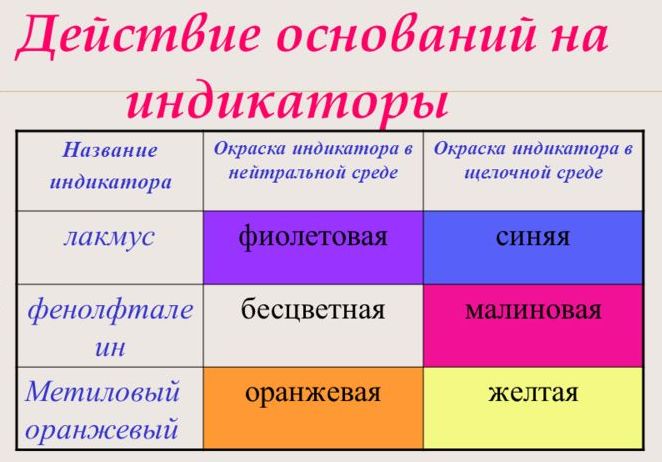
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.

Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Никита Ковалёв
9/10
-

Еркежан Рысова
10/10
-

Александр Котков
10/10
-

Мишлен Громов
10/10
-

Вика Мартынова
10/10
-

Ольга Хромцова
10/10
-

Лилия Швец
10/10
-

Наталья Чернова
10/10
-

Максим Макеев
10/10
-

Сергей Ефремов
8/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
А какая ваша оценка?
В нем металл и кислород,
Да еще плюс водород,
И такое сочетание
Называют основание.
Основания
– это сложные вещества, состоящие из атомов металла и гидроксогруппы. Гидроксогруппа
– это группа ОН.
Степень
окисления О (-2), Н (+1), поэтому суммарный заряд этого иона (1-).
Т.е. гидроксогруппа представляет собой сложный ион, который еще называют гидроксид-ионом.
Состав
оснований можно записать формулой Ме(ОН)n,
где Ме – это металл, а n –
число групп ОН.
Если
заряд иона металла 1+, то с ионом металла связана 1 группа ОН–,
формула таких оснований будет МеОН, а если заряд иона металла 2+, то с
ионом металла связано 2 группы ОН– и формула таких оснований будет Ме(ОН)2
и т.д.
Название
оснований состоит из слова гидроксид + название металла в
родительном падеже. Например, КОН – гидроксид калия, Ва(ОН)2
– гидроксид бария, Al(OH)3
– гидроксид алюминия.
Если
металл проявляет переменную степень окисления, то после
названия в скобках римскими цифрами ставят численное значение степени
окисления. Например: Cu(OH)2
– гидроксид меди (II),
Fe(OH)3
– гидроксид железа (III),
Mn(OH)2
– гидроксид марганца (II).
По
числу гидроксид-ионов основания подразделяют на: однокислотные,
в формулах которых 1 гидроксид-ион (NaOH,
KOH); двукислотные, в формулах
которых 2 гидроксид-иона (Ca(OH)2,
Fe(OH);
многокислотные основания, в которых три и более гидроксид-ионов (Al(OH)3).
По
растворимости в воде основания делятся на растворимые в воде, или щёлочи и
нерастворимые в воде. Растворимыми основаниями являются основания,
образованные металлами I
A группы и
некоторыми металлами II
A группы.
Например, NaOH, Ba(OH)2,
KOH. Растворимые в воде
основания хорошо растворяются в воде, не образуя, осадка, а нерастворимые,
наоборот, выпадают в виде осадка и нерастворимы в воде. Например, Cu(OH)2,
Al(OH)3,
Fe(OH)2.
Для
того чтобы определить растворимо или нерастворимо основание в воде, можно
воспользоваться таблицей растворимости. Если в таблице на пересечении
иона металла и гидроксид-иона стоит буква «Р», значит, это основание
растворимо в воде, если на пересечении стоит буква «М», значит,
основание мало растворимо в воде, а если буква «Н», значит, основание
нерастворимо в воде.
Таблица
растворимости
Рассмотрим
некоторые щёлочи. Одной из наиболее распространённых щелочей является гидроксид
натрия – NaOH.
Это твердое белое вещество, гигроскопично, т.е. поглощает влагу
из воздуха, поэтому оно расплывается на воздухе, хорошо растворимо в воде с
выделением тепла.
Раствор
гидроксида натрия мыльный на ощупь и очень едкий, поэтому
его ещё называют едкий натр. Он разъедает ткани, кожу, бумагу и др. органические
материалы. С гидроксидом натрия и его раствором обращаться нужно осторожно, при
попадании на кожу вызывает долго не заживляющие раны. Гидроксид натрия широко
используется в мыловарении, кожевенной, фармацевтической промышленности,
бумажной и текстильной промышленности. Его техническое название – «каустическая
сода».
Гидроксид
калия – КОН – является тоже твердым белым веществом,
которое хорошо растворимо в воде, при этом выделяется большое количество
теплоты.
Его
раствор мыльный на ощупь и очень едкий, поэтому гидроксид
калия тоже называют едкое кали. Его применяют при производстве мыла и
тугоплавкого стекла.
Гидроксид
кальция Са(ОН)2 называют еще гашёной известью.
Его получают реакцией негашёной извести с водой. Гидроксид кальция представляет
собой рыхлый белый порошок, малорастворимый в воде. Этот гидроксид
используют при кладке и штукатурке стен, побелке деревьев, для получения
хлорной извести.
Прозрачный
раствор гидроксида кальция называют известковой водой.
Если через нее пропустить углекислый газ, то она помутнеет, вследствие
образования нерастворимого карбоната кальция. Эта реакция является качественной
на углекислый газ. Качественные реакции – это реакции, с помощью которых
распознают определенные вещества. Следовательно, углекислый газ распознают
по помутнению известковой воды.
Для
того чтобы определить щёлочи, используют специальные
вещества, которые называют индикаторами. Индикаторы – это вещества,
которые изменяют свою окраску под действием различных веществ. Сравним окраску
индикаторов в нейтральной среде, или в воде и в растворах щелочей.
Наиболее
распространенными индикаторами являются: лакмус, метиловый оранжевый и
фенолфталеин. В нейтральной среде лакмус – фиолетовый, метиловый
оранжевый – оранжевый, фенолфталеин – бесцветный.
Если
мы капнем в щелочь лакмуса, то он станет синим, метиловый
оранжевый – желтым, а фенолфталеин и вовсе станет малиновым. Поэтому c
помощью индикаторов можно отличить щелочи от других классов соединений.
Изменение
окраски индикаторов в зависимости от среды
В (1754) году французский химик Г. Руэль ((1703)–(1770)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.

Гийом Франсуа Руэль
(1703)–(1770)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов (-OH)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
где (M) — знак металлического химического элемента,
а (n) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.
Пример:
— гидроксид железа((II)),
— гидроксид хрома((II)).
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.

|
Примеры: Ca(OH)2
— гидроксид кальция. |
Примеры: Cu(OH)2
— гидроксид меди((II)), Fe(OH)2
— гидроксид железа((II)), Cr(OH)2
— гидроксид хрома. |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
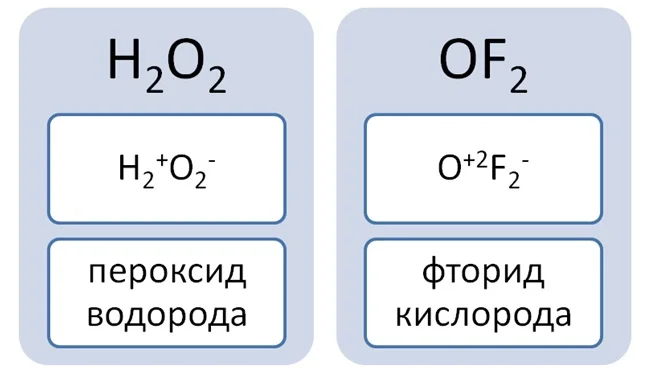
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.

Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.

Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.

Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.

Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции – соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.

Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.


Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.

Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.

В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
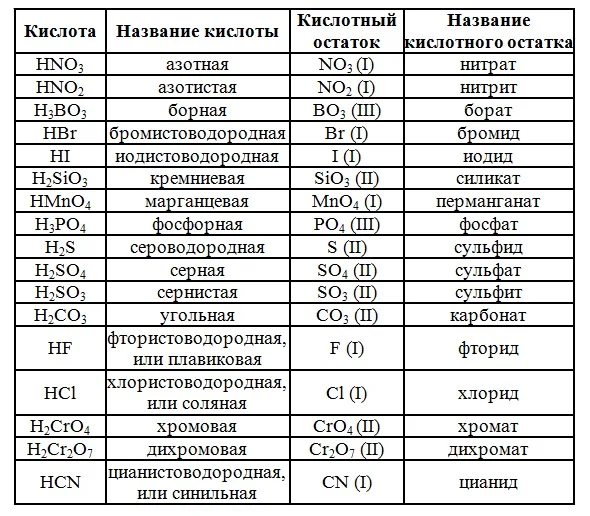
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.

Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.

Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы – ОН.

Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.

Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.

Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.

Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.

Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.

Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.

Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
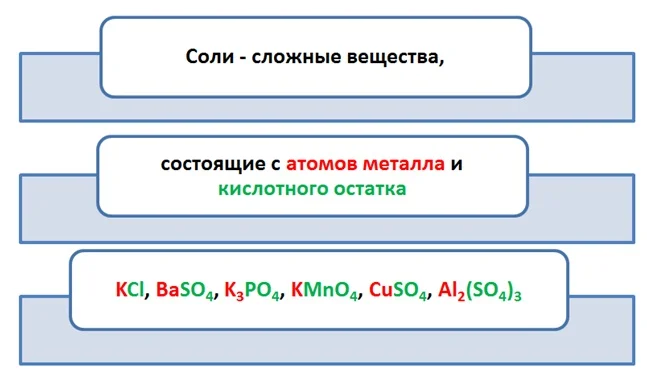
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
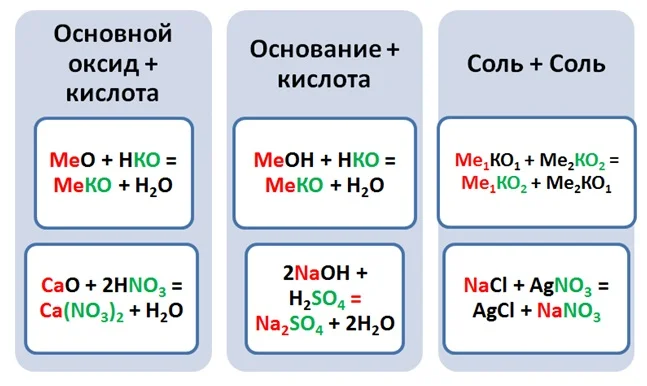
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.

Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.

Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.

Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.

Источник
Теперь необходимо справиться с задачей дать название этому типу солей.

Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.

Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
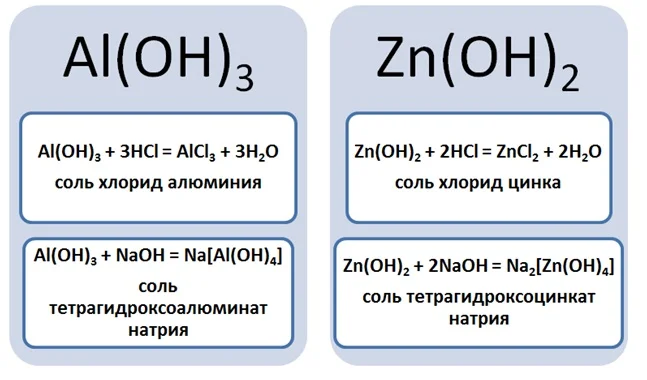
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.

Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.

Основания: классификация, номенклатура, получение
Урок посвящен повторению и обобщению сведений о классификации и свойствах оснований, сравнению химических свойств растворимых и нерастворимых в воде оснований.
I. Общая формула и названия оснований
Основания – это сложные вещества, в состав которых входят атомы металлов и гидроксильные группы – ОН.
Валентность гидроксильной группы равна единице. Поэтому общую формулу оснований можно записать так:
Ме(ОН)n
где n – число, равное валентности металла
Названия оснований состоят из двух слов: первое слово в названии – «гидроксид», а второе – название металла. Если валентность металла переменная, то она указывается в скобках в конце названия. Например:
NaOH – гидроксид натрия
Cu(OH)2 – гидроксид меди(II)
У некоторых оснований есть исторически сложившиеся названия. Например, гидроксид натрия получил название едкий натр или каустическая сода, гидроксид калия – едкое кали, гидроксид кальция – гашеная известь (пушонка). Эти названия веществ часто встречаются в технической литературе.
|
Формула |
Название |
Формула |
Название |
|
LiOH |
гидроксид лития |
Ca(OH)2 |
гидроксид кальция |
|
NaOH |
гидроксид натрия |
Cu(OH)2 |
гидроксид меди(II) |
|
KOH |
гидроксид калия |
Fe(OH)3 |
гидроксид железа(III) |
Обратите внимание, что кислородсодержащие кислоты также относятся к гидроксидам, поскольку содержат гидроксогруппу.
Однако, в России принято разделять основные и кислотные гидроксиды на два класса неорганических веществ: основания и кислоты, соответственно. Поэтому в нашей стране чаще всего термин “гидроксид” используется как синоним “основания”.
II. Классификация оснований
Щёлочи – это основания растворимые в воде.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Остальные – нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
III. Способы получения оснований
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra)
2. Оксид металла+ H2O = Щелочь
Na2O + H2O = 2 NaOH
Здесь, оксид металла (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Видео “Получение нерастворимых оснований”
Это интересно
Зачем купать крендель в гидроксиде натрия?
Гидроксид натрия необходим для приготовления некоторых блюд, например, традиционного немецкого кренделя — брецеля. Брецель является в Германии эмблемой пекарей и очень часто изображается на вывесках булочных и пекарен. Перед выпечкой брецели погружают на несколько секунд в раствор гидроксида натрия, что способствует образованию уникальной хрустящей корочки.
Чтобы приготовить скандинавское блюдо из рыбы — лютефиск — также необходим гидроксид натрия. Сушёную треску вымачивают 5 — 6 дней в едкой щёлочи, и рыба приобретает мягкую, желеобразную консистенцию.
Гидроксид натрия зарегистрирован в качестве пищевой добавки E524.
IV. Выполните задания
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al2O3, Zn(OH)2, CaO , SiO2, CrO , NaOH , Mn2O7, Fe(OH)2, Cr2O3
| Основный оксид | Кислотный оксид | Амфотерный оксид | Безразличный оксид | Щёлочь | Нерастворимое основание |
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
№3. Приведите по два уравнения реакций получения следующих оснований:
1) Гидроксид калия
2) Гидроксид кальция
в) Гидроксид железа (III)
V. Тренажеры
Тренажер №1. Классификация оснований
Тренажёр №2. Классификация оснований по растворимости в воде
Тренажёр №3. Оказание первой помощи при попадании щелочей на кожу
Тренажёр №4. Правила техники безопасности при работе со щелочами
Тренажёр №5. Составление названия основания по формуле
Тренажёр №6. Составление формул оснований
Тренажёр №7. Установление соответствия: основание – оксид металла
ЦОРы
Видео: “Получение нерастворимых оснований”
Видео-презентация: “Классификация оснований”
