найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где
— обозначение массовой доли;
— масса вещества;
— масса раствора.
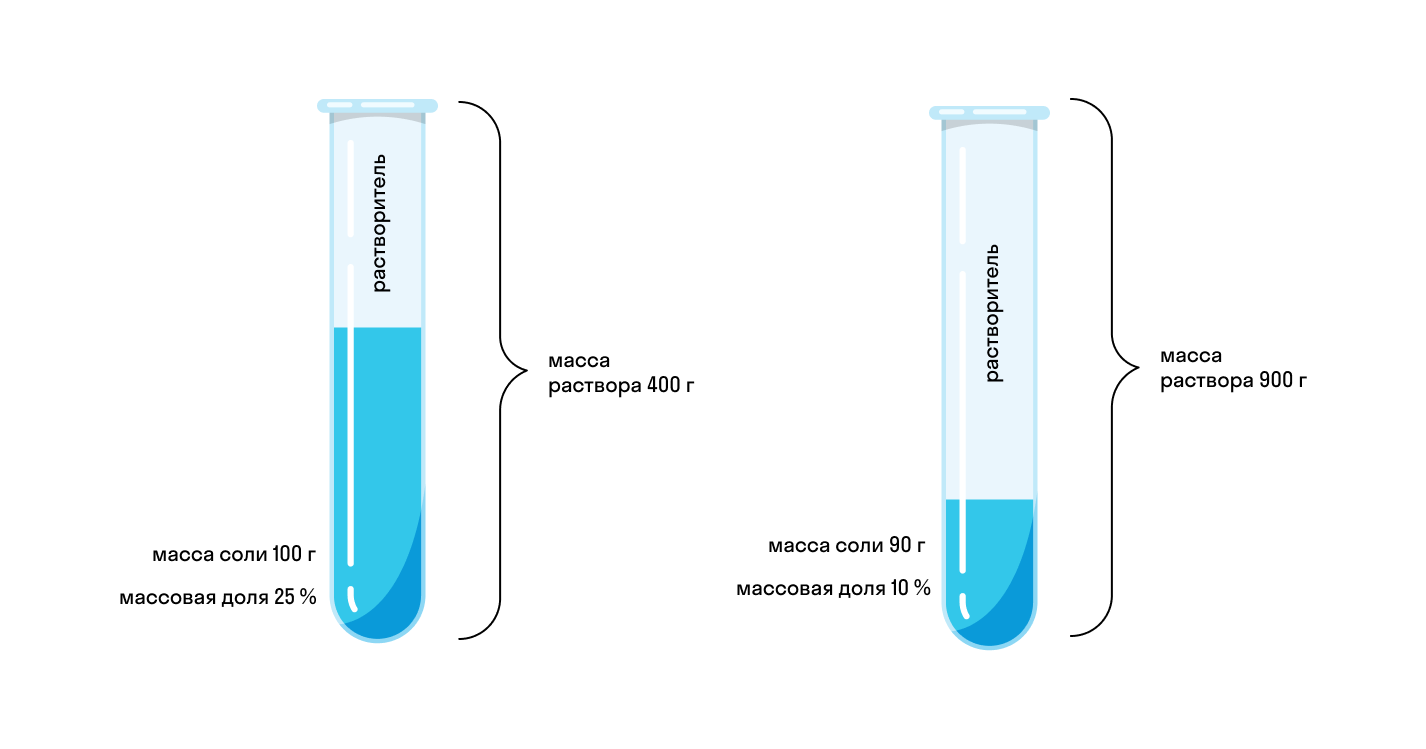
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
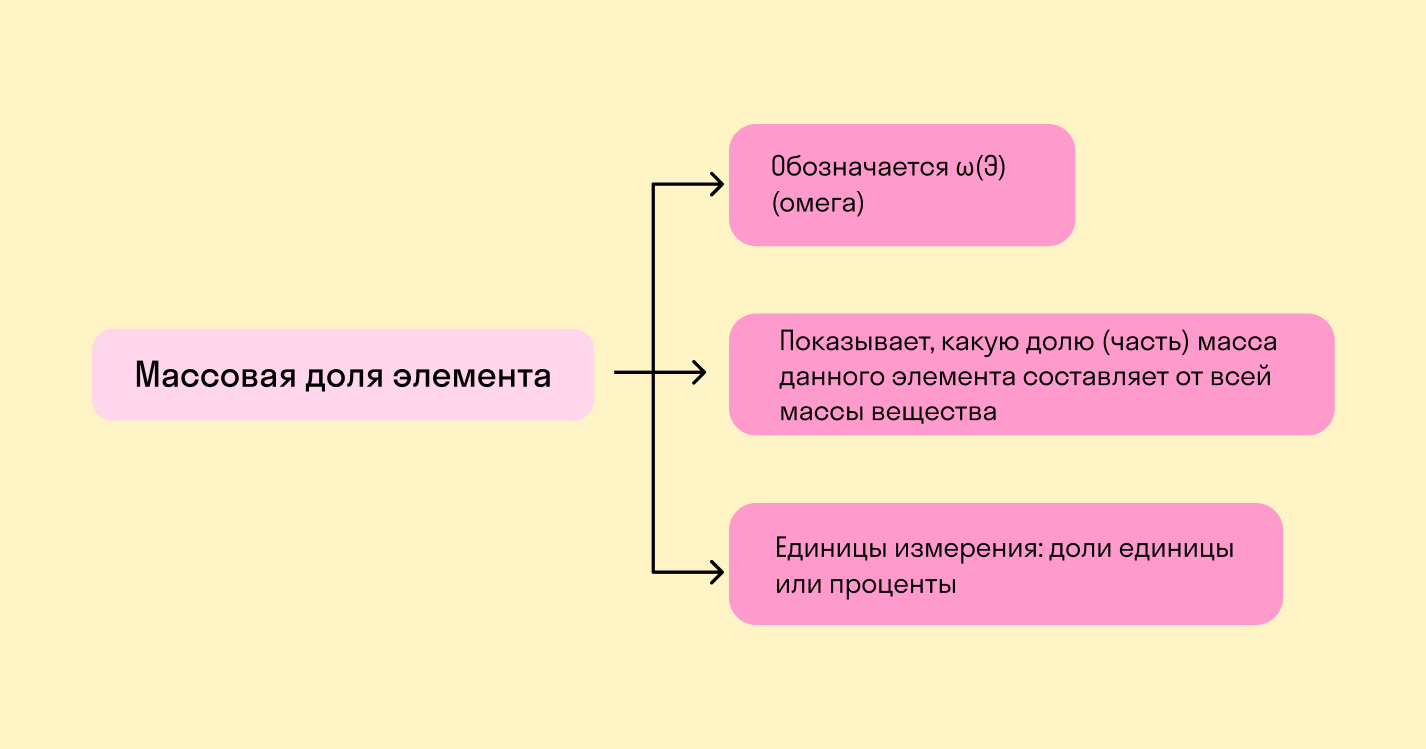
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
-
— количество атомов искомого элемента;
-
— относительная атомная масса элемента;
-
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
или
.
или
.
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
, значит
.
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
или
.
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Важно
Указание массовой доли вещества — один из способов выражения концентрации раствора.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
, а значит
.
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Введение
Одним из
специфических методов обучения химии является решение химических задач. В
процессе решения задач определяется степень усвоения материала, умение
использовать полученные знания.
Различают качественные, расчетные и комбинированные задачи. Расчетные
задачи подразделяют, в свою очередь, на три группы:
1.
Задачи, решаемые с
использованием химической формулы вещества или на вывод формулы.
2.
Задачи, для решения
которых используют управления химической реакций.
3.
Задачи, связанные с
растворами веществ.
Каждая из групп содержит различные виды задач.
Программой по химии предусмотрены следующие виды
расчетных задач:
1.
Вычисление относительной молекулярной массы веществ
по химическим формулам.
2.
Вычисления по химическим
уравнениям количества вещества, участвующего в реакции, по известному
количеству вещества, принимающего участие в химической реакции.
3.
Вычисления по химическим
уравнениям объема газов по известному количеству вещества одного из вступающих
в реакцию веществ или получающихся в результате ее.
4.
Вычисление массовой доли и
массы вещества в растворе.
5.
Вычисление по химическим
уравнениям массы по известному количеству вещества одного из вступающих или
получающихся в реакции веществ.
Основным требованием к отбору задач
является их химическое содержание. Условия задачи должны соответствовать целям
урока, должны быть доступны по содержанию и нести сведения практического
характера.
Расчетные задачи можно применять при объяснении нового материала,
при закреплении знаний, для домашнего задания, при текущем учете знаний, при
повторении материала и итоговом зачете, при выполнении самостоятельных и
контрольных работ, на факультативных или кружковых занятиях.
При решении задач необходимо правильно применять общепризнанные
буквенные обозначения физических величин и их единиц измерения в системе СИ
(см. таблицу 1 в Приложении) и использовать единый стиль оформления задач.
Последовательность действий учителя и ученика при решении задач
следующая:
1.
Понимание сущности задачи.
2.
Выполнение химической
части решения задачи (запись условия, уравнений реакций, постановка вопроса).
3.
Выбор наиболее
рационального способа решения.
4.
Расчет
5.
Запись ответа.
Существует несколько способов решения задач.
Наиболее распространенными являются:
1. Соотношение масс веществ.
2. Использование величины “количество
вещества”.
3. Составление пропорций.
Эти способы решения будут использованы в данном пособии.
- Вычисление относительных атомных и молекулярных
масс.
Относительная атомная масса(Аr)-это
отношение массы атома элемента к 1/12 массы атома углерода:
Аr(Э)=![]() =m(Э)
=m(Э)![]() 1аем. (1)
1аем. (1)
ma(Э)-масса атома элемента;
ma(Э)-масса атома углерода;
1/12 ma(c)=1,66![]() 10-24г – одна атомная единица массы (а.е.м).
10-24г – одна атомная единица массы (а.е.м).
Задача 1. Найдите
относительную атомную массу натрия, если масса атома натрия 38 ![]() 10-24 г, а масса атома углерода
10-24 г, а масса атома углерода
20 ![]() 10-24 г.
10-24 г.
Ход рассуждений. Запишем кратко условие
задачи. Вспомним определение Аr и формулу для ее вычисления. Подставим
числовые данные. Сделаем расчет.
![]() Дано: Решение:
Дано: Решение:
ma(Na)=38![]() 10-24г Ar(Na)=
10-24г Ar(Na)=![]()
![]() ma(с)=20
ma(с)=20![]() 10-24г Ar(Na)=
10-24г Ar(Na)=![]()
Аr(Na)-? Ответ: Аr(Na)=23
Относительная молекулярная масса (Мr)-это отношение массы молекулы вещества к 1/12
массы атома углерода:
Mr=![]() (а.е.м) (2)
(а.е.м) (2)
Mm
– масса молекулы вещества.
Задача 2. Определите относительную молекулярную массу Fe2O3, если известно, что масса молекулы оксида
железа (III) 2,6![]()
Ход рассуждений. Запишем кратко условие задачи. Вспомним определение Мr.
Поскольку для вычисление Мr через массу молекулы необходимо знать массу
атома углерода, подставим ее значение в условие задачи. Запишем формулы(2).
Подставим числовые данные в формулу. Сделаем расчет.
![]() mM(Fe2O3)=2.6
mM(Fe2O3)=2.6![]()
![]() Mr
Mr
(Fe2O3)=![]()
ma(С)=20![]() Mr (Fe2O3)=
Mr (Fe2O3)=![]()
![]() Мr(Fe2O3)-? Ответ: Mr (Fe2O3)=160
Мr(Fe2O3)-? Ответ: Mr (Fe2O3)=160
2.
Определение относительной молекулярной массы и массы молекулы
Относительную молекулярную массу (Mr)
можно вычислить по относительной атомной массе элементов, входящих в эту
молекулу. Для этого нужно знать формулу вещества, т.е. какие элементы входят и
каково число атомов каждого элемента в молекуле:
Mr = Аr(Э1) * n1+
Аr(Э2) * n2
+ … (3)
Аr(Э1) – относительная атомная масса
первого элемента;
n1 – число атомов первого элемента в молекуле;
Аr(Э2) – относительная атомная масса
второго элемента
n2 – число атомов второго элемента в молекуле;
Задача 3. Определите относительную молекулярную массу
углекислого газа СO2, зная относительные массы углерода и кислорода.
Ход рассуждений. Запишем кратко
условие задачи. Определим формулу для вычисления (Mr),
если известны относительные атомные массы (Аr) кислорода и углерода. Подставим числовые
данные в формулу (3).Сделаем расчет.
![]() Дано: Мr (СО2)
Дано: Мr (СО2)
= Аr(С) * nс+ Аr(О) * nо
Мr (СО2) =12*1+16*2=44
Аr (С)=12
![]() Аr (О)=16
Аr (О)=16
Мr (СО2) – ? Ответ: Мr (СО2)
= 44
3. Нахождение массовой доли элемента в веществе
Нахождение массовой доли элемента в
веществе – центральная задача среди расчетов по формуле вещества. Рекомендуются
упражнения этого вида выполнить в таком количестве, чтобы учащиеся приобрели
навык расчета массовой доли элемента в веществе.
Массовая доля элемента в веществе (W) показывает, какую часть
составляет масса атомов элемента от массы молекулы вещества. Для чистого
вещества с постоянным составом массовая доля элемента в веществе постоянна. В
любой массе массовая доля элемента такая, как в истинной или условной молекуле.
Для нахождения W (Э) необходимо
относительную атомную массу Аrвсех атомов данного элемента (n) отнести к относительной
молекулярной массе вещества (Мr) :
 (4)
(4)
Массовую долю элемента в веществе можно
выражать в долях или процентах. Во втором случае полученный по формуле (4)
результат умножают на 100%:

Задача 4. Определить массовую долю элемента кислорода в
320 г серной кислоты.
![]() Дано: Решение:
Дано: Решение:
![]() m(H2SO4)=320г W(O) = Ar (O) *n
m(H2SO4)=320г W(O) = Ar (O) *n
Аr (О)=16 Mr (H2SO4)
Аr (S)=32
Аr (H)=1 Mr
(H2SO4) = 1*2+32*1+16*4=98
![]()
![]() W (O) -? W(O) = 16*4 = 0,65 или 65 %
W (O) -? W(O) = 16*4 = 0,65 или 65 %
98
4. Вычисления с использованием понятия
«Количество вещества», «Число Авогадро»
Количество вещества – (υ) – это физическая величина, определяемая числом
структурных единиц (атомов, молекул, ионов, электронов) и других частиц). Единица
измерения количества вещества –МОЛЬ. Моль равна количеству вещества системы,
которая содержит столько же структурных частиц, сколько содержится атомов в
углероде – 12 массой 0,012 кг (12г), 1 моль вещества содержит 6*1023
структурных частиц. Является величиной постоянной и называется числом Авогадро
(NA).
NA ![]()

Используя понятие «моль» необходимо указывать, о каких структурных
частицах говорится. Если число структурных частиц, содержащихся в системе (N)
разделить на число структурных частиц, составляющих 1 моль (NA), можно определить число молей.
![]()
![]() υ = N (5)
υ = N (5)
NA
Задача 5. Какое
количество вещества содержит 18*1023 молекул Н2S?
Дано: Решение:
![]()
![]() N(Н2S) =
N(Н2S) =
18*1023 υ = N = 18*1023 = 3 моль Н2S
![]() υ (Н2S) –? NA 60*1023
υ (Н2S) –? NA 60*1023
Задача 6. Какое
число атомов соответствует 0,25 моль железа?
![]() Дано: Решение:
Дано: Решение:
![]() υ
υ
(Fe) = 0,25моль
N (Fe) -? N = υ *
NA
N (Fe)
=0,25 моль * 6*1023 = 1,5*1023 атомов
Ответ:
N (Fe) = 1,5*1023 атомов
Количество вещества
(υ) взаимно связано с массой вещества (m):
m = υ *
М (6)
Где М – молярная масса.
Нужно различать понятия «масса», «относительная молекулярная масса» и
«молярная масса». Первые два понятия уже описаны выше. Молярная масса –это
масса 1 моль вещества или масса 6*1023 структурных частиц. Единица
измерения моляронй массы – г/моль. Связь с относительной молекулярной (Mr)
М=Mr * 1 г/моль
Mr (NaOH) =40
M (NaOH) =
40г/моль
Задача 7.
Определите массу 0,3 моль оксида алюминия.
![]() Дано: Решение:
Дано: Решение:
υ (Al2O3) = 0,3моль M (Al2O3)=27*2+16*3=102г/моль
M (Al2O3)=102г/моль m (Al2O3)=0,3 моль*102г/моль= 30,6 г
![]() m (Al2O3) -? Ответ: m (Al2O3)= 30,6 г
m (Al2O3) -? Ответ: m (Al2O3)= 30,6 г
Задача 8. Сколько моль вещества составляет 12 г
гидроксида калия?
![]() Дано: Решение:
Дано: Решение:
m(KOH) = 12 г Преобразуем формулу (6)
M (KOH)=56г/моль υ =![]()
υ ![]() (KOH) -? υ (КОН)
(KOH) -? υ (КОН)
= 12г = 0,2 моль
![]() 56
56
г/моль
Ответ:
υ (КОН) = 0,2 моль.
6. Вычисление массовой доли и массы вещества в растворе.
Массовая доля растворенного вещества определяется как отношение
массы растворенного вещества к массе раствора:

W – массовая доля
растворенного вещества;
mр.в.– масса растворенного вещества, г;
mр-ра.– масса раствора, г;
Массовую долю можно
выражать в долях (умножение на 100% в этом случае опускается ) или в процентах.
Расчеты по химическим формулам.
Алгоритмы.
1.
Записать химическую
формулу вещества.
2.
Установить определяемый
элемент.
3.
Рассчитать массу вещества
и массу определяемого элемента. Составить пропорцию и рассчитать Х.
Задача.
Вычислить массу меди,
содержащуюся в 320 г. оксида меди (II).
Загрузить PDF
Загрузить PDF
Состав молекулы в массовых процентах – это доля каждого элемента в общей массе молекулы. Массовый процент какого-либо элемента в соединении определяется как отношение массы данного элемента к полной молекулярной массе соединения, умноженное на 100%. Хоть это определение и звучит замысловато, на самом деле определить массовую долю довольно легко!
-

1
Атомы. Материя состоит из атомов, а те, в свою очередь, состоят из протонов, нейтронов и электронов. Атомы – элементарные кирпичики, из которых сложено все, что окружает нас.
-

2
Молекулы. Молекулы – это электрически нейтральные химические соединения двух или большего количества атомов, скрепленных друг с другом химическими связями.
- Например, вода состоит из молекул H2O. Каждая молекула воды включает в себя два атома водорода, соединенных химическими связями с одним атомом кислорода.
-

3
Моли. Моль – это единица измерения количества вещества. Один моль определяется как количество вещества, содержащее 6,02 x10^ 23 элементарных составляющих, и повсеместно используется для выражения количества химических веществ.
- Величина 6,02 x 10^23 примерно равна числу атомов в 12 граммах чистого углерода и называется “числом Авогадро”.
-

4
Химические соединения. Это чистые химические вещества, состоящие из двух или более химических элементов.
- Вода, состоящая из молекул H2O, является химическим веществом.
-

5
Атомная масса. Это масса отдельного атома либо молекулы. Атомная масса выражается в граммах на моль (г/моль).
- Учтите, что атомная масса отличается от атомного веса; она соответствует полной массе частицы (атома или молекулы) в состоянии покоя.
-

6
Молекулярная масса. Это масса отдельной молекулы. Другими словами, это сумма масс всех атомов, входящих в данную молекулу.
- Как и в случае с атомной массой, молекулярная масса отлична от веса молекулы.
Реклама
-

1
Выпишите элементы, входящие в химическое соединение.
- Например, вам необходимо вычислить массовые проценты в лимонной кислоте, имеющей химическую формулу C6H8O7, как показано на рисунке. Молекула кислоты содержит следующие элементы: углерод (C), водород (H) и кислород (O).
-

2
Выпишите атомную массу каждого элемента. Для определения атомных масс используйте периодическую таблицу элементов (таблицу Менделеева). Как правило, атомная масса приведена в этой таблице сразу под символом соответствующего элемента, и выражена в единицах г/моль.
- Для приведенного выше примера находим: атомная масса углерода равна 12,01 г/моль, водорода – 1,00 г/моль, кислорода – 15,99 г/моль.
-

3
Найдите массовый вклад каждого элемента, входящего в соединение. Массовый вклад отдельного соединения равен атомной массе данного элемента, умноженной на количество его атомов в молекуле соединения. Количество атомов каждого элемента в молекуле обозначается числом в подписи, стоящим после символа соответствующего элемента.
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
Массовый вклад углерода: 6 x 12,01 г/моль = 72,06 г/моль
Массовый вклад водорода: 8 x 1,00 г/моль = 8,00 г/моль
Массовый вклад кислорода: 7 x 15,99 г/моль = 111,93 г/моль
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
-

4
Вычислите общую молекулярную массу вашего соединения. Общая молекулярная масса равна сумме массовых вкладов каждого элемента, и соответствует массе одной молекулы соединения.
- В нашем примере молекулярная масса рассчитывается так:
Молекулярная масса C6H8O7 = 72,06 г/моль + 8,00 г/моль + 111,93 г/моль = 191,99 г/моль
- В нашем примере молекулярная масса рассчитывается так:
-

5
Найдите массовый состав в процентах. Массовая доля элемента в процентах вычисляется как отношение массового вклада данного элемента к общей молекулярной массе соединения, умноженное на 100%.
- В нашем примере массовые проценты каждого элемента рассчитываются так, как показано на рисунке. Таким образом, C6H8O7 состоит из 37,53% углерода, 4,16% водорода и 58,29% кислорода.
Реклама
Советы
- Вы можете проверить правильность своих вычислений, сложив массовые проценты всех элементов – в сумме должно получиться 100%. Однако помните, что вы не всегда можете получить точно 100%, поскольку массовый вклад каждого элемента был округлен до второго знака после запятой.
Реклама
Об этой статье
Эту страницу просматривали 12 939 раз.
