Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.

здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
![]()
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
![]()
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.

Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.

Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
475
Создан на
11 января, 2022 От Admin

Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два вещества, на скорость реакции между которыми оказывает влияние повышение давления.
1) Na2SO4 (р-р)
2) CuO
3) H2
4) Ba(NO3)2 (р-р)
5) HNO3 (р-р)
2 / 10
Из предложенного перечня выберите два вещества, на скорость реакции между которыми оказывает влияние повышение давления.
1) Na2CO3 (р-р)
2) CO (г)
3) HCl (р-р)
4) Ba(OH)2 (р-р)
5) O2 (г)
3 / 10
Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость реакции, протекающей по схеме:
CuO(тв.) + 2H+(p-p) = Cu2+(p-p) + H2O(ж)
1) повышение температуры
2) разбавление раствора кислоты
3) применение индикатора
4) увеличение концентрации кислоты в растворе
5) увеличение давления
4 / 10
Из предложенного перечня выберите все внешние воздействия, которые увеличивают скорость химической реакции гидролиза этилацетата.
1) охлаждение реакционной смеси
2) увеличение концентрации этилацетата
3) повышение температуры
4) увеличение концентрации этанола
5) добавление катализатора
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции железа с раствором серной кислоты.
1) понижение температуры
2) увеличение концентрации кислоты
3) использование ингибитора
4) увеличение степени измельчения железа
5) повышение давления в системе
Запишите в поле ответа номера выбранных внешних воздействий.
6 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции между растворами медного купороса и гидроксида натрия.
1) понижение давления в системе
2) увеличение концентрации щёлочи
3) повышение давления в системе
4) увеличение концентрации купороса
5) понижение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
7 / 10
Из предложенного перечня выберите две химические реакции, для которых увеличение давления приводит к увеличению скорости реакции.
1) Ba(тв.) + 2H2О(ж) = Ba(OH)2(тв.) + H2(г)
2) Fe2О3(тв.) + H2(г) = 2FeO(тв.) + H2(г)
3) Fe(тв.) + CuSO4(p-p) = FeSO4(p-p) + Cu(тв.)
4) 2KOH(р-p) + H2SO4(p-p) = K2SO4(p-p) + 2H2О(ж)
5) 2P(тв.) + 5Cl2 = 2PCl5(тв.)
Запишите в поле ответа номера выбранных реакций.
8 / 10
Из предложенного перечня выберите две реакции, для которых уменьшение концентрации кислоты приводит к уменьшению скорости реакции.
1) SO2 + H2O = H2SO3
2) РCl5 + 4H2O = 5HCl + H3PO4
3) Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
4) Mg + 2H+ = Mg2+ + H2
5) Cl2 + H2O = HCl + HClO
Запишите в поле ответа номера выбранных реакций.
9 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции гидратации ацетилена.
1) добавление катализатора
2) понижение давления в системе
3) уменьшение концентрации продукта реакции
4) увеличение концентрации ацетилена
5) понижение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
10 / 10
Из предложенного списка химических реакций выберите те, скорость которых уменьшается при понижении концентрации кислоты.
1) Ca + 2HCl = CaCl2 + H2
2) H2O + N2O5 = 2HNO3
3) C6H6 + HNO3 = C6H5NO2 + H2O
4) NH4H2PO4 = NH3 + H3PO4
5) SO3 + H2O = H2SO4
Ваша оценка
The average score is 38%
Скорость химической реакции – основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
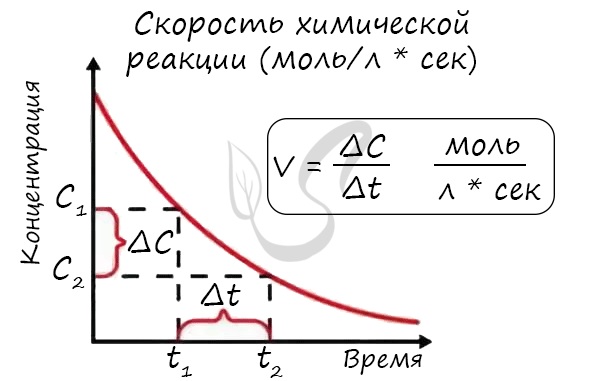
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции – 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо – железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос “какой из металлов Fe или Ca быстрее прореагирует с серой?” мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос “какой из металлов Li или K быстрее прореагирует с водой?” мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации “прямо пропорционально” скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении – понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости – k – в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени – a и b.
Записанное выше следствие закона действующих масс нужно не только “зазубрить”, но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: “Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!”
Очень часто в заданиях следующей темы – химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
Итак, влияние температуры на скорость реакции “прямо пропорционально”: чем выше температура, тем выше скорость реакции – чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая “пропорция”.
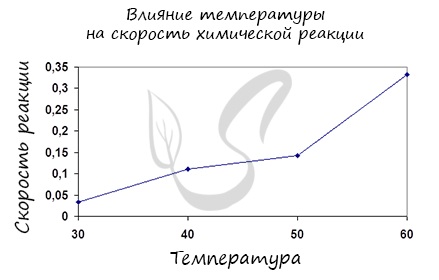
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
“При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза”

В формуле, написанной выше, используются следующие обозначение:
- υ1 – скорость реакции при температуре t1
- υ2 – скорость реакции при температуре t2
- γ – температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
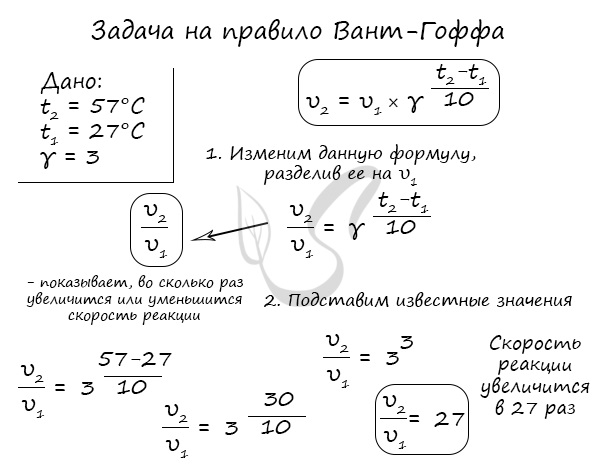
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: “Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз”.

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) – вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов – белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
– каталитическими.

Ингибитор (лат. inhibere – задерживать) – вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
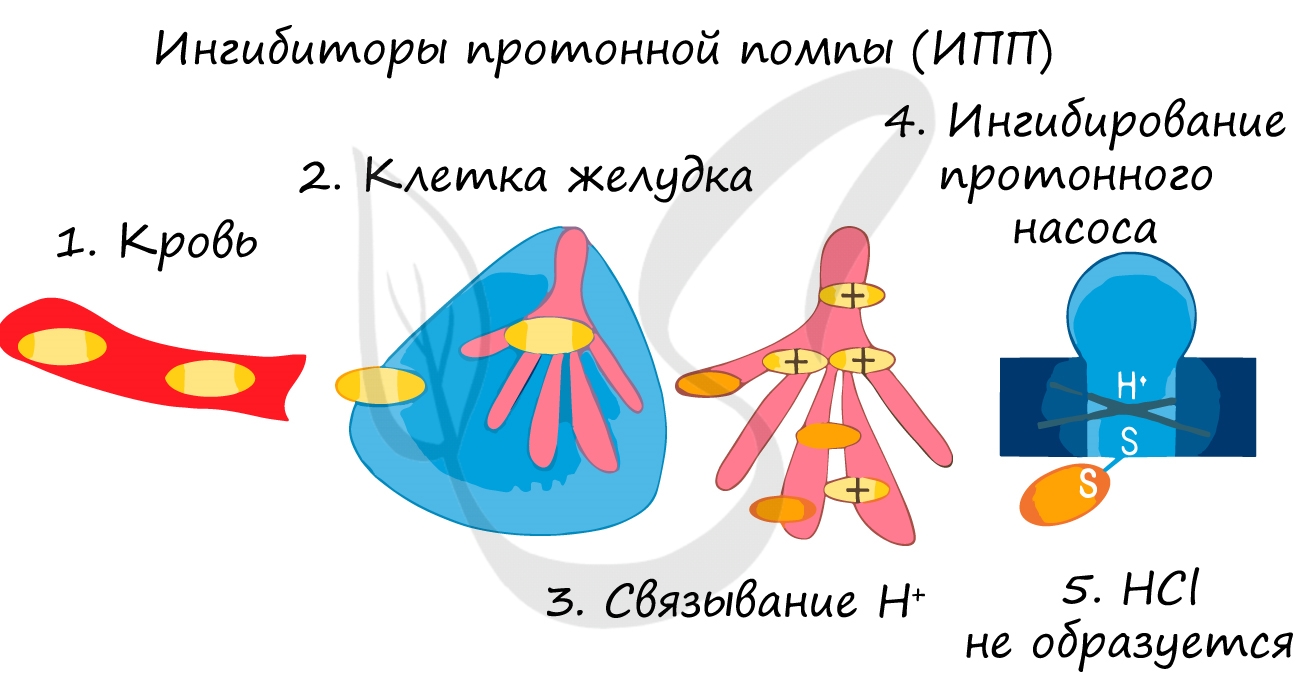
Так при лечении гастрита – воспаления желудка (греч. gaster – желудок) или язв часто назначаются ингибиторы протонной помпы – химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18/2006
Основы химической кинетики.
Состояние химического равновесия
План
 1.
1.
Химическая кинетика и область ее изучения.
2. Скорость гомогенной и гетерогенной реакции.
3. Зависимость скорости реакции от различных
факторов: природы реагирующих веществ,
концентрации реагентов (закон действующих масс),
температуры (правило Вант-Гоффа), катализатора.
4. Обратимые и необратимые химические реакции.
5. Химическое равновесие и условия его смещения.
Принцип Ле Шателье.
Раздел химии, изучающий скорости и механизмы
протекания химических реакций, называется
химической кинетикой. Одним из основных в этом
разделе является понятие скорости химической
реакции. Одни химические реакции протекают
практически мгновенно (например, реакция
нейтрализации в растворе), другие – в течение
тысячелетий (например, превращение графита в
глину при выветривании горных пород).
Скорость гомогенной реакции – это количество
вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени в единице объема системы:
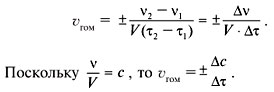
Другими словами, скорость гомогенной реакции
равна изменению молярной концентрации
какого-либо из реагирующих веществ за единицу
времени. Скорость реакции – величина
положительная, поэтому в случае выражения ее
через изменение концентрации продукта реакции
ставят знак «+», а при изменении концентрации
реагента знак «–».
Скорость гетерогенной реакции – это
количество вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени на единице поверхности фазы:
![]()
Важнейшие факторы, влияющие на скорость
химической реакции, – природа и концентрация
реагентов, температура, присутствие
катализатора.
Влияние природы реагентов проявляется в
том, что при одних и тех же условиях различные
вещества взаимодействуют друг с другом с разной
скоростью, например:
При увеличении концентрации реагентов
увеличивается число столкновений между
частицами, что приводит к увеличению скорости
реакции. Количественно зависимость скорости
реакции от концентрации реагентов выражается з а
к о н о м д е й с т в у ю щ и х м а с с
(К.М.Гульдберг и П.Вааге, 1867 г.; Н.И.Бекетов, 1865 г.). Скорость
гомогенной химической реакции при постоянной
температуре прямо пропорциональна произведению
концентрации реагирующих веществ в степенях,
равных их стехиометрическим коэффициентам
(концентрации твердых веществ при этом не
учитываются), например:
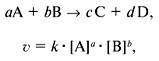
где А и В – газы или жидкости, k – константа
скорости реакции, равная скорости реакции при
концентрации реагентов 1 моль/л. Константа k
зависит от свойств реагирующих веществ и
температуры, но не зависит от концентрации
веществ.
Зависимость скорости реакции от температуры
описывается экспериментальным п р а в и л о м
В а н т-Г о ф ф а (1884 г.). При повышении температуры
на 10°, скорость большинства химических реакций
увеличивается в 2–4 раза:
![]()
где ![]() –
–
температурный коэффициент.
Катализатором называется вещество,
изменяющее скорость химической реакции, но не
расходующееся в результате этой реакции.
Различают положительные катализаторы
(специфические и универсальные), отрицательные
(ингибиторы) и биологические (ферменты, или
энзимы). Изменение скорости реакции в
присутствии катализаторов называется катализом.
Различают гомогенный и гетерогенный катализ.
Если реагенты и катализатор находятся в одном
агрегатном состоянии, катализ является
гомогенным; в разных – гетерогенным.
Гомогенный катализ:
![]()
гетерогенный катализ:
![]()
Механизм действия катализаторов является
очень сложным и не изученным до конца. Существует
гипотеза об образовании промежуточных
соединений между реагентом и катализатором:
А + кат. ![]() [A кат.],
[A кат.],
[A кат.] + В ![]() АВ + кат.
АВ + кат.
Для усиления действия катализаторов применяют
промоторы; существуют также каталитические яды,
ослабляющие действие катализаторов.
На скорость гетерогенной реакции влияют величина
поверхности раздела фаз (степень
измельченности вещества) и скорость подвода
реагентов и отвода продуктов реакции от
поверхности раздела фаз.
Все химические реакции делятся на два типа:
обратимые и необратимые.
Необратимыми называются химические реакции,
протекающие только в одном направлении, т.е.
продукты этих реакций не взаимодействуют друг с
другом с образованием исходных веществ. Условия
необратимости реакции – образование осадка,
газа или слабого электролита. Например:
BaCl2 + H2SO4 = BaSO4![]() + 2HCl,
+ 2HCl,
K2S + 2HCl = 2KCl + H2S![]() ,
,
HCl + NaOH = NaCl + H2O.
Обратимыми называются реакции, протекающие
одновременно в прямом и обратном направлениях,
например:
![]()
При протекании обратимой химической реакции
скорость прямой реакции вначале имеет
максимальное значение, а затем уменьшается
вследствие уменьшения концентрации исходных
веществ. Обратная реакция, наоборот, в начальный
момент времени имеет минимальную скорость,
которая постепенно увеличивается. Таким образом,
в определенный момент времени наступает состояние
химического равновесия, при котором скорость
прямой реакции равна скорости обратной реакции.
Состояние химического равновесия является
динамическим – продолжают протекать как прямая,
так и обратная реакции, но поскольку скорости их
равны, то концентрации всех веществ в
реакционной системе не изменяются. Эти
концентрации называются равновесными.

Отношение констант скоростей прямой и
обратной реакций является постоянной величиной
и называется константой равновесия (Кр).
Концентрации твердых веществ не входят в
выражение константы равновесия. Константа
равновесия реакции зависит от температуры и
давления, но не зависит от концентрации
реагирующих веществ и от присутствия
катализатора, который ускоряет ход как прямой,
так и обратной реакции. Чем больше Кр, тем
выше практический выход продуктов реакции. Если Кр
> 1, то в системе преобладают продукты реакции;
если Кр < 1, в системе преобладают
реагенты.
Химическое равновесие является подвижным, т.е.
при изменении внешних условий может
увеличиваться скорость прямой или обратной
реакции. Направление смещения равновесия
определяется п р и н ц и п о м, сформулированным
французским ученым Ле Шателье в 1884 г. Если на
равновесную систему оказывается внешнее
воздействие, то равновесие смещается в сторону
той реакции, которая противодействует этому
воздействию. На смещение равновесия влияют
изменения концентрации реагентов, температуры и
давления.
Увеличение концентрации реагентов и вывод
продуктов приводят к смещению равновесия в
сторону прямой реакции.
При нагревании системы равновесие смещается в
сторону эндотермической реакции, при охлаждении
– в сторону экзотермической.
Для реакций, в которых принимают участие
газообразные вещества, повышение давления
смещает равновесие в сторону реакции,
протекающей с уменьшением числа молекул газа.
Если реакция протекает без изменения числа
молекул газообразных веществ, то изменение
давления никак не влияет на смещение равновесия.
Тест по теме «Основы химической
кинетики.
Состояние химического равновесия»
 1.
1.
В некоторой реакции температурный коэффициент
равен 2. При повышении температуры от 0 до 50 °С
скорость этой реакции увеличится в число раз:
а) 4; б) 16; в) 32; г) 64.
2. При повышении давления в 5 раз скорость
реакции образования йодоводорода из простых
веществ возрастет в число раз:
а) 5; б) 10; в) 25; г) 125.
3. Реакция при температуре 20 °С протекает
за 6 мин 45 с. При температуре 60 °C (коэффициент
Вант-Гоффа для данной реакции равен 3) эта же
реакция закончится через (в с):
а) 5; б) 15; в) 20; г) 25.
4. Реакция при температуре 30 °С протекает
за 2 мин 40 с, а при температуре 70 °С эта же
реакция протекает за 10 с. Температурный
коэффициент данной реакции равен:
а) 1,5; б) 2; в) 2,5; г) 3.
5. Из перечисленных реакций выбрать ту,
которая протекает с максимальной скоростью.
а) Образование хлорида серебра из нитрата
серебра и хлорида натрия в растворе;
б) окисление этанола в организме человека;
в) брожение глюкозы;
г) коррозия железа во влажном воздухе.
6. На смещение равновесия в ходе реакции
восстановления оксида железа(III) водородом
оказывает влияние:
а) изменение давления;
б) введение катализатора;
в) удаление из сферы реакции образующихся
продуктов;
г) изменение температуры.
7. Катализ может быть:
а) окислительно-восстановительным;
б) биологическим;
в) гомогенным;
г) гетерогенным.
8. Ингибитором называют:
а) биологический катализатор;
б) отрицательный катализатор;
в) положительный катализатор;
г) совсем не катализатор.
9. Для какой из перечисленных реакций
давление не влияет на смещение равновесия?
а) Образование воды из простых веществ;
б) образование аммиака из простых веществ;
в) образование метана из простых веществ;
г) образование бромоводорода из простых
веществ.
10. Две реакции протекают с одинаковой
скоростью при 30 °С, коэффициенты Вант-Гоффа
для этих реакций 3 и 5 соответственно. Отношение
скоростей этих реакций, протекающих при 60 °С,
равно:
а) 5,0; б) 4,63; в) 1,67; г) 0,22.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | в | а | б | а | в, г | б, в, г | б | г |
г |
Задачи и упражнения по
химической кинетике
Скорость химической реакции. Закон
действующих масс (закон Гульдберга и Вааге)
 1.
1.
Как изменится скорость образования диоксида
азота в реакции оксида азота(II) с кислородом, если
давление в системе увеличить в 3 раза, а
температуру оставить неизменной?
Ответ. Возрастет в 27 раз.
2. Как изменится скорость элементарной
реакции А2 + 2В2 = 2АВ2,
протекающей в газовой фазе в закрытом сосуде,
если увеличить давление в 6 раз?
Решение
Для реакции, описываемой уравнением:
А2 + 2В2 = 2АВ2,
скорость реакции:
![]() 1 =
1 =
k•[A2]•[B2]2.
При увеличении давления в сосуде в 6 раз
концентрации всех веществ также возрастут в 6
раз. Выражение для скорости реакции примет вид:
![]() 2 =
2 =
k•6[A2]•(6[B2])2 = 216k•[A2]•[B2]2.
Ответ. Возрастет в 216 раз.
3. Определить среднюю скорость химической
реакции восстановления углекислого газа
водородом до угарного газа и воды, если через 80 с
после начала реакции молярная концентрация воды
была равна 0,24 моль/л, а через 2 мин 7 с стала равна
0,28 моль/л.
Ответ. 0,051 моль/(л•мин).
4. Как изменится скорость реакции получения
аммиака из простых веществ, если при неизменной
температуре уменьшить объем газовой смеси в 3
раза?
Ответ. Увеличится в 81 раз.
5. Во сколько раз изменится скорость
химической реакции 2А + В = А2В, если
концентрацию вещества А увеличить в 2 раза, а
концентрацию вещества В уменьшить в 2 раза?
Ответ. Возрастет в 2 раза.
Правило Вант-Гоффа
1. Во сколько раз увеличится скорость
химической реакции образования йодоводорода из
простых веществ при повышении температуры от
20 °С до 170 °С, если при повышении температуры
на каждые 25 °С скорость реакции увеличивается
в 3 раза?
Ответ. Увеличится в 716 раз.
2. Коэффициент Вант-Гоффа для некоторой
реакции равен 2,5. Во сколько раз увеличится
скорость этой реакции при повышении температуры
от 10 °С до 55 °С?
Решение
Выражение для скорости реакции ![]() 2 по сравнению со скоростью
2 по сравнению со скоростью
реакции ![]() 1 при
1 при
изменении температуры ![]() Т
Т
имеет вид:
![]()
Ответ. Возрастет в 61,76 раза.
3. Скорость некоторой реакции возрастает в
3,5 раза при повышении температуры на каждые
20 °C. Как изменится время протекания данной
реакции при повышении температуры от 20 °C до
85 °С?
Ответ. Уменьшится в 58,475 раза.
4. Растворение образца цинка в соляной
кислоте при 20 °С заканчивается через 27 мин, а
при 40 °С такой же образец металла растворяется
за 3 мин. За какое время данный образец цинка
растворится при 55 °С?
Ответ. За 34,6 с.
5. Растворение образца железа в серной
кислоте при 20 °С заканчивается через 15 мин, а
при 30 °С такой же образец металла растворяется
за 6 мин. За какое время данный образец железа
растворится при 35 °С?
Ответ. За 3,8 мин.
Состояние равновесия. Равновесные
концентрации
1. Равновесие реакции образования
йодоводорода из простых веществ установилось
при следующих концентрациях: [H2] = 0,4 моль/л,
[I2] = 0,5 моль/л, [HI] = 0,9 моль/л. Определить
исходные концентрации водорода и йода и
рассчитать константу равновесия данной реакции.
Решение
Для реакции образования йодоводорода:
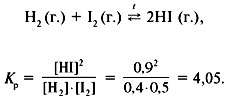
Равновесные концентрации:
[H2] = 0,4 моль/л, [I2] = 0,5 моль/л,
[HI] = 0,9 моль/л.
Прореагировало в объеме: 0,45 моль/л Н2 и 0,45
моль/л I2, получилось 0,9 моль/л HI.
Исходные концентрации:
с0(H2) = 0,4 + 0,45 = 0,85 моль/л,
с0(I2) = 0,5 + 0,45 = 0,95 моль/л.
Ответ. с0(Н2) = 0,85 моль/л, с0(I2)
= 0,95 моль/л, Кр = 4,05.
2. В реакции А + В = С + D смешали по 1 моль всех
веществ A–D. После установления равновесия в
смеси оказалось 1,5 моль вещества С. Определить
константу равновесия данной реакции.
Ответ. Кр = 9.
3. Равновесие реакции образования аммиака
из простых веществ устанавливается при
следующих концентрациях: [N2] = 0,01 моль/л, [Н2]
= 2 моль/л, [NН3] = 0,4 моль/л. Вычислить
константу равновесия и исходные концентрации
азота и водорода.
Ответ. Кр = 2, с0(N2)
= 0,21 моль/л, с0(Н2) = 2,6 моль/л.
4. Равновесие реакции образования
диоксида азота из монооксида и кислорода
установилось при следующих концентрациях
реагирующих веществ: оксида азота(II) – а
моль/л, кислорода – в моль/л, оксида азота(IV) –
с моль/л. Как изменятся скорости прямой и
обратной реакций, если уменьшить объем,
занимаемый газами, в 2 раза? Сместится ли при этом
равновесие?
Ответ. Возрастут в 8 и 4 раза,
равновесие сместится вправо.
5. Исходные концентрации азота и водорода в
реакционной смеси для получения аммиака
составляли 4 и 10 моль/л соответственно. Вычислить
равновесные концентрации компонентов смеси и
константу равновесия данной реакции, если к
моменту наступления равновесия прореагировало
50% азота.
Ответ. Равновесные концентрации:
[N2] = 2 моль/л,
[Н2] = [NН3] = 4 моль/л,
Кр = 1/8.
Принцип Ле Шателье
1. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления углекислого газа до угарного с
помощью углерода в сторону образования продукта
реакции?
Ответ. Для реакции
СО2 (г.) + С (тв.) ![]() 2СО (г.) – Q
2СО (г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) понижение давления;
в) увеличение концентрации СО2;
г) вывод СО из сферы реакции.
2. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления оксида железа(III) с помощью
водорода в сторону прямой реакции?
Ответ. Для реакции
Fe2О3 (тв.) + 3Н2 (г.) ![]() 2Fe (тв.) + 3Н2О
2Fe (тв.) + 3Н2О
(г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) увеличение концентрации Н2;
в) вывод Н2О из реакции.
3. Какие факторы способствуют смещению
равновесия в экзотермической реакции
образования сероводорода из простых веществ в
сторону образования продукта реакции?
Ответ. Для реакции
Н2 (г.) + S (тв.) ![]() Н2S (г.) + Q
Н2S (г.) + Q
смещению равновесия в сторону
образования Н2S способствуют:
а) охлаждение; б) увеличение концентрации Н2;
в) вывод Н2S из реакции.
4. Для каких из указанных реакций повышение
давления приведет к смещению равновесия в том же
направлении, что и понижение температуры?
а) N2 + O2 ![]() 2NO – Q;
2NO – Q;
б) CO2 + C ![]() 2CO – Q;
2CO – Q;
в) 2CO + O2 ![]() 2CO2 + Q;
2CO2 + Q;
г) CO + H2O (г.)![]() CO2 + H2 + Q.
CO2 + H2 + Q.
Ответ. б, в.
Комбинированные задачи повышенной
сложности
1. Один моль смеси пропена с водородом,
имеющей плотность по водороду 15, нагрели в
замкнутом сосуде с платиновым катализатором при
320 °С, при этом давление в сосуде уменьшилось
на 25%. Рассчитать выход продукта гидрирования в
процентах от теоретического.
Ответ. 83,3%.
2. Пары этаналя смешали с водородом в
молярном отношении 1:2 при давлении 300 кПа и
температуре 400 °С в замкнутом реакторе,
предназначенном для синтеза этанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 20%.
Определить объемную долю паров этанола в
реакционной смеси и процент превращения
уксусного альдегида в этанол.
Ответ. Объемная доля паров этанола
в конечной реакционной смеси – 25%,
степень превращения альдегида в этанол – 60%.
3. При нагревании до некоторой температуры 36
г уксусной кислоты и 7,36 г безводного этанола в
присутствии серной кислоты получена равновесная
смесь. Эта смесь при действии избытка раствора
хлорида бария образует 4,66 г осадка, а при
действии избытка раствора гидрокарбоната калия
выделяет 12,1 л углекислого газа (н.у.). Найти
количество сложного эфира в равновесной смеси.
Ответ. 0,1 моль.
4. Угарный газ смешали с водородом в
молярном соотношении 1:4 при давлении 10 МПа и
температуре 327 °С в замкнутом реакторе,
предназначенном для синтеза метанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 10%.
Определить объемную долю паров метанола в
реакционной смеси и процент превращения
угарного газа в метанол.
Ответ. Объемная доля паров метанола
в конечной реакционной смеси – 5,55%,
степень превращения угарного газа в метанол – 25%.
§ 2.1.4. Скорость химических реакций
Раздел химии, изучающий скорости химических реакций называется химической кинетикой.
Если под скоростью движения подразумевают векторную величину 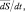 где t – время; S – вектор перемещения, то скоростью химической реакции по веществу А (v(А)) называется скалярная величина
где t – время; S – вектор перемещения, то скоростью химической реакции по веществу А (v(А)) называется скалярная величина 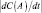 ,
,
где С(А) – концентрация или масса реагирующего вещества. Другими словами, если под скоростью движения подразумевают скорость направленного приращения расстояния, то скоростью химической реакции по веществу А называется абсолютное значение скорости приращения концентрации или массы вещества А. Например, если скорость реакции
2NO + O2 = 2NO2
по кислороду равна 0,01 моль/л∙с[20], то при тех же самых условиях скорость этой же реакции по NO окажется равной 0,02 моль/л∙с, потому что, согласно уравнению реакции, оксида азота (II), расходуется в 2 раза больше, чем кислорода. При этом, скорость реакции по оксиду азота (IV) также равна 0,02 моль/л∙с. Во избежание зависимости значения скорости от выбора вещества пользуются понятием «скорость химической реакции».
Скоростью химической реакции (v) называется скалярная величина 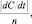 где n – стехиометрический коэффициент при реагирующем веществе или продукте реакции. Иными словами, скоростью химической реакции называется отношение скорости химической реакции по веществу к стехиометрическому коэффициенту этого вещества. Для рассмотреной реакции v = 0,01 моль/л∙с независимо от того, расход какого из реагирующих веществ измеряется. Скорость реакции, определённая по образованию продукта реакции, при этом окажется равной также 0,01 моль/л∙с.
где n – стехиометрический коэффициент при реагирующем веществе или продукте реакции. Иными словами, скоростью химической реакции называется отношение скорости химической реакции по веществу к стехиометрическому коэффициенту этого вещества. Для рассмотреной реакции v = 0,01 моль/л∙с независимо от того, расход какого из реагирующих веществ измеряется. Скорость реакции, определённая по образованию продукта реакции, при этом окажется равной также 0,01 моль/л∙с.
В простейших случаях мономолекулярных реакций твёрдых веществ, т. е. в случаях превращений молекул твёрдых веществ без взаимодействия с другими веществами, концентрация представляет собой неизменную плотность. Поэтому скорость таких реакций иногда определяют через изменение массы m:
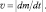
Например, для реакции[21] Cu(OH)2(к.) = СuО + H2О
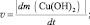
для реакции 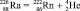
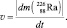
Равенства с Cu(OH)2 описывают реакцию разложения, протекающую без изменения состава ядер атомов. Равенства с 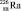 представляют реакцию распада, протекающую с разрушением ядра атома. В обоих случаях скорость процесса пропорциональна массе m разрушающегося вещества:
представляют реакцию распада, протекающую с разрушением ядра атома. В обоих случаях скорость процесса пропорциональна массе m разрушающегося вещества:
v = km, (2.10)
где k – константа скорости химической реакции. Причём, константа скорости реакции распада называется постоянной распада. Выражение (2.10) иначе можно записать так:
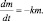
Строго говоря, величина 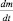 уже не является скоростью химической реакции, поскольку приведена без модуля. Величина
уже не является скоростью химической реакции, поскольку приведена без модуля. Величина 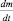 – представляет собой отрицательное изменение (уменьшение) массы во времени, т. е.
– представляет собой отрицательное изменение (уменьшение) массы во времени, т. е. 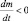 .
.
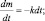
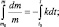
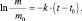
Полагая, что t0 = 0, можно записать m = mо∙e–kt.
Поскольку m = NM; m0 = N0M, где М – молекулярная масса вещества; N0 и N – количество молекул вещества в начальный момент времени и по истечении времени t соответственно, то можно записать
N = No∙ e–kt. (2.11)
Обозначив время, в течение которого разлагаются или распадаются половина молекул (период полураспада) через Т, последнее равенство можно преобразовать:
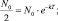
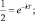
kT = ln2.
Если равенство (2.11) представить в виде
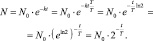
То, получается, что
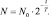 (2.12)
(2.12)
Равенства (2.11) и (2.12) представляют собой две формы закона радиоактивного распада, широко используемого при изучении реакций самопроизвольного распада радиоактивных элементов, таких как уран, нептуний, плутоний и др. Радиоактивными их стали называть из-за радиации, нередко сопровождающей распад[22]. Критерием устойчивости таких элементов как раз и является период полураспада. Как видно из предыдущих рассуждений, закон радиоактивного распада представляет собой лишь частный случай законов химической кинетики.
Следует отметить, что скорости мономолекулярных реакций разложения газообразных и растворённых веществ пропорциональны концентрации C лишь при небольших значениях концентраций. В частности, скорость разложения водного раствора гидроксида меди подчиняется равенству:
v = kC (2.13)
только при невысоких значениях С.
Из (2.10) и (2.13) следует, что 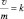 или
или 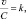 где
где  или
или  – удельная скорость химической реакции.
– удельная скорость химической реакции.
Удельная скорость мономолекулярных химических реакций постоянна, т. е. не зависит от массы или концентрации вещества.
Понятие «удельная скорость» применимо только к мономолекулярным процессам и неприменимо к реакциям, протекающим в результате столкновения молекул различного состава. Поэтому, в дальнейшем будем анализировать только скорость, не прибегая к рассмотрению удельной скорости.
Скорость реакций распада не зависит от температуры. Скорости же химических реакций, не сопровождающихся изменением состава ядра, в том числе и реакций разложения, зависят от температуры. Установлено, что при повышении температуры на каждые 10 °С скорость большинства таких реакций увеличивается в 2–4 раза.
Рассмотренные выше процессы относятся к реакциям первого порядка, т. к. их скорости зависят от концентрации (или массы) вещества в первой степени.
Скорости бимолекулярных реакций растворённых или газообразных веществ, т. е. скорости превращений, протекающих в результате химического взаимодействия двух молекул разных веществ А и В описываются равенством:
v = k [A] [B],
где [A] и [B] – концентрации веществ А и В соответственно, k константа скорости химической реакции. Например, для процесса
H2 + I2 = 2HI;
v = k [H2] [I2]. (2.14)
Тримолекулярные реакции протекают в результате столкновения трёх молекул[23], например:
2NO + O2 = 2NO2.
Скорость приведённой реакции описывается равенством
v = k [NO]2∙[O2]. (2.15)
На основании равенств (2.13)–(2.15) был сформулирован закон действия масс, который гласит: «Скорость простейшей (элементарной) реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам». При этом под элементарными подразумеваются реакции, протекающие в одну стадию. Показатель степени концентрации вещества в уравнениях для скорости химической реакции принято называть порядком реакции по этому веществу. Сумма порядков реакции называется общим порядком реакции. Например, порядок реакции (2.14) по водороду равен единице, по йоду – тоже единице. Общий порядок этой реакции равен двум, поэтому она относится к реакциям второго порядка. Порядок реакции (2.15) по NO равен двум, а по кислороду равен единице. Общий порядок реакции (2.15) равен трём, поэтому она относится к реакциям третьего порядка. Однако, следует иметь в виду, что реакции, описанные уравнениями (2.8) и (2.9) не могут быть простыми, потому что для этого необходимо столкновение десяти или даже четырнадцати молекул. Причём, трёх различных веществ. Вероятность такого события, практически равна нулю. Скорости реакций (2.8) и (2.9) не подчиняются закону действия масс в его классической формулировке, потому что протекают по сложному механизму, представляющему собой последовательность многочисленных мономолекулярных, бимолекулярных, тримолекулярных реакций. Общий порядок реакций, подчиняющихся закону действия масс, не может превышать 3.
В общем случае скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, определяемых экспериментально. То есть, для реакций (2.8) и (2.9) можно записать:
v = k∙[KMnO4]a∙[Na2SO3]b∙[H2SO4]C; (2.16)
v = k∙[K2Cr2O7]f∙[H2SO4]g∙[KI]h, (2.17)
где a, b, c, f, g, h – экспериментально определяемые порядки реакций по соответствующему веществу, отличные от их стехиометрических коэффициентов.
Следует подчеркнуть, что уравнения (2.14)–(2.17) справедливы для процессов протекающих в растворе или газовой фазе. Если же взаимодействующие вещества находятся в твёрдом состоянии, например
Fe + S = FeS,
то скорость реакции прямо пропорциональна поверхности реагирующих веществ. На величину константы скорости большое влияние оказывает присутствие катализаторов и ингибиторов. Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами. Вещества, которые замедляют скорость химических реакций, называют ингибиторами. Например, реакция 2SO2 + O2 = 2SO3 протекает значительно быстрее в присутствии V2O5. А окисление металлических изделий (коррозия), соприкасающихся с растворами, может быть предотвращено добавлением таких ингибиторов как NaNO2, K2CrO4, K2Cr2O7, Na3PO4 и др.
Примеры решения задач
1. Для реакции, подчиняющейся закону действия масс, определить во сколько раз изменится скорость реакции, если концентрацию первого вещества увеличить в 2 раза, а концентрацию второго уменьшить в 2 раза?
N2 + 3H2 = 2NH3;
2СО + О2 = 2СО2.
Прежде чем приступить к решению задачи необходимо определиться какая из двух реакций подчиняется закону действия масс. Общий порядок первой реакции равен 4. Поэтому она не может подчиняться закону действия масс. Общий порядок второй реакции равен трём. Значит, именно реакция окисления угарного газа подчиняется закону действия масс.
|
Дано:
|
Решение: v = k [CO]2∙[O2];
|
|
|
Ответ: 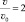 .
.
2. Определить постоянную распада k калифорния (Сf) если период его полураспада T равен одному году. Сколько нераспавшегося калифорния останется от 1 кг через 1,5 года хранения.
|
Дано: Т = 1 год t = 1,5 года mо = 1 кг |
Решение: Взаимосвязь постояной распада и периода полураспада любого радиоактивного вещества определяется равенством kT = ln2. |
|
k – ? m – ? |
Следовательно
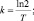
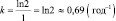 .
.
I способ нахожения m
m = mо∙e–kt;
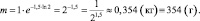
II способ нахождения m
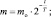
m = 1∙2–1,5 ≈ 0,354 (кг) ≡ 354 (г).
Ответ: k ≈ 0,69 год–1; m ≈ 354 г.
Задачи для самостоятельного решения
1. Для реакции, подчиняющейся закону действия масс, определить во сколько раз изменится скорость реакции, если концентрации обоих реагирующих веществ увеличить в 3 раза?
СО2 + H2 = CO + H2O;
2С2Н2 + 5О2 = 4СО2 + 2Н2О.
2. Определить постоянную распада кюрия (Сm) если период его полураспада равен 106 лет. Сколько не распавшегося кюрия останется от 300 г. через 500 000 лет.
3. Определить размерность и значение константы скорости для каждой из следующих химических реакций:
А → С;
А + В = С;
2А + В = С,
если во всех трёх случаях:
– реакции подчиняются закону действия масс;
– d[C]/dt = 0,5 моль/л∙с;
– [A] = 0,2 моль/л.
В последних двух реакциях [В] = 0,3 моль/л.
1. Что такое химическая кинетика? Дайте определение скорости химической ре акции по веществу и скорости химической реакции.
2. Что такое мономолекулярная реакция? Бимолекулярная? Тримолекулярная? Приведите конкретные примеры. Возможно ли протекание тетрамолекулярных и пентамолекулярных реакций?
3. Сформулируйте закон действия масс и расскажите о границах его применимости.
4. Как влияют на скорость химической реакции температура, катализаторы, ингибиторы?
Методы определения
порядка реакции.
I. Метод подстановки.
Основным условием в данном методе
является независимость константы
скорости от времени протекания реакции:
k![]() .
.
Пусть при изучении скорости протекания
реакции мы имеем следующие данные убыли
концентрации исходного вещества:
|
|
0 |
5 10 |
10 |
15 |
|
c |
c |
c |
c |
c |
Экспериментальные данные подставляются
в одно из известных кинетических
уравнений и критерием правильности
выбранного уравнения является постоянство
константы скорости во времени.
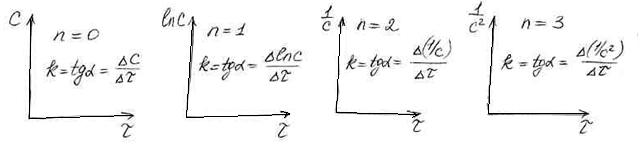
n=0 k=![]()
n=1 k=![]()
n=2 k=![]()
n=3 k=![]()
Методом подстановки можно определить
порядок реакции, если он имеет целочисленное
значение.
II. Графический метод.
Здесь также основным условием является
независимость константы скорости от
времени протекания реакции: k![]() .
.
Зависимость концентрации от времени
для реакций различных порядков может
быть выражена прямой линией, если выбрать
соответствующую систему координат.
Уравнение прямой выглядит следующим
образом: y=ax+в,
где в – это постоянная, равная тангенсу
угла наклона этот прямой: в=tg![]() .
.
Например, n=1 (реакция
первого порядка)
k =![]() ;
;
k![]() =
=
lnc![]() –
–
lnc;
lnc = lnc![]() -k
-k![]() .
.
Это уравнение будет уравнением прямой
в координатах lnc(![]() ),
),
когда k не будет
зависеть от
![]() .
.
Из графика легко определяется константа
скорости реакции:
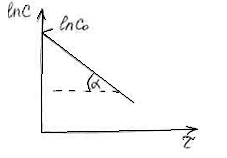
tg![]() =k=
=k=![]()
Таким образом, смотря в каких координатах
зависимости концентрации от времени
мы получим прямую, такой порядок имеет
химическая реакция.
III. Метод половинного
превращения.
Этот метод основан на том, что время
полупревращения для реакций различного
порядка по-разному зависит от начальной
концентрации реагентов:
![]() .
.
n=0:
![]() .
.
Для реакций нулевого порядка время
полупревращения прямо пропорционально
начальной концентрации реагента.
n=1:
![]() ;
;
![]()
. Для реакций первого порядка время
полупревращения не зависит от начальной
концентрации реагента.
n=2:
![]() .
.
Для реакций второго порядка время
полупревращения обратно пропорционально
начальной концентрации реагента.
n=3:
![]() .
.
Для реакций третьего порядка время
полупревращения обратно пропорционально
квадрату начальной концентрации
реагента.
В общем случае время полупревращения
равно:
n![]() 1
1
![]() (1)
(1)
;
![]()
(2)
Прологарифмируем уравнения (1) и (2) и
получим:
![]()
Таким образом, строя зависимость
![]()
от lnc![]() ,
,
по тангенсу угла наклона можно определить
порядок реакции.
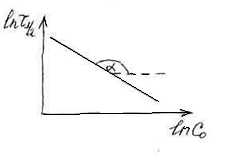
tg![]()
IV.
Метод Вант-Гоффа.
Этот метод позволяет определить дробный
порядок реакции.
Метод Вант-Гоффа заключается в следующем.
Проводится два опыта, в которых начальные
концентрации вещества, по которому
определяется порядок реакции, равны c![]()
и c![]()
(концентрации других веществ во много
раз больше). Тогда скорости реакции в
первом и втором опытах будут равны:
![]() ;
;![]() ;
;
n – порядок реакции.
![]() ;
;![]()
Поделим эти уравнения и получим:
n=![]()
Для решения этого уравнения необходимо
найти значения скоростей в момент
времени
![]()
и
![]()
![]() .
.
Скорости определяют графически из
наклона касательной в точке соответствующей
кинетической кривой.

![]()
![]()
V. Метод избытков
Оствальда (метод понижения порядка
реакции).
С помощью этого метода определяется
частный порядок по одному или нескольким
веществам вследствие понижения общего
порядка, т.к. взят избыток одного из
реагентов. Частный порядок определяется
четырьмя выше перечисленными методами.
Например, процесс инверсии сахарозы в
водном растворе представим следующим
образом:
C![]()
избыток
![]()
Порядок этой реакции должен быть вторым,
но избыток реагента – воды приводит к
тому, что ее концентрацию можно принять
равной единице (С![]() .
.
![]()
Экспериментально
определенный порядок этой реакции –
первый (![]() .
.
Рассмотрим реакцию
![]() +B
+B![]() P
P
![]()
![]()
Сначала в избытке возьмем вещество А.
Тогда скорость реакции будет пропорциональна
только концентрации вещества В, поэтому
можно определить порядок по веществу
В (![]() ).
).
Затем в избытке возьмем вещество В.
Тогда скорость реакции будет пропорциональна
только концентрации вещества А, поэтому
можно определить порядок по веществу
А (![]() .
.
А+![]()
общий
порядок будет равен сумме порядков
![]()
n![]()
по
отдельным компонентам (![]()
Пример.
Приведем пример определения порядка
реакции превращения цианата аммония в
карбамид (мочевину) NH![]() CNO
CNO![]()
по времени полупревращения
![]() ,
,
который в зависимости от исходной
начальной концентрации изменяется
следующим образом:
C![]() ,
,
моль/л 0,05 0,10 0,20
![]() ,
,
ч 37,03 19,15 9,45
Рассчитаем константу скорости реакции
для первого порядка, используя время
полупревращения.
 ;
;
![]() =
=![]()
n=1
![]()
![]()
Реакция не первого порядка, т.к. константа
скорости монотонно возрастает.
Рассчитаем константу скорости реакции
второго порядка.
k=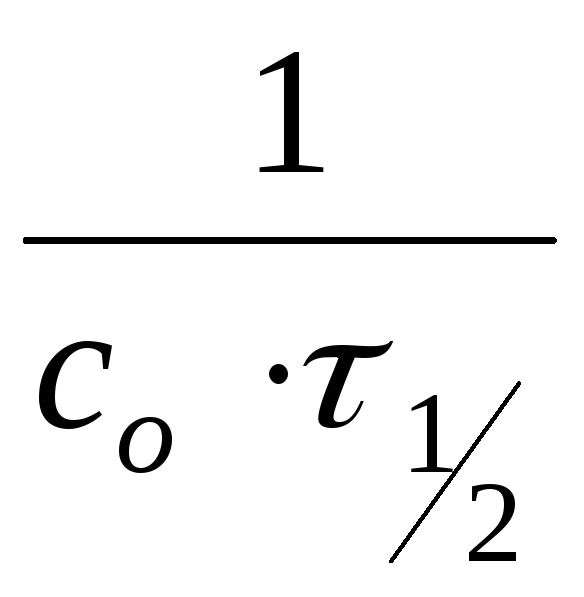 ;
;
k![]() =
=![]()
![]()
n=2 k![]()
![]()
k![]()
![]()
Так как константа скорости почти
постоянна, можно считать,
что это реакция второго порядка.
Кинетика сложных химических реакций.
Сложными называются реакции,
состоящие из нескольких простых.
Все многообразие сложных реакций
можно свести к различным комбинациям
простых (элементарных) реакций.
Суммарное кинетическое
уравнение таких реакций обычно содержит
несколько констант скоростей.
Типичными сложными реакциями
являются обратимые, параллельные,
последовательные и сопряженные
реакции.
1. А+В![]() С
С
обратимые
2. А![]()
![]()
параллельные
3. А![]()
последовательные
4. А![]()
сопряженные, т.е. одна
реакция не идет без другой
А![]()
1. Кинетика обратимых реакций.
Обратимыми называются реакции,
которые протекают одновременно в двух
противоположных направлениях. Наиболее
простой тип обратимых реакций – это
обратимые реакции первого порядка:
А![]() В
В
Обозначим, начальная концентрация
исходного вещества А: C![]() ;
;
концентрация продукта В в момент времени
![]() ;
;
концентрация исходного вещества А в
момент времени
![]() ,
,
т.к. в реакции данного типа исчезновение
определенного количества молекул
вещества А вызывает образование точного
такого же количества молекул вещества
В.
Воспользуемся постулатами химической
кинетики:
I постулат – если
протекает одновременно несколько
реакций, то каждая из них независима от
остальных.
Концентрация продукта В изменяется как
за счет прямого, так и обратного процесса.
Поэтому dx=dx![]() +dx
+dx![]() ,
,
где
dx![]() –
–
изменение концентрации вещества В в
результате прямой реакции;
dx![]() –
–
изменение концентрации вещества В в
результате обратной реакции.
Напишем кинетические уравнения прямой
и обратной реакции, используя концентрацию
продукта В:
![]()
![]()
Скорость суммарной реакции равна:
![]()
Разделим переменные, проинтегрируем
это выражение и получим:
![]()
(*)
При равновесии, когда скорость прямой
и обратной реакции равны (![]() ,
,
dx/![]() ,
,
тогда
![]() ,
,
где
![]() –
–
концентрация продукта В при равновесии.
Тогда уравнение (*) запишется в виде:
![]()
(**)
Совместно решая уравнения (*) и (**),
получим:
k![]() =
=![]()
Таким образом, для расчета скорости
обратимой реакции необходимо знать
исходные и равновесные концентрации
реагентов.
Кинетические кривые для обратимых
процессов.
Рассмотрим кинетические кривые для
обратимой реакции первого порядка.
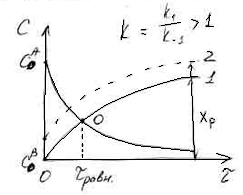 1.c
1.c![]()
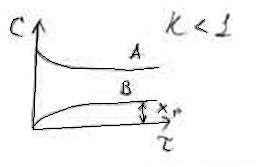
2.c![]()
В отсутствии обратимой реакции
концентрация исходного вещества А по
мере увеличения времени реакции
становится равной нулю. В случае обратимой
химической реакции концентрация вещества
А снижается, но не достигает нуля.
Концентрация продукта В в начале реакции
равна нулю (кривая 1), а затем увеличивается.
В точке О кривые пересекаются и СА=СВ,
т.е.
![]() С
С
= СА – СВ = 0. Это означает, что
скорость обратимой реакции равна нулю
(![]() ).
).
Время, соответствующее точке О, является
временем достижения равновесия обратимой
химической реакции.
Если начальная концентрация продукта
В не равна нулю, то достижение химического
равновесия обратимой реакции произойдет
быстрее, на что указывает точка пересечения
кривой 2 и кривой убыли исходного вещества
А.
2. Кинетика
параллельных реакций.
Реакции называются параллельными,
если исходные вещества одновременно
реагируют в нескольких направлениях.
Примером односторонних параллельных
реакций является реакция разложения
бертолетовой соли, протекающая при не
очень интенсивном нагревании в двух
направлениях:
6KClO![]()
Если параллельно протекают две
мономолекулярные реакции:
![]()
x=y+z
Обозначим: С0А =а – начальная
концентрация исходного компонента А;
х – количество прореагировавшего
вещества А, независимо от того, в какой
продукт оно превратилось; у – количество
вещества, превратившегося в первый
продукт реакции В; z – во
второй продукт реакции С.
Для каждой реакции можно записать:
![]()
![]()
Полная скорость превращения исходного
вещества равна сумме двух скоростей:
![]()
После интегрирования получим:
![]()
Для констант равновесия параллельных
реакций первого порядка можно записать
следующие выражения:
k![]()
k![]()
В параллельных реакциях первого порядка
отношение количества прореагировавшего
вещества в каждой из реакции в любой
момент времени постоянно и равно
отношению констант скоростей этих
реакций:
![]()

При изучении параллельных реакций
определяют сумму констант скоростей
по убыли вещества, а по отношению
концентраций образовавшихся веществ
– отношение констант скоростей. После
этого находят величины констант
скоростей отдельных реакций.
Кинетические кривые для параллельных
реакций практически такие же, как
для обратимых реакций.
Соседние файлы в папке Лекции по ФХ 2 семестр
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
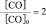
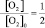
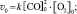
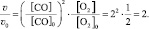
 – ?
– ?