В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
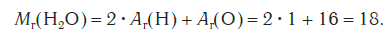
Относительная молекулярная масса серной кислоты H2SO4:

Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
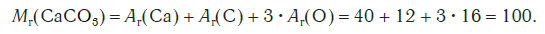
Относительная формульная масса вещества Al2(SO4)3 равна:
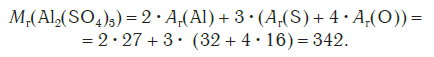
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
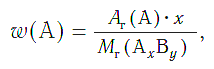
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер

[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Практическое занятие №1
Вычисление относительной молекулярной массы вещества, определение массовой доли элемента в сложном веществе. Нахождение формулы вещества по значениям массовой доли элементов.
Цель работы: На практике закрепить знания об относительной атомной и молекулярной массе, массовой доле элемента в сложном веществе в решении упражнений и задач по вычислению относительной молекулярной массы (задание №1), вычислению массовых отношений элементов (задание №2), массовых долей элементов (задание №3) в соединениях, нахождение формулы вещества по содержанию массовых долей элементов в соединении (задание № 4)
I.Вычисление относительной молекулярной массы
Теоретическое обоснование
1.Относительная молекулярная масса равна сумме всех относительных атомных масс элементов с учетом индекса элемента. Относительная молекулярная масса соединения величина безразмерная. Она показывает во сколько раз относительная молекулярная масса соединения больше 1/12 массы изотопа углерода-12.
2.Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов образующих соединение.
Мr = n1 *Аr1 + n2* Ar2 + n3* Ar3
Задание №1
Вычислите относительную молекулярную массу сульфата алюминия, химическая формула которого Al2(SO4)3.
Алгоритм решения
|
Дано: Al2(SO4) 3 |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав сульфата алюминия: Ar(Al)=27 2.Записываем формулу расчета Мr (Al2(SO4) 3) в общем виде: Мr (Al2(SO4) 3) = n1 *Аr (AI) + n2* Ar(S) + n3* Ar(O) n1– число атомов (моль атомов алюминия) n2– число атомов (моль атомов серы) n3– число атомов кислорода (моль атомов кислорода) 2.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем. Мr (Al2(SO4) 3 )= 27 * 2 + (32 + 16*4) * 3 = 342 |
|
Мr (Al2(SO4) 3)-? |
Ответ: Мr (Al2(SO4) 3) =342 Не забывайте, что Мr величина безразмерная |
Задание № 1 (для учащихся) Вычислите относительные молекулярные массы:
Вариант 1: оксида железа (III) Fe2O3, гидроксида кальция Ca(OH)2,
Вариант 2: нитрата меди (II) Cu(NO3)2, глицерина C3H8O3,
Вариант 3: оксида углерода (IV) CO2, азотной кислоты HNO3,
Вариант 4: гидроксида алюминия Al(OH) 3, карбоната калия K2CO3.
II.Вычисление отношения масс атомов элементов в сложном веществе по его формуле
Теоретическое обоснование
Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовые соотношения этих элементов
|
Задание №2 Вычислите массовые отношения элементов в серной кислоте Алгоритм решения |
|
|
Дано: H2SO4 |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав серной кислоты: Ar(Н)=1, Ar(S)=32, Ar(O)=16 2.Вычисляем массовые отношения элементов в молекуле серной кислоте: В молекуле серной кислоте: 1*2 часть приходиться на атомы H (так как два атома) 32 части – на атомы S (так как один атом) 16 *4 =64 части – на атомы О (так как четыре атома) 2.Определим, как они относятся к друг другу в массовом соотношении: H : S : O = 2: 32 : 64 = 1 : 16 : 32 1+16+32=49 Это означает,что 49 мас.частей серной кислоты приходится: 1 мас.ч. Н, 16 мас. ч. S, 32 мас. ч. О |
|
Определить: Аr(Н):Аr(S):Аr(O) |
Ответ: 1:16:32 |
Задание № 2 (для учащихся) Вычислите массовые доли элементов в соединении
Вариант 1: в перманганате калия КМnО4.
Вариант 2: в карбонате магния MgCO3.
Вариант 3: в сульфиде железа FeS.
Вариант 4: в бромиде железа FeВr3.
III.Вычисление массовой доли элементов в соединение
Теоретическое обоснование занятия
Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
n·Ar(элемента)
w(элемента) = ——————————- *100 %
Mr(вещества), (5)
где
w – массовая доля элемента в веществе, Ar– относительная атомная масса,
n– индекс в химической формуле, Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях: w (элемента) = 20% или 0,2.
Задание № 3
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
АЛГОРИТМ РЕШЕНИЯ
|
Дано: Фосфорная кислота H3PO4 |
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты Ar(H)=1, Ar(P)=31, Ar(O)=16 2.Записываем формулу расчета в общем виде Mr(H3PO4): Mr(H3PO4) = n1*Ar(H) +n2*Ar(P) + n3*Ar(O) 3.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем: Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) для водорода: w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% для фосфора: w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% для кислорода: w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка: Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100% Подставляем значения: 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
|
Найти: w%(H) w%(P) w%(O) |
Ответ: w(H) = 3,06% w(P) = 31,63% w(O) = 65,31% |
Задание №3
Вариант 1: Вычислить массовую долю азота в нитрате кальция (Ca(NO3)2
Вариант 2: Вычислите содержание кислорода в перманганате калия (KMnO4)
Вариант 3: Вычислите содержание серы в минерале пирите (FeS2)
Вариант 4: Вычислите массовую долю серебра в оксиде серебра (Ag2O)
IV.Нахождение формулы вещества по содержанию массовых долей элементов
Теоретическое обоснование
1.Задачи на вывод формулы вещества по данным химического анализа относится к группе задач, которые решаются по формулам.
2. Для решения задач данного типа необходимо знать массовые доли элементов, которые входят в состав соединения.
3.Также необходимо знать, что общее содержание веществ в соединении равно 100%. Поэтому иногда в условии задачи указывается содержание не всех элементов, с учетом того, что неизвестное содержание второго или третьего элемента всегда можно определить.
|
Задача 4. Установите формулу вещества, которое состоит из углерода (w=25%) и алюминия (w=75%). АЛГОРИТМ РЕШЕНИЯ |
|
|
Дано: w(С)=25% (0.25 ) w(Аl)=75% (0.75) |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов Al, С: M(Al)=27 , М(С)=12 , значит. молярные массы веществ равны соответственно: M(Al)=27 г/моль, М(С)=12 г/моль 2.Из условия задачи нам известно, что w(С)=25% (0.25 ) и w(Аl)=75% (0.75), значит в 100 г вещества содержится: m(AI)=27 г и m(C)=25г 3.Определим, сколько количества вещества содержится в 27 г. алюминия:n(Al) : – для этого воспользуемся формулой нахождения количества вещества: n(Al)= m(AI)/ M(Al) -подставляем значения в формулу и рассчитываем: n(Al)= 75 г / 27 г/моль =2,78 моль 4.Определим, сколько количества вещества содержится в 25 г. углерода: – для этого воспользуемся формулой нахождения количества вещества: n(C)=m(C)/M(C) -подставляем значения в формулу и рассчитываем: n (C) = 25г / 12 г/моль = 2,08 моль n (C) n(AI): n(C)= 2.78 : 2,08 Получившийся результат выражается десятичными числами, поэтому необходимо привести результат к целым. а)принимаем меньшее число условно за 1 и производим операцию деления деления большего числа на меньшее и получаем: 2,78 : 2,08=1,34:1 б)в результате деления снова получили десятичное число, следовательно нужно искать получившийся результат последовательным делением меньшего числа на натуральные числа:: 2,3,4,5 и т.д до тех пор пока полученная при делении величина не будет укладываться в большем числе целое количество раз. 2,08 : 2. = 1,04 2,78: 1,04 = 2,67 : 1 2,08 :3 = 0,69 2,78 :0,69 = 4 : 3 Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно. |
|
Найти: AlхCу |
Ответ: Al4C3 (карбид алюминия). |
Задание № 4
Вариант 1:
В состав химического вещества входят кальций (массовая доля 29,4%),сера (23,5%) и кислород (47,1%). Установите формулу этого вещества.
Вариант 2:
Массовая доля серы в соединении с кислородом равна 40%. Выведите формулу этого вещества.
Вариант №3:
В соединении калия, хлора и кислорода массовые доли элементов равны соответственно 31,8, 29,0, 39,2%.Установите формулу этого вещества.
Вариант №4:
Массовая доля магния в его соединении с кислородом равна 60%. Определите формулу этого соединения.
§ 1.4. Молекулы. Формулы веществ. Относительная молекулярная масса. Массовая доля элемента в соединении
На данный момент известно около 120 разных химических элементов, из которых в природе можно обнаружить не более 90. Многообразие же различных химических веществ вокруг нас несоизмеримо больше этого числа.
Связано это с тем, что крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными — гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего, химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки.
То есть атомы большинства химических элементов способны связываться друг с другом. Чаще всего в результате этого получаются молекулы – частицы, представляющие собой группировки из двух или более атомов. Например, химическое вещество водород состоит из молекул водорода, которые образуются из атомов следующим образом:

Рисунок 3. Образование молекулы водорода
Образовывать связи друг с другом могут и атомы разных химических элементов, так, например, при взаимодействии атома кислорода с двумя атомами водорода образуется молекула воды:

Рисунок 4. Образование молекулы воды
Поскольку каждый раз рисовать атомы химических элементов и подписывать их неудобно, для отражения состава молекул были придуманы химические формулы. Так, например, формула молекулярного водорода записывается как Н2, где число 2, написанное подстрочным шрифтом справа от символа атома водорода, означает количество атомов данного типа в молекуле. Таким образом, формулу воды можно записать как H2O. Единица, которая должна показывать количество атомов кислорода в молекуле, согласно принятым в химии правилам, не пишется. Числа, обозначающие количества атомов в составе одной молекулы называют индексами.
Рассмотрим еще несколько примеров химических формул веществ. Так, формула аммиака записывается как NH3, что говорит о том, что каждая молекула аммиака состоит из одного атома азота и трех атомов водорода.
Нередко встречаются молекулы, в которых можно насчитать несколько одинаковых групп атомов. Например, из формулы сульфата алюминия Al2(SO4)3, можно сделать вывод о том, что в составе молекулы данного вещества находятся две группы атомов SO4.
Таким образом, химические формулы веществ однозначно характеризуют как их качественный, так и количественный состав.
Из всего вышесказанного логично вытекает закон постоянства состава вещества, установленный еще в 1808 году французским ученым Жозефом Луи Прустом, и звучит он следующим образом:
Любое чистое химическое вещество имеет постоянный качественный и количественный состав, не зависящий от способа получения этого вещества.
Поскольку любое химическое вещество является совокупностью молекул одинакового состава, это приводит к тому, что пропорции между атомами химических элементов в любой порции вещества такие же, как и в одной молекуле данного вещества. Все различия в химических свойствах веществ зависят от количественного и качественного состава молекул и кроме того, от порядка связей атомов между собой, если таковое возможно.
Таким образом, можно дать следующее определение термина молекула:
Молекула – это наименьшая частица какого-либо химического вещества обладающая его химическими свойствами.
Аналогично относительной атомной массе, существует также и такое понятие как относительная молекулярная масса Mr:
Относительная молекулярная масса (Mr) вещества это отношение массы одной молекулы этого вещества к одной двенадцатой массы одного атома углерода (1 атомной единице массы).
Таким образом, очевидно, что относительная молекулярная масса складывается из относительных атомных масс элементов, каждая из которых помножена на количество атомов данного конкретного типа в одной молекуле. Так, например, относительная молекулярная масса молекулы азотной кислоты HNO3 складывается из относительной атомной массы водорода, относительной атомной массы азота и трех относительных атомных масс кислорода:

Для описания качественного и количественного состава вещества используют такое понятие как массовая доля химического элемента w(X):
Массовая доля (ω) химического элемента в веществе — это отношение относительной атомной массы Ar(X) данного элемента, помноженной на число его атомов в молекуле, к относительной молекулярной массе Ar(X) данного вещества.

где ω(Х) — массовая доля элемента X; Аr(Х) — его относительная атомная масса; n — число атомов X в одной молекуле вещества; Мr — относительная молекулярная масса химического вещества.
Чаще всего, массовую долю химического элемента выражают в процентах, в этом случае формульное выражение массовой доли в процентах ω%(Х) будет иметь вид:
![]()
Рассчитаем в качестве примера массовые доли водорода, азота и кислорода в молекуле азотной кислоты (НNO3):

О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5/2006
Глава 2. Математика в химии
§ 10. Относительная атомная и
молекулярная массы
 Давайте
Давайте
внимательно посмотрим на таблицу Д.И.Менделеева
и выберем один из элементов. Например, обитатель
шестой «квартиры» – углерод. Что изображено в
этой клетке? Знак (символ) химического элемента и
его название. В верхнем левом углу – порядковый
номер элемента, под символом элемента – его
название. А что означает записанное под
названием число 12,011?
Это число называется относительной атомной
массой элемента, в нашем случае – углерода.
Как вы помните, одно из важнейших свойств
атомов химических элементов – их масса.
Статья опубликована при поддержке группы компаний “Евроинжиниринг”. Бензогенераторы, дизельгенераторы, снегоуборщики, блоки автоматического запуска, комплекты для ТО, предпусковые подогреватели, контейнеры для генераторов и другие товары от ведущих мировых производителей. Доставка по всей России, наличный и безналичный расчёт, гарантия качества. Доступна услуга выездного обслуживания бензиновых и дизельных генераторов. Всю подробную информацию Вы найдёте на сайте: http://energyprofessional.ru.
Размерность массы вам хорошо известна: ее
выражают в граммах, килограммах, миллиграммах.
Существуют, конечно, и другие единицы массы:
тонны, например, или центнеры. Однако в
повседневной жизни бывает удобно оперировать не
точной массой предмета, а сравнением ее с
чем-либо. Поскольку массы атомов и молекул
чрезвычайно малы, их сравнивают с массой атома
самого легкого элемента – водорода. Такое
сравнение позволяет утверждать, что масса атома
углерода в 12 раз больше массы атома водорода.
Масса атома кислорода больше массы атома
водорода в 16 раз, а масса атома железа – в 56 раз.
Величина, показывающая, во сколько раз масса
атома данного элемента больше массы атома
водорода, принятой за единицу, называется
относительной атомной массой элемента.
Относительную атомную массу элемента
обозначают символом Аr. Подстрочная
буква r – это первая буква английского слова relative,
что значит относительный. Например: Аr(Н) =
1,
Аr(С) = 12, Аr(N) = 14, Аr(О) = 16, Аr(Fe)
= 56, Аr(Cl) = 35,5.
Обычно относительные атомные массы всех
элементов округляют до целых чисел, кроме хлора
(Аr(Cl) = 35,5), хотя в таблице Д.И.Менделеева
они приведены с большей точностью.
Обратите внимание, что относительная атомная
масса хотя массой и называется, но размерности не
имеет.
Обладают ли массой молекулы веществ? Конечно!
Можете ли вы ответить на вопрос, во сколько раз
молекула воды тяжелее атома водорода? Это очень
просто: надо сложить относительные атомные массы
всех атомов, входящих в состав молекулы (рис. 56):
Mr(H2O) = 2Ar(H) + Ar(O)
= 2•1 + 16 = 18.
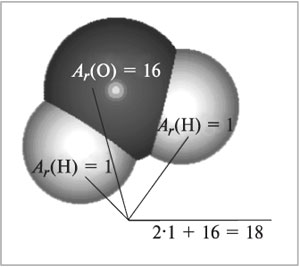 |
Рис. 56.
|
Величина Mr(H2O) – это относительная
молекулярная масса воды. Правильнее было бы
называть ее относительной формульной массой.
Во-первых, не все вещества состоят из молекул (мы
уже приводили в пример железо и графит).
Во-вторых, при расчете этой величины нужно
внимательно смотреть на формулу вещества и не
забывать про индексы, указывающие на число
атомов каждого элемента:
Mr(СH4) = Ar(С) + 4Ar(Н)
= 12 + 4•1 = 16,
Mr(SO2) = Ar(S) + 2Ar(O)
= 32 + 2•16 = 64.
Таблица относительных атомных масс Дж.Дальтона
была далека от совершенства, содержала довольно
много ошибок. Но благодаря ей стало возможным
определять формулы химических веществ по
соотношению масс входящих в их состав элементов.
Как это делалось, мы расскажем на следующем
уроке.
1.
Что такое относительная атомная масса? Почему
эта величина не имеет размерности?2. Что такое относительная молекулярная
масса? Как она рассчитывается?3. В состав молекулы фосфорной кислоты
входят три атома водорода, один атом фосфора и
четыре атома кислорода. Найдите относительную
молекулярную массу этого вещества.4. Рассчитайте относительные молекулярные
массы веществ по их формулам: Br2, H2O, CO2,
H2SO4, KOH, BaCl2. Значения
относительных атомных масс найдите по таблице
Д.И.Менделеева, округлите их до целых чисел (за
исключением хлора,
Ar(Cl) = 35,5).
5.
Атом серы образует с атомами кислорода два
сложных вещества (их называют оксидами) разного
состава. Относительная молекулярная масса
первого оксида равна 64, а второго – 80. Выведите
формулы этих оксидов.6. Не производя расчетов, а только на
основании значений относительных атомных масс
(найдите их по таблице Д.И.Менделеева) определите,
у какого из веществ, формулы которых приведены
ниже, наибольшая и наименьшая относительные
молекулярные массы: а) селеноводорода H2Se; б)
воды Н2О;
в) теллуроводорода H2Te; г) сероводорода H2S.
§11. Массовая доля элемента в сложном
веществе
С XVII в. химия перестала быть описательной
наукой. Ученые-химики стали широко использовать
измерение вещества. Все более
совершенствовалась конструкция весов,
позволяющих определять массы образцов. Для
газообразных веществ помимо массы измеряли
также объем и давление. Применение
количественных измерений дало возможность
понять сущность химических превращений,
определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества
входят два или более химических элементов.
Очевидно, что масса всего вещества слагается из
масс составляющих его элементов. Значит, на долю
каждого элемента приходится определенная часть
массы вещества.
Массовой долей элемента называется отношение
массы этого элемента в сложном веществе к массе
всего вещества, выраженное в долях единицы (или в
процентах):
![]()
Массовая доля элемента в соединении
обозначается латинской строчной буквой w
(«дубль-вэ») и показывает долю (часть массы),
приходящуюся на данный элемент в общей массе
вещества. Эта величина может выражаться в долях
единицы или в процентах. Конечно, массовая доля
элемента в сложном веществе всегда меньше
единицы (или меньше 100%). Ведь часть от целого
всегда меньше целого, как долька апельсина
меньше всего апельсина.
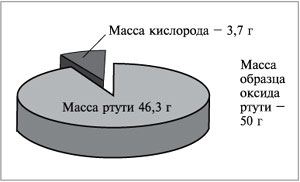
Например, в состав оксида ртути входят два
элемента – ртуть и кислород. При нагревании 50 г
этого вещества получается 46,3 г ртути и 3,7 г
кислорода (рис. 57). Рассчитаем массовую долю ртути
в сложном веществе:
![]()
|
|
Рис. 57.
|
Массовую долю кислорода в этом
веществе можно рассчитать двумя способами. По
определению массовая доля кислорода в оксиде
ртути равна отношению массы кислорода к массе
оксида:
![]()
Зная, что сумма массовых долей элементов в
веществе равна единице (100%), массовую долю
кислорода можно вычислить по разности:
w(O) = 1 – 0,926 = 0,074,
или
w(О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов
предложенным способом, необходимо провести
сложный и трудоемкий химический эксперимент по
определению массы каждого элемента. Если же
формула сложного вещества известна, та же задача
решается значительно проще.
Для расчета массовой доли элемента нужно его
относительную атомную массу умножить на число
атомов (n) данного элемента в формуле и
разделить на относительную молекулярную массу
вещества:
![]()
Например, для воды (рис. 58):
Mr(H2O) = 1•2 + 16 = 18,
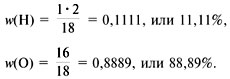
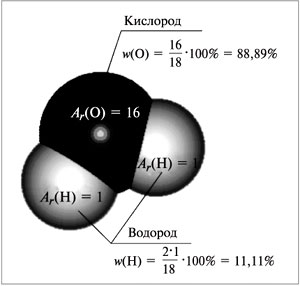 |
Рис. 58.
|
Далее рассмотрим решение задач на
вычисление массовых долей элементов в сложных
веществах.
Задача 1. Рассчитайте массовые доли
элементов в аммиаке, формула которого NH3.
Дано:
вещество аммиак NH3.
Найти:
w(N), w(H).
Решение
1) Рассчитаем относительную молекулярную массу
аммиака:
Mr(NH3) = Ar(N) + 3Ar(H)
= 14 + 3•1 = 17.
2) Найдем массовую долю азота в веществе:
![]()
3) Вычислим массовую долю водорода в аммиаке:
w(H) = 1 – w(N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w(N) = 82,35%, w(H) = 17,65%.
Задача 2. Рассчитайте массовые доли
элементов в серной кислоте, имеющей формулу H2SO4.
Дано:
серная кислота H2SO4.
Найти:
w(H), w(S), w(O).
Решение
1) Рассчитаем относительную молекулярную массу
серной кислоты:
Mr(H2SO4) = 2Ar(H)
+ Ar(S) + 4Ar(O) = 2•1 + 32 + 4•16 = 98.
2) Найдем массовую долю водорода в веществе:
![]()
3) Вычислим массовую долю серы в серной кислоте:
![]()
4. Рассчитаем массовую долю кислорода в
веществе:
w(O) = 1 – (w(H) + w(S)) = 1 – (0,0204 +
0,3265) = 0,6531, или 65,31%.
Ответ. w(H) = 2,04%, w(S) = 32,65%, w(O) = 65,31%.
Чаще химикам приходится решать обратную
задачу: по массовым долям элементов определять
формулу сложного вещества. То, как решаются
подобные задачи, проиллюстрируем одним
историческим примером.
Из природных минералов – тенорита и куприта –
были выделены два соединения меди с кислородом
(оксиды). Они отличались друг от друга по цвету и
массовым долям элементов. В черном оксиде
массовая доля меди составляла 80%, а массовая доля
кислорода – 20%. В оксиде меди красного цвета
массовые доли элементов составляли
соответственно 88,9% и 11,1%. Каковы же формулы этих
сложных веществ? Проведем несложные
математические расчеты.
Пример 1. Расчет химической формулы черного
оксида меди (w(Cu) = 0,8 и w(О) = 0,2).
1) Обозначим формулу вещества с помощью
индексов х, у – по числу атомов химических
элементов в его составе: СuxOy.
2) Отношение индексов равно отношению частных
от деления массовой доли элемента в соединении
на относительную атомную массу элемента:
![]()
3) Полученное соотношение нужно привести к
соотношению целых чисел: индексы в формуле,
показывающие число атомов, не могут быть
дробными. Для этого полученные числа разделим на
меньшее (т.е. любое) из них:
![]()
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида
меди по известным массовым долям w(Cu) = 88,9% и w(O)
= 11,1%.
Дано:
w(Cu) = 88,9%, или 0,889,
w(O) = 11,1%, или 0,111.
Найти:
формулу.
Решение
1) Обозначим формулу оксида СuxOy.
2) Найдем соотношение индексов x и y:
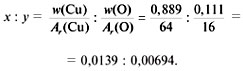
3) Приведем соотношение индексов к отношению
целых чисел:
![]()
Ответ. Формула соединения – Cu2O.
А теперь немного усложним задачу.
Задача 3. По данным элементного
анализа состав прокаленной горькой соли,
использовавшейся еще алхимиками в качестве
слабительного средства, следующий: массовая доля
магния – 20,0%, массовая доля серы – 26,7%, массовая
доля кислорода – 53,3%.
Дано:
w(Mg) = 20,0%, или 0,2,
w(S) = 26,7%, или 0,267,
w(O) = 53,3%, или 0,533.
Найти:
формулу.
Решение
1) Обозначим формулу вещества с помощью
индексов x, y, z: MgxSyOz.
2) Найдем соотношение индексов:

3) Определим значение индексов x, y, z:
![]()
Ответ. Формула вещества – MgSO4.
1.
Что называется массовой долей элемента в сложном
веществе? Как рассчитывается эта величина?2. Рассчитайте массовые доли элементов в
веществах: а) углекислом газе CO2;
б) сульфиде кальция СаS; в) натриевой селитре NaNO3;
г) оксиде алюминия Al2O3.3. В каком из азотных удобрений массовая
доля питательного элемента азота наибольшая: а)
хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4;
в) мочевине (NH2)2CO?
4.
В минерале пирите на 7 г железа приходится 8 г
серы. Вычислите массовые доли каждого элемента в
этом веществе и определите его формулу.5. Массовая доля азота в одном из его оксидов
равна 30,43%, а массовая доля кислорода – 69,57%.
Определите формулу оксида.
6. В средние века из золы костра выделяли
вещество, которое называли поташ и использовали
для варки мыла. Массовые доли элементов в этом
веществе: калий – 56,6%, углерод – 8,7%, кислород –
34,7%. Определите формулу поташа.
1
Единицей молекулярной массы является 1/12 массы атома углерода, которая условно принята за 12. Молекулярная масса численно равна суммарной относительной атомной массе всех атомов, входящих в молекулу, и её очень легко рассчитать.
2
Согласно закону Авогадро в одинаковых объемах газов при постоянном давлении и температуре будет содержаться одинаковое число молекул. Из него позже было выведено уравнение Менделеева-Клайперона. Сейчас вам потребуется им воспользоваться, но оно справедливо только для газообразных веществ! Подставьте в формулу известное вам давление и температуру, в результате получите молекулярную массу газа: M=(m∙R∙T)/(P∙V),где M – искомая молекулярная масса, m – масса вещества, R – универсальная газовая постоянная (принимать за 8,31 Дж/моль*К), T – температура в Кельвинах, P –давление в Паскалях, V – объём в кубических метрах.
Как видно, для этого способа требуется очень много данных, но зато погрешность таких расчетов минимальна.
Следующий способ намного проще. Если вам известна только масса вещества m и его химическое количество ν, то подставьте эти данные в формулу: M=m/ν,
где m – масса вещества (как правило, в граммах), а ν – количество вещества в молях.
4
А есть самый простой вариант, если вам известна химическая формула вещества. Возьмите таблицу Менделеева, посмотрите молекулярную массу каждого элемента, входящего в состав. Например, у водорода она равна 1, у кислорода – 16. А чтобы найти молекулярную массу всего вещества (возьмём для примера воду, которая состоит из двух молекул водорода и одной молекулы кислорода) просто сложите массы всех входящих в него элементов. Для воды: M(H2O) = 2M(H)+M(O) = 2•1+16 = 18 а. е. м.
Полезный совет
Как видим, найти молекулярную массу можно очень просто. Главное не путайте её с молярной массой вещества – они численно равны между собой, но имеют различные единицы измерения и физический смысл.