Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
Белки относятся
к высокомолекулярным соединениям, в
состав которых входят сотни и даже
тысячи аминокислотных остатков,
объединенных в макромолекулярную
структуру. Молекулярная масса белков
колеблется от 6000 (нижний предел) до
1000000 и выше в зависимости от количества
отдельных полипептидных цепей в составе
единой молекулярной структуры белка.
Такие полипептидные цепи называются
субъединицами. Их молекулярная масса
варьирует в широких пределах: от 6000 до
100000 и более. Для выражения молекулярной
массы белков используют также специальную
единицу – дальтон.
Дальтон (Да) –
единица массы, практически равная массе
атома водорода (т.е. 1,0000 по шкале атомных
масс). Терминами «дальтон» и «молекулярная
масса» пользуются как взаимозаменяемыми:
например, белок в 20000 дальтон имеет
молекулярную массу 20000. Наименование
дано в честь Джона Дальтона, разработавшего
атомарную теорию строения материи.
Килодальтон (кДа) – единица массы, равная
1000 дальтон. Масса большинства белков
лежит в пределах от 10 до 100 кДа.
Аминокислотный
состав и последовательность аминокислот
выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление
их молекулярной массы химическим путем
с высокой точностью. Однако для огромного
количества встречающихся в природе
белков химическое строение не выяснено,
поэтому основными методами определения
молекулярной массы все еще остаются
физико-химические методы (гравиметрические,
осмометрические, вискозиметрические,
электрофоретические, оптические и др.).
На практике чаще всего используются
методы седиментационного анализа,
гель-хроматография и гель-электрофорез.
При определении
молекулярной массы белков методами
седиментационного анализа используют
аналитические ультрацентрифуги (первая
ультрацентрифуга была сконструирована
в 1923 г. Т. Сведбергом), в которых удается
создать центробежные ускорения (g), в
200000 и более раз превышающие ускорение
земного притяжения. Обычно молекулярную
массу вычисляют по скорости седиментации
молекул белка или седиментационному
равновесию. По мере перемещения молекул
от центра к периферии образуется резкая
граница «растворитель-белок»
(регистрируется автоматически). Оптические
свойства растворителя и белка используются
при определении скорости седиментации;
которую выражают через константу
седиментации s, зависящую как от массы,
так и от формы белковой частицы:
v
S = —— ,
ω2 ∙ r
где v – скорость
перемещения границы растворитель-белок,
см/с; ω – угловая скорость ротора, рад/с;
r – расстояние от центра ротора до
середины ячейки с раствором белка, см.
Константа седиментации имеет размерность
времени (ее выражают в секундах). Величина
константы седиментации, равная 1·10–13
с, условно принята за единицу и названа
сведбергом (S). Значения констант
седиментации большинства белков лежат
в пределах 1–50 S, хотя в ряде случаев эти
значения превышают 100 S.
Для вычисления
молекулярной массы, помимо константы
седиментации, необходимы дополнительные
сведения о плотности растворителя и
белка и другие согласно уравнению
Сведберга:
RTS
M = ————
D (1- v ρ)
где R – газовая
постоянная, эрг/(моль∙гр.); Т – абсолютная
температура (по шкале Кельвина); S
– константа седиментации; ρ – плотность
растворителя; v – парциальный удельный
объем молекулы белка; D ‒ коэффициент
диффузии.
Определение
молекулярной массы белков методом
ультрацентрифугирования требует много
времени и дорогостоящей аппаратуры.
Поэтому в последние годы разработаны
простые методы (гель-хроматография и
электрофорез).
Гель-хроматографию
проводят при заполнении колонки пористым
гелем сефадекса. Через колонку пропускают
ряд белков с известной молекулярной
массой и строят график зависимости
логарифма молекулярной массы от значений
их элюционных объемов. Между логарифмом
молекулярной массы белка, имеющего
сферическую форму, и элюционным объемом
существует прямая зависимость. Легко
определить молекулярную массу исследуемого
белка, зная его объем элюции.
Второй разновидностью
этого метода является тонкослойная
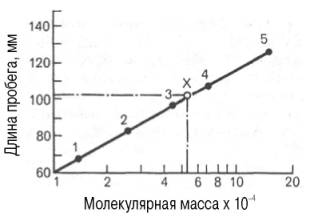
гель-хроматография. Длина пробега белка
через тонкий слой сефадекса находится
в логарифмической зависимости от его
молекулярной массы (рис.7.1).
Рис.7.1. Зависимость
между длиной пробега белковых частиц
при гель-хроматографии в тонком слое
сефадекса G-150
и их молекулярными массами
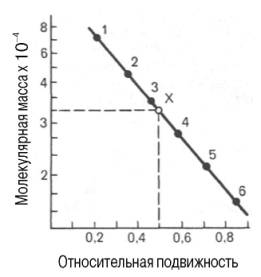
При использовании
диск-электрофореза в полиакриламидном
геле строят график зависимости между
логарифмом молекулярной массы
калибровочных белков и подвижностью
белковых частиц в полиакриламидном
геле, а затем, определив подвижность
исследуемого белка, по графику находят
его массу (рис.7.2).
Рис.7.2. Зависимость
между молекулярной массой и относительной
подвижностью белка при диск-электрофорезе
в полиакриламидном геле. присутствии
додецилсульфата натрия
Электрофорез
проводят в присутствии детергента –
додецилсульфата натрия (SDS), т.к. только
в этом случае наблюдается прямая
пропорциональная зависимость между
логарифмом молекулярной массы и
подвижностью белков.
Додецилсульфат
натрия
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
АЛГОРИТМ
ФОРМИРОВАНИЯ УМЕНИЙ
ИСПОЛЬЗОВАТЬ
ЗНАНИЯ ПРИ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ ПО МОЛЕКУЛЯРНОЙ БИОЛОГИИ
Одним
из важных задач школьного курса «Биология» является формирование у учащихся
общеучебных и специальных умений. Умение решать задачи – один из объективных
критериев оценки глубины усвоения материала.
Практическое
применение полученных знаний при решении задач способствует развитию
логического мышления, творческой, аналитическом подходе к решению поставленного
вопроса или проблемы в целом, что особенно важно для будущих работников
современных отраслей производства, сельского хозяйства, медицины.
Представленный
материал предназначен для учителей биологии, старшеклассников, абитуриентов.
единицы
измерения
В
биологии используются основные и производные единицы международной системы
единиц : длины, массы, энергии, работы, теплоты и т.д..
Единицы длины – метр (м).1 м = 10 дм = 100
см = мк = нм, 1 нм = м.
Единицы массы – килограмма (кг).1 кг = г
(г); 1 г = нг (нанограммов);
1 Дальтон – единица молекулярной массы,
равной массе атома водорода.
Единица энергии, работы и количества
теплоты – джоуль (Дж).
1 Дж = эрг = 0,2388 кал; 1 кал = 4,1868
Дж.
В процессе решения любой задачи выделяют
определенные этапы.
Анализ задачи.
Внимательно прочитайте содержание задачи, осмыслите ее и определите:
к какому разделу или теме относится
задача,
найдите, что дано и что необходимо
найти.
1. Сокращенная запись условия.
С помощью условных обозначений коротко
запищит, что дано и что нужно найти (как на уроках химии или физики).
Подумайте, какие из постоянных известных
вам величин можно использовать при решении задачи, запишите их.
2. Оформление записи задачи.
Место, что осталось после короткого записи
условия задачи, условно разделите на две части. В левой части запишите данные,
которые вы будете использовать, в правой – решение. Действий в задаче может
быть несколько. Записывайте их так: 1) …; 2) …; 3) … и т.д.
3. Решение задачи.
Решайте задачу поэтапно.
На каждом этапе кратко сформулируйте
вопрос.
Тщательно проверяйте результаты
расчетов.
Проверьте всю ли информацию из условия
задачи использовали.
При необходимости выберите другой способ
решения.
4. Завершающий этап.
Проверьте правильность решения в целом,
сформулируйте и запишите окончательный ответ.
Примеры решения задач на
молекулярные основы НАСЛЕДСТВЕННОСТИ
При
решении таких задач необходимо помнить, что:
•
длина одного нуклеотида, или расстояние между двумя соседними вдоль оси ДНК,
составляет 0,34 нм;
•
средняя молекулярная масса одного нуклеотида 345 условных единиц;
•
средняя молекулярная масса одной аминокислоты равна 100 условных единиц;
•
молекула белка в среднем состоит из 200 аминокислот;
•
каждую аминокислоту в белковой молекуле кодирует триплет нуклеотидов
и-РНК (во время трансляции);
•
для определения длины гена (l) учитывают количество нуклеотидов, которая
содержится в одной цепи ДНК;
•
для определения молекулярной массы гена (Mr) учитывают количество нуклеотидов,
содержится в двух цепях ДНК;
•
трансляция осуществляется согласно генетическим кодом;
•
для всех ДНК выполняется правило Чаргаффа: А = Т; Г = Ц;
•
А + Г = Т + Ц (содержание пуриновых азотистых оснований – аденина и гуанина –
равна содержания пиримидиновых азотистых оснований – тимина и цитозина);
•
сумма всех нуклеотидов в молекуле ДНК или РНК (А + Т + Г + Ц или А + В + Г + Ц)
составляет 100%.
Задача
1.
На
фрагменте одной цепи ДНК нуклеотиды расположены в последовательности,
показанной ниже.
…
АГТАЦГГЦАТГТАГЦ …
1.
Нарисуйте схему структуры двухцепочечной молекулы ДНК.
2.
Какова длина в нанометрах этого фрагмента?
3.
Какова масса двухцепной фрагмента?
решение
1.
Руководствуясь свойством ДНК, способностью к самовоспроизведению (репликации),
в основе которого лежит комплиментарность, запишем схему двухцепочечной ДНК:
ДНК:
А Г Т -А Ц Г -Г Ц А -Т Г Ц -А Г Ц-
Т Ц А – Т Г Ц – Ц Г Т – А Ц Д – Т Ц Г –
2.
Длина одного нуклеотида, или расстояние между двумя соседними вдоль оси ДНК,
составляет 0,34 нм. Длина двухцепочечной фрагмента равна длине одной цепи.
L = 15 х 0,34 = 5,1 (нм) (15
– количество нуклеотидов в одной цепи).
3.
Средняя молекулярная масса одного нуклеотида 345 условных единиц, молекулярная
масса фрагмента ДНК:
Мr
= 345 х 15 = 5175 (а.о.м) (30 – количество нуклеотидов в двух цепях).
Ответ.
Вторая цепь фрагмента ДНК имеет следующую структуру: ТЦА – ТГЦ – ЦГТ – АЦГ –
ТЦГ; длина фрагмента ДНК – 5,1 нм; молекулярная масса фрагмента ДНК – 5175
а.е.м.
Задача
2.
Фрагмент
первой цепи ДНК имеет такую нуклеотидную последовательность: ТАЦАГАТГГАГТЦГЦ.
Определите последовательность мономеров белка, закодированного фрагментом
второй цепи ДНК.
решение
ДНК:
– ТАЦ – АГА – ТГГ – АГТ – ЦГЦ-
– АТГ – ТЦТ – АЦЦ – ТЦА – ГЦГ-
иРНК:
– УАЦ – АГА – УГГ – АГУ – ЦГЦ-
Белок:
– тир – арг – трип – ср – арг-
Ответ.
Последовательность мономеров белка: тирозин – аргинин – триптофан – серин –
аргинин.
Задача
3.
Фрагмент
цепи А белка нормального гемоглобина состоит из 7 аминокислот, расположенных в
следующей последовательности:
вал
– лей – лей – трет – о – ГЛН – лез.
1.
Какое строение фрагмента иРНК, что является матрицей для синтеза этого
фрагмента молекулы гемоглобина?
2.
Какое строение фрагмента ДНК, кодирующего данную иРНК?
Решение
Белок:
вал – лей – лей – трет – о – глу – лез
иРНК:
ГУУ – УУА – УУА – АЦУ – ЦЦУ – ЦАА – ААА
ДНК:
ЦАА – ААТ – ААТ – ТГА – ГГА – ДНС – ТТТ
ГТТ ТТА ТТА АЦТ ЦЦТ ЦАА ААА
Задача 4.
Биохимический
анализ показал, что иРНК имеет 30% аденина, 18% гуанина и 20% урацила.
Определите долю (в%) каждого нуклеотида в соответствующем фрагменте
двухцепочечной ДНК?
решение
дано:
А
= 30%;
Г
= 18%;
У
= 20%.
Определяем
процент цитозинових нуклеотидов в данной иРНК:
= 100% – (+) =
= 100% – (30% + 20% + 18%) = 32%.
Определяем
процент адениновых и тиминових нуклеотидов (отдельно) во фрагменте ДНК:
= (+): 2 = (30% + 20%): 2 = 25%.
Определяем
процент гуанинових и цитозиновог нуклеотидов (отдельно) во фрагменте ДНК:
= (+): 2 = (18% + 32%): 2 = 25%.
Ответ.
Доля каждого нуклеотида в соответствующем фрагменте двухцепочечной ДНК
составляет 25%.
Задача 5.
Белок
состоит из 124 аминолислот. Сравните относительные молекулярные массы белка и
гена, который его кодирует.
дано:
Состав
белка – 124 аминокислоты;
Мr
(аминокислоты) = 100;
Мr
(нуклеотида) = 345.
Мr
(гена) -? Мr (белка) -?
решение
1).
Определяем относительную молекулярную массу белка:
124
х 100 = 12400.
2).
Определяем количество нуклеотидов в составе гена, кодирующего данный белок: 124
х 3 х 2 = 744 (нуклеотиды).
3).
Определяем относительную молекулярную массу гена:
744
х 345 = 256680.
4).
Определяем, во сколько раз ген тяжелее белок:
256680:
12400 = 20,7 (раза).
Ответ.
Относительная
молекулярная масса гена в 20,7 раза больше, чем кодированного белка.
Задача 6.
Гормон
роста человека (соматотропин) – белок, содержащий 191 аминокислоту. Сколько
кодируя нуклеотидов и триплетов входит в состав гена соматотропина?
решение
Одну
аминокислоту кодирует триплет нуклеотидов, следовательно, в состав гена
соматотропного входит 191 триплет.
191
х 3 = 573 (нуклеотиды) – одна цепь;
573
х 2 = 1146 (нуклеотидов) – обе цепи.
Ответ. В состав гена
соматотропного входит 191 триплет, содержащий 1146 нуклеотидов (обе цепи гена).
Задача 7.
У
больного синдром Фанкони (нарушение образования костной ткани) с мочой
выделяются аминокислоты, которым соответствуют следующие триплеты иРНК: АУА,
ГУЦ, АУГ, УЦА, УУГ, УАУ, ГУУ, АУУ. Определите, какие аминокислоты выделяются с
мочой у больных синдромом Фанкони (см. Таблица «Генетический код»).
решение
Аминокислоты:
илей, вал, мет, сер, лей, тир, вал, илей.
Ответ. У больных синдромом
Фанкони выделяются с мочой такие аминокислоты: изолейцин, валин, метионин,
серин, лейцин, тирозин.
Экзон-интронная ОРГАНИЗАЦИЯ ГЕНОМА
Большинство
структурных генов эукариот (участки ДНК) внутренне неоднородно. Они состоят из
экзонных (информативных) и интронных (без информационной) фрагментов.
При
транскрипции в ядре сначала синтезируется про-иРНК (незрелая), которая имеет в
себе как экзоны, так и интроны. Далее с помощью комплекса ферментов без
информационной участки вырезаются и разрушаются, а информативные соединяются в
новый полинуклеотидний цепь – зрелую иРНК. Механизм созревания иРНК в ядре
называется сплайсингом.
Задача 1.
Фрагмент
цепи молекулы ДНК содержит 1100 нуклеотидов, из них 100, 120, и 130 нуклеотидов
образуют интронная участка. Определите, сколько аминокислот кодирует этот
фрагмент ДНК:
дано:
N
(ДНК нуклеотидов) – 1100;
N
(интронных нуклеотидов) – 100, 120, 130.
N (аминокислот)
-?
решение:
1).
100 + 120 + 130 = 350 (количество нуклеотидов, образующих интронная участка);
2).
1100 – 350 = 750 (количество нуклеотидов, образующих экзонных участка);
3).
750: 3 = 250 (аминокислотных остатков).
Ответ. Этот фрагмент ДНК кодирует
250 аминокислот.
Задача 2.
Структурный
ген (фрагмент молекулы ДНК) содержит 384 цитозинових нуклеотидов, составляет
20% от их общего количества. В экзонных участках этого гена закодировано белок,
состоящий из 120 аминокислотных остатков.
1.
Какой нуклеотидный состав гена?
2.
Какая относительная молекулярная масса интронных участков гена?
3.
Насколько зрелая иРНК короче про-иРНК?
дано:
N
(Ц нуклеотидов) – 384 (20%);
N
(аминокислот в белке) – 120;
L
(нуклеотида) – 0,34 нм;
Мr
(нуклеотида) – 345.
1.
Нуклеотидный состав гена -?
2.
Мr (интронных участков гена) -?
3.
Насколько зрелая иРНК короче про-иРНК -?
решение
1.
Определяем общее количество нуклеотидов в фрагменте ДНК. Поскольку на цитозин
нуклеотиды приходится 20% от их количества, то общее количество нуклеотидов
составляет:
384
нуклеотидов – 20%;
Х
нуклеотидов – 100%;
Х
= 1920 (нуклеотидов);
По
принципу комплиментарности:
Г
= Ц = 384 нуклеотиды = 20%. Отсюда: А = Т = 30%.
384
нуклеотиды – 20%;
Х
нуклеотидов – 30%; х = 576 9нуклеотидив);
А
= Т 576 нуклеотидов.
2.
Находим количество нуклеотидов в экзонных участках гена:
120
3 х 2 = 720 (нуклеотидов).
Находим количество нуклеотидов в интронных участках гена:
1920
– 720 = 1200 (нуклеотидов).
Находим
относительную молекулярную массу интронных участков гена:
Mr
(интро. Участков гена) = 1200 х 345 = 414000.
3.
Длина молекулы про-иРНК равна длине структурного гена:
l
(о-иРНК) = (384 + 576) х 0,34 = 326,4 (нм).
Зрелая
иРНК состоит только из информативной части. Ее длина составляет:
l
(зрелой РНК) = 120 х 3 х 0,34 = 122,4 (нм).
Разница
в длине о-иРНК и зрелой иРНК составляет:
326,4
нм – 122,4 нм = 204 нм.
Ответ. 1. Ген содержит по 576
адениновых и тиминових нуклеотидов, и по 384 гуанинових и цитозинових
нуклеотиды. 2. Относительная молекулярная масса интронных участков гена – 414
000. 3. Разница в длине между про- иРНК и зрелой иРНК – 204 нм.
литература:
1.
Барна Иван Общая биология. Сборник задач. – Киев: Издательство «Ранок», 2009 –
736 с.
2.
Биология: Справочник для абитуриентов и школьников общеобразовательных учебных
заведений: Учебно-методическое пособие. – 2-е издание. – К .: Литере ЛТД, 2009.
– 656 с.
3.
Овчинников С.А. Сборник задач и упражнений по общей биологии: Учебное пособие.
– Донецк: Третье тысячелетие, 2002. – 128 с.
4.
Биология. Словарь-справочник .: Учеб. Пособие / /Авт.-сост .: В.П. Попович,
Т.А. Сало, Л.В. Деревинская. – М .: Страна грез, 2006. – 112 с.
Свойства белков
Молекулярная масса белков
Ученых, изучающих свойства белков, прежде всего интересовали вопросы: каковы размеры белковых молекул, какова их форма, молекулярная масса? Ответы на них получить было не просто. Определять относительную молекулярную массу по повышению температуры кипения белковых растворов, как это принято для других веществ, невозможно из-за того, что белки нельзя кипятить. Определение этого показателя по понижению температуры замерзания дает неточные результаты. К тому же белки никогда не встречаются в чистом виде. Они связаны с химическими соединениями других классов, в том числе и с солями, от которых трудно полностью избавиться. А присутствие солей значительно искажает результаты определения молекулярных масс традиционными методами. И все же методами, разработанными в конце прошлого века и в начале нашего столетия, было доказано, что молекулярная масса белков колеблется в больших пределах — от 14 000 до 45 000 и более. С такими необычными молекулами химики ранее не работали.
Принципиально новый и достаточно точный метод определения молекулярной массы предложил Т. Сведберг. Под действием силы инерции, развивающейся в ультрацентрифугах, белки осаждаются в зависимости от размера и массы их молекул. Центрифуга — это аппарат, основной частью которого является вращающийся ротор с вставленными в него пробирками с исследуемыми белковыми растворами. Ультрацентрифуги дают 70 000 и более оборотов в минуту. Скорость оседания частиц белка при этом значительно увеличивается.
А зная скорость, можно по специальным формулам вычислить относительные молекулярные массы белков. О значительных различиях молекулярных масс свидетельствуют следующие цифры: белок-фермент рибонуклеаза имеет массу 13700, яичный альбумин — 45000, y-глобулин сыворотки крови—160000, а один из растительных белков — вирус помидора—10 млн. За нижний предел молекулярной массы белков принято значение 6000. О числе атомов в составе белков можно судить по элементарному составу, например, лактоглобулина: С1864 H3012 N68 S21.
При растворении в воде белки дают коллоидные растворы, частицы в которых довольно крупные—от 0,1 до 0,001 мкм. Для этих растворов характерен эффект Тиндаля. Эффект заключается в том, что при пропускании пучка света через раствор коллоидных частиц свет рассеивается и становится хорошо заметным в сосуде с раствором.
На разнице в молекулярных массах белков и других низкомолекулярных частиц основан метод очистки белков от примеси. Для этого раствор белка наливают в мешочек из целлофана или пергамента и помещают его в чистый растворитель (воду). Молекулы низкомолекулярных веществ, которые находятся с белком в мешочке и загрязняют его, переходят постепенно через поры целлофана или пергамента в растворитель, а белок остается. Если несколько раз сменить воду, окружающую мешочек, то белковый раствор можно полностью освободить от солей и других сопутствующих низкомолекулярных веществ. Такой метод очистки белков называют диализом.
Растворимость белков
В аминокислотах, входящих в состав белков, содержатся полярные функциональные группы, обладающие сродством к воде. Поэтому белки растворяются в воде хорошо, образуя коллоидные растворы. В то же время из-за большого размера молекул растворы белков оказываются неустойчивыми. Под влиянием различных водоотнимающих веществ (спирт, ацетон, соли и т. д.) белки выпадают в осадок. Действительно, если отнять воду от белка, от его полярных функциональных групп,
то огромные молекулы не смогут уже держаться в растворителе и будут, сталкиваясь друг с другом, осаждаться. Количество воды, которое может связать белок, довольно велико. Например, белки некоторых тканей могут образовывать своеобразный каркас, который способен удержать в своих ячейках до 99 % воды. Именно такое количество воды содержится, например, у медуз за счет своеобразной структуры их тел.
Одним из важных свойств белка является его фракционное высаливание, т. е. выделение белка из раствора после прибавления растворов солей различных концентраций. Так, для выделения из сыворотки крови глобулинов добавляют к ней сульфат аммония (NH4)2 SO4 до полунасыщения. После отделения белков глобулинов можно взять ту же соль, но более насыщенной концентрации, и осадить альбумины. Разделив таким образом две эти фракции, можно избавиться от соли диализом и получить отдельно альбумины и глобулины. Высаливание не приводит к инактивации белка. Он сохраняет все свои природные свойства и может быть опять при необходимости растворен в воде. Такое же действие оказывает на растворы белков этиловый спирт, действующий как мощный водоотнимающий фактор. Но действие спирта должно быть непродолжительным, иначе белок потеряет активность и способность опять растворяться в воде.
Кроме нейтральных солей, осаждение белков вызывают соли тяжелых металлов (Hg, Zn, Ag, Pb и др.) уже в небольших концентрациях. Они образуют комплексы с функциональными группами белков, изменяют структуру белков, которые в связи с этим теряют устойчивость в растворе и осаждаются. В ряде случаев осаждение солями тяжелых металлов приводит к потере природных свойств белка и представляет необратимый процесс. Такие белки теряют способность растворяться в воде, а ферменты не способны катализировать реакции.
Большое практическое применение получил метод осаждения белков органическими кислотами, в частности трихлоруксусной кислотой CCI3COOH. Она осаждает только белки и не осаждает полипептиды. Это очень важно в медицине: когда хотят определить небелковый азот крови, предварительно осаждают белок трихлор-уксусной кислотой, а с надосадочной жидкостью проводят необходимые исследования.
Денатурация
Потеря натуральных свойств белка, которая происходит при его осаждении тяжелыми металлами, носит название денатурации. Она может происходить и под влиянием других физических или химических факторов. В этом случае происходят внутримолекулярные изменения, приводящие чаще всего к потере способности белков растворяться. Денатурация подразумевает различные превращения молекулы белка, но не разрыв полипептидной цепочки, т. е. она не затрагивает первичную структуру белка.
О том, что произошла денатурация белка, можно судить по ряду признаков: а) уменьшается растворимость белка; б) изменяются форма и размеры молекулы; в) теряется ферментативная активность; г) изменяются оптические свойства белка и т. д. У различных белков это проявляется по-разному.
В результате денатурации часто оказывается, что в белке появились какие-то новые, «дополнительные» функциональные группы. Это произошло потому, что при разворачивании молекулы обнажаются замаскированные внутри молекулы SH-, ОН-группы и другие, доступные для реакций.
Кроме указанных причин, денатурация может быть вызвана нагреванием белка. При этом происходит увеличение теплового движения отдельных участков полипептидной нити, водородные связи разрываются, белок разворачивается и приобретает необычную, неприродную форму, водородные связи (и др.) устанавливаются в несвойственных данной молекуле местах и конфигурация молекулы меняется. Гидратная оболочка вокруг такого белка нарушается, отдельные молекулы белка соединяются между собой в более крупные частицы, слипаются и уже не могут держаться в растворе—начинается процесс осаждения денатурированного белка. Процесс восстановления структуры белка после денатурации называют ренатурацией. Иногда денатурированный белок не выпадает из раствора, так как он имеет большое число зарядов, препятствующих сближению и слипанию отдельных частиц. Если эти заряды снять или уменьшить, добавив в раствор ионы с противоположным знаком, то взвешенные частички начнут слипаться и выпадать в осадок.
Какое практическое значение может иметь денатурированный белок? Всегда ли нужно препятствовать процессу денатурации? На все эти вопросы нельзя дать однозначный ответ. Кулинарная обработка мяса, яиц и других белоксодержащих продуктов приводит к денатурации белка. Денатурация в этом случае готовит молекулы белка к воздействию пищеварительных ферментов, содержащихся в желудочном и кишечном соке. Денатурацию используют при отравлении как лечебную процедуру. Например, при отравлении солями тяжелых металлов больному дают молоко или большое количество сырого яичного белка. Белки связывают тяжелые металлы. Образуются нерастворимые комплексы, удерживающие соли тяжелых металлов, которые не могут всосаться из желудка в кровь. Ядовитое действие металлов нейтрализовано. Если после этого у больного вызвать рвоту, яд будет удален из организма.
Однако в ряде случаев с денатурацией необходимо бороться, прежде всего при получении в чистом виде белков, ферментов, гормонов, чтобы сохранить их активность и другие природные свойства, уберечь от повреждения.
При выделении белков из биологического материала (из печени животных, мышц, сыворотки крови и т. д.) часто прибегают к различным физико-химическим приемам: нагреванию, замораживанию с последующим оттаиванием, действию органических и неорганических веществ, ионизирующего излучения, ультразвука. Многие из этих приемов, особенно при продолжительном воздействии, могут вызвать денатурацию. Например, разрушение мембран клеток и субклеточных частиц для последующего извлечения из них белка осуществляют действием ультразвука или чередованием замораживания-оттаивания. Но при этом могут быть повреждены (денатурированы) содержащиеся в клетках белки. Поэтому выделение белков проводят при охлаждении, чтобы исключить тепловую денатурацию, при определенных значениях кислотности, в присутствии веществ, тормозящих денатурацию.
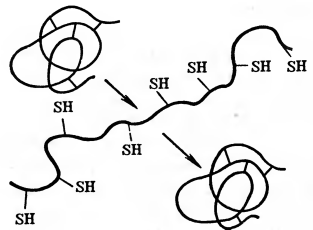
Рис. 1 Схема обратимой денатурации белка.
Денатурация может быть обратимой. Многие вещества действуют на белок до тех пор, пока они находятся в растворе; при их удалении структура и свойства белка восстанавливаются. Однако продолжительное действие денатурирующего агента или сильные денатурирующие факторы приводят к глубоким необратимым изменениям структуры и свойств белка.
Необходимо отметить, что денатурация не приводит к разрушению ковалентных связей. Любые изменения, в результате которых происходит выделение из белка аммиака или других веществ, расщепление до пептидов и другие превращения, связанные с отщеплением части белка, уже не считаются денатурацией.
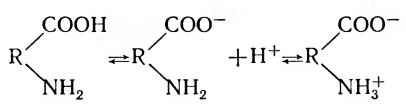
Белки-электролиты.
Изоэлектрическая точка
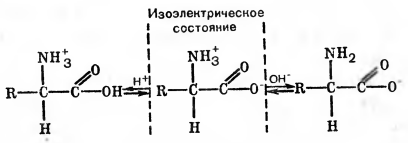
Аминокислоты, составляющие белки, относятся к амфотерным веществам, обладающим одновременно свойствами и кислот, и оснований. Это объясняется тем, что не все амино- и карбоксильные группы аминокислот заняты в образовании пептидных связей. В молекулах диаминокислот остаются свободными аминогруппы, а в молекулах моноаминодикарбоновых кислот — карбоксильные группы. Например, при растворении белка в воде от карбоксильных групп отщепляются протоны, и белок приобретает свойства слабой кислоты:
Появляющиеся в растворе протоны тотчас же присоединяются к NН2-группам, имеющим основной характер, вследствие чего они переходят в ионизированную форму — NH3+
Таким образом, белок несет положительные и отрицательные заряды, т. е. является диполярным ионом.
Рис. 2 Как образуются заряды у аминокислоты.
Белки могут изменять свои заряды в зависимости от кислотности растворов. В кислой среде они обычно движутся к катоду, в щелочной — к аноду.
Амфотерность белков определяется не только присутствием свободных карбоксильных или аминогрупп в белке, но и наличием других функциональных группировок. Слабо выраженными кислотными свойствами обладают SH-группа цистеина и ОН-группа тирозина.
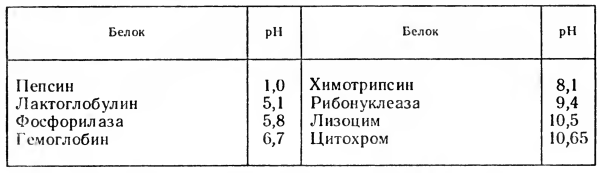
Если заряд белковой молекулы изменяется при изменении pH, значит, должна существовать такая точка, в которой белок не несет в избытке положительный и отрицательный заряд. Такое значение pH, когда заряд белка равен нулю, называется изоэлектрической точкой. Изоэлектрические точки некоторых белков представлены в таблице:
В изоэлектрической точке белки наименее устойчивы. Поэтому для более полного осаждения белка необходимы два условия: устранение гидратной оболочки какими-либо водоотнимающими веществами и снятие избыточного электрического заряда. Для этого осаждение белка рекомендуют проводить при определенных значениях pH, т. е. подкисляют или подщелачивают раствор.
Если белок находится в растворе при значениях pH выше изоэлектрической точки, то он обладает суммарным отрицательным зарядом и движется в электрическом поле к аноду. От присутствия в растворах некоторых даже нейтральных солей белки могут существенно смещать значение своей изоэлектрической точки. Соли влияют на степень ионизации многочисленных боковых функциональных групп в макромолекуле белка. Белок может просто связывать некоторые ионы растворов, например ионы кальция, магния, хлора, фосфаты. После такого связывания изоэлектрическая точка белка существенно меняется.
Таким образом, природа среды, в которой растворен белок, в значительной степени влияет на его изоэлектрическую точку.
Наличие зарядов у белковых молекул позволяет проводить тонкое разделение различных белковых фракции путем электрофореза в зависимости от значения и знака заряда. Этот метод широко используется на практике для изучения состава белков крови. Такие данные дают большую информацию для диагностики заболеваний и контроля за эффективностью проводимого лечения. Большое значение имеет этот метод для биологии и сельского хозяйства.
Скачать реферат: Svoystva-belka.rar
Пароль на архив: privetstudent.com
Молекулярная масса белков
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и более.
где v – скорость перемещения границы растворитель-белок, см/с; ω – угловая скорость ротора, рад/с; r – расстояние от центра ротора до середины ячейки с раствором белка, см. Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1•10 –13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S.
Для вычисления молекулярной массы (М), помимо константы седиментации, необходимы дополнительные сведения о плотности растворителя и белка и другие согласно уравнению Сведберга:
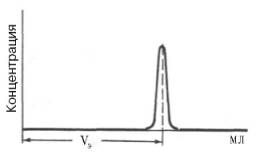
Определение молекулярной массы белков методом ультрацентрифугирования требует много времени и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два более простых метода (гель-хроматография и электрофорез). При использовании гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого через колонку с сефадексом пропускают несколько белков с известными молекулярными массами и строят график, откладывая значения логарифмов молекулярной массы против их элюционных объемов, которые находят, как показано на рис. 1.9.
Известно, что между логарифмом молекулярной массы белка, имеющего сферическую форму, и элюционным объемом существует прямая зависимость. Поэтому легко определить молекулярную массу исследуемого белка, зная его объем элюции. Второй разновидностью этого метода является тонкослойная гель-хроматография. Длина пробега белка (в миллиметрах) через тонкий слой сефадекса находится в логарифмической зависимости от молекулярной массы белка (рис. 1.10).
Рис. 1.9. Измерение объема элюции (VЭ).
Рис. 1.10. Зависимость между длиной пробега белковых частиц при гель-хроматографии в тонком слое сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в полулогарифмической системе координат).
Гель-хроматография, кроме простоты и быстроты, имеет дополнительное преимущество: не требуется выделять белок в чистом виде, так как примеси других белков не мешают определению, поскольку каждый из них проходит через колонку со свойственной ему скоростью, определяемой молекулярной массой. Это обстоятельство широко используется в энзимологии, когда оказывается возможным определение молекулярной массы даже очень небольшого количества фермента в присутствии других белков, не обладающих аналогичной каталитической активностью.
При использовании диск-электрофореза в полиакриламидном геле для определения молекулярной массы белков также строят график зависимости между логарифмом молекулярной массы калибровочных белков и подвижностью белковых частиц в полиакриламидном геле, а затем, определив подвижность исследуемого белка, по графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии детергента додецилсульфата натрия, так как только в этом случае наблюдается прямая пропорциональная зависимость между молекулярной массой и подвижностью белков. Белки с четвертичной структурой при этих условиях распадаются на субъединицы, поэтому метод находит широкое применение для определения молекулярной массы субъединиц белка.
Рис. 1.11. Зависимость между молекулярной массой и относительной подвижностью белка при диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия (в полулогарифмической системе координат).
Недавно предложен новый масс-спектрометрический метод (так называемый лазерный десорбционно-ионизационный метод), позволяющий определять молекулярную массу небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и, кроме того, структуру биомолекул.
Источник
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ БЕЛКОВ
Методы определения молекулярной массы белка можно разделить на химические, физико-химические и физические. К наиболее распространенным физико-химическим методам определения молекулярной массы белков относятся гель-хроматография (на колонках и в тонком слое), а также электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия. Использование этих методов не требует сложной аппаратуры и большого количества исследуемого материала.
МЕТОД ГЕЛЬ-ХРОМАТОГРАФИИ НА КОЛОНКАХ
Принцип метода. Метод основан на том, что для большого числа глобулярных белков имеется линейная зависимость между логарифмом молекулярной массы и объемом элюирования с колонки, заполненной гелем с определенной величиной пор. Поэтому для определения молекулярной массы глобулярного белка достаточно определить объем его элюции с предварительно откалиброванной колонки. Калибровку колонки проводят, пропуская через нее белки с известной молекулярной массой и определяя объемы элюции для каждого из них.
Для сефадекса G-75 экспериментальным путем получено уравнение для расчета молекулярной массы:
где М – молекулярная масса; Vэ – объем раствора, в котором из колонки выходит исследуемое вещество; Vo – свободный объем колонки.
Реактивы: 1. 1 % раствор голубого декстрана.
2. 0,1 моль/л раствор NaCl.
3. Сефадекс G-75 – 4 г.
4. 1 % раствор гемоглобина.
Ход работы.Подготовку колонки проводят аналогично тому, как это описано для метода гель-хроматографии. После заполнения колонки гелем сефадекса G-75 ее промывают 0,1 моль/л раствором NaCl.
Открывают зажим на колонке и сливают 0,1 моль/л раствором NaCl, находящийся над гелем. Зажим закрывают и на поверхность геля аккуратно наносят 0,5 мл раствора голубого декстрана. Открывают зажим и собирают вытекающую из колонки жидкость в мерный цилиндр, сохраняя ее до конца опыта.
Как только из колонки начнет вытекать окрашенный (голубой) раствор, начинают сбор элюата в заранее подготовленные пробирки по 20 капель в каждую пробирку. Элюат из этих пробирок от начала ряда, включая пробирку с самой интенсивной окраской, сливают в мерный цилиндр, где уже собраны предыдущие (неокрашенные) фракции. Объем остальных пробирок, в которых окраска начинает ослабевать, не учитывается. Таким образом, объем элюата от начала опыта до появления наиболее яркой голубой окраской составляет свободный объем колонки (Vo).
Закончив определение свободного объема, колонку отмывают от следов голубого декстрана. После этого в колонку вносят 0,5 мл 1 % раствора гемоглобина и повторяют ход работы, описанный для голубого декстрана. Объем элюата от начала эксперимента с гемоглобином до появления в пробирке максимально розовой окраски определяют как Vэ.
Полученные значения Vo и Vэ подставляют в приведенное выше уравнение и находят молекулярную массу, используя таблицу логарифмов.
ГЕЛЬ-ХРОМАТОГРАФИЯ В ТОНКОМ СЛОЕ СЕФАДЕКСА
Принцип метода. По мере продвижения раствора по пластинке с нанесенным на нее тонким слоем геля сефадекса смесь белков распределяется в нем таким образом, что расстояние, пройденное каждым белком от линии старта, пропорционально логарифму его молекулярной массы. Построив калибровочный график зависимости расстояния, пройденного белками-маркерами, от логарифма их молекулярной массы и определив длину пути, пройденного исследуемым белком, можно определить его молекулярную массу.
Оборудование: 1. Столик с переменным углом наклона (рис. 6).
2. Хроматографическая камера.
Рис. 6 – Оборудование для хроматографического разделения белков в тонком слое сефадекса:
а – столик с переменным углом наклона; б – хроматографическая камера (1, 3 – отсеки, заполненные буферным раствором; 2 – отсек, в который помещают стеклянную пластинку), 4 – стеклянная пластинка, покрытая гелем сефадекса; 5 – соединительные мостики из фильтровальной бумаги; в – скользящая крышка
Реактивы: 1.Сефадекс G-200 или G-150.
2. 0,1 моль/л натрий-фосфатный буфер, pH 7,4.
3.0,1 % раствор бромфенолового синего, приготовленного на смеси этанол : концентрированная уксусная кислота (9:1).
4. 5 % раствор СН3СООН.
5. 2 % раствор СН3СООNa, приготовленный на 10 % растворе СН3СООН.
6. Набор белков-маркеров с известной молекулярной массой: сывороточный альбумин (70 000 Да), рибонуклеаза (12 700 Да), яичный альбумин (45 000 Да), трипсин (23 800 Да), креатинкиназа из мышц кролика (80 000 Да), глицеральдегидфосфатдегидрогеназа (144 000 Да), пируваткиназа (237 000 Да).
7. Хроматографическая бумага.
Ход работы. 4 г сухого сефадекса суспендируют в избытке натрий-фосфатного буфера и оставляют набухать в течение 3 сут при комнатной температуре или в течение нескольких часов при 60 °С. Перед нанесением на стеклянную пластинку (20 × 40 см), которая должна быть вымыта с особой тщательностью, избыток буфера над гелем декантируют, а гель перемешивают и наносят фарфоровой ложкой на пластинку, расположенную на столике со строго горизонтальной поверхностью. Слой геля распределяют по пластинке стеклянной палочкой размером 1 × 22 см с надетой на концы резиновой трубкой, прокатывая палочку вдоль пластинки несколько раз для получения равномерного слоя геля толщиной 1 мм (без комочков и пузырьков воздуха). Пластинку подсушивают на воздухе в течение 15 мин, а затем помещают в средний отсек камеры, как показано на рис. 6.
Крайние резервуары заливают 0,1 моль/л фосфатным буфером (pH 7,4), слой геля соединяют с буферным раствором полосками хроматографической бумаги, камеру закрывают скользящей крышкой и помещают на подставку с переменным углом. Угол наклона камеры устанавливают равным 7 – 10°. Камеру оставляют для насыщения на ночь при комнатной температуре.
Убедившись в равномерности слоя сефадекса, наносят микропипеткой по 0,02 мл растворов (5 мг/мл) исследуемого белка и белков-свидетелей. Для этого пластинку устанавливают горизонтально и наносят белки в отдельные точки на расстоянии 3 см от верхнего края пластинки и друг от друга. Закрывают камеру крышкой и устанавливают ее под углом 7 – 10°. Гель-хроматографию проводят в течение 4 ч при комнатной температуре. Затем камеру устанавливают горизонтально, полоски хроматографической бумаги удаляют, пластинку помещают на горизонтальную подставку и снимают “реплику” на хроматографическую бумагу. Для этого бумагу свертывают в трубочку и, постепенно разворачивая, накладывают на тонкий слой так, чтобы бумага прилипла к нему. Не следует сильно надавливать на бумагу, чтобы не повредить слой сефадекса. Бумагу оставляют на пластинке 1 мин, затем высушивают при 90 °С в течение 20 мин и помещают в кювету для окрашивания.
Для идентификации белковых зон “ реплику ” помещают на 3 – 5 мин в раствор бромфенолового синего; краситель отмывают дважды 5 % раствором СН3СООН и закрепляют 2 % раствором уксуснокислого натрия, приготовленного на 10 % растворе СН3СООН.
После тщательного промывания в холодной проточной воде хроматографическую бумагу высушивают и измеряют расстояние, пройденное каждым белком от точки нанесения до центра белкового пятна. Строят калибровочный график, откладывая по оси абсцисс величину отношения lа : lст (lа – длина пути, пройденного данным белком; lст – расстояние, пройденное стандартным белком, например сывороточным альбумином), по оси ординат – логарифм молекулярной массы данного белка. Определив расстояние белковой зоны исследуемого белка от старта, по калибровочному графику находят его молекулярную массу.
3.3. ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ В ПРИСУТСТВИИ ДОДЕЦИЛСУЛЬФАТА НАТРИЯ
Принцип метода. Белки, обработанные концентрированным раствором додецилсульфата натрия в присутствии β-меркаптоэтанола, распадаются на отдельные полипептидные цепи и приобретают отрицательный заряд, значительно превышающий собственный заряд белковой молекулы. При последующем разделении с помощью диск-электрофореза в полиакриламидном геле белковые зоны распределяются на электрофореграммах таким образом, что подвижность белковой зоны обратно пропорциональна логарифму молекулярной массы. Метод дает возможность определять молекулярные массы субъединиц олигомерных белков. Электрофоретическое разделение можно проводить различными методами. Ниже описаны два из них: метод Вебера и Осборн, а также метод, предложенный Лэммли.
В методе Вебера и Осборн буферные растворы для приготовления геля и электродный не отличаются между собой. Обычно используют 0,1 или 0,05 моль/л натрий-фосфатный буфер. В методе Лэммли гелевый и электродный буферные растворы отличаются друг от друга по составу и величине pH. Кроме того, используют два типа гелей –концентрирующий и разделяющий. Эти модификации приводят к тому, что на границе между концентрирующим и разделяющим гелем весь белковый образец собирается в виде узкого диска. Это способствует более четкому разделению белков.
3.3.1. МЕТОД ВЕБЕРА И ОСБОРН
Реактивы: 1. 30 % раствор акриламида, содержащий 0,6 % раствор метиленбисакриламида.
Внимание! Работу с акриламидом проводят под тягой, в перчатках!
2. Буфер для приготовления геля: 0,2 моль/л натрий-фосфатный буфер (pH 7,2).
3. Буфер для приготовления образцов: 0,02 моль/л натрий-фосфатный буфер (pH 7,2).
4. Электродный буфер: 0,05 моль/л натрий-фосфатный буфер (pH 7,2).
5. Раствор персульфата аммония – 15 мг/мл (готовят непосредственно перед употреблением).
7. 40 % раствор сахарозы.
8. 70 % раствор изопропилового спирта.
9. 0,04 % раствор кумасси R-250, приготовленный на 20 % растворе изопропанола и 10 % растворе СН3СООН.
10. 10 % раствор уксусной кислоты.
11. 10 % раствор додецилсульфата натрия (ДСН).
13. Набор белков-маркеров с известной молекулярной массой. В качестве белков-маркеров можно использовать следующие белки: фосфорилаза (91 000 Да), бычий сывороточный альбумин (68 000 Да), яичный альбумин (42 000 Да), химотрипсиноген А (27 000 Да), РНКаза (14 000 Да), цитохром с (12 000 Да) – 5 мг/мл.
Готовят гель.Для этогов эрленмейеровскую колбочку сливают 10 мл раствора акриламида, 15 мл фосфатного буфера, содержащего 30 мг ДСН, 3,5 мл Н2О, 1,5 мл персульфата аммония и 0,04 мл ТЕМЕД.
Разделение белка можно проводить как в трубочках, так и на пластинах для вертикального электрофореза. После обработки ДСН к образцам добавляют сахарозу (до концентрации 10 %) и в качестве лидирующего красителя — бромфеноловый синий (до концентрации 0,001 %).
Образцы исследуемых белков и белков-маркеров наносят на поверхность геля в объеме от 20 до 100 мкл (каждого или смеси нескольких образцов) и осторожно наслаивают электродный буфер. Нагрузка на гель определяется методом окраски гелей, а также способностью того или иного белка связывать используемый краситель. Как правило, при электрофорезе в трубочках удается обнаружить от 20 до 100 мкг белка, при электрофорезе в пластинке – от 4 до 15 мкг.
В электродный буфер катодного отделения добавляют ДСН до концентрации 0,1 %. Электрофоретическое разделение проводят при комнатной температуре и силе тока 8 мА на трубочку. При этом сначала устанавливают силу тока – 2 мА на трубочку (напряжение около 50 В), напряжение поднимают до 100 – 200 В лишь после того, как образцы войдут в гель. Разделение проводят до тех пор, пока краситель не пройдет 4/5 всей длины геля. Обычно это занимает 4 – 6 ч.
После этого электрофорез прекращают, вынимают гель и помещают его для фиксации в 70 % раствор изопропанола на 1 ч. Затем гели прокрашивают раствором кумасси R-250 в течение 2 ч. Избыток краски удаляют промыванием 10 % раствором СН3СООН.
После окончания отмывки геля проводят обработку электрофореграмм. Определяют расстояние, пройденное каждым белком от стартовой линии. Определение можно проводить визуально или с помощью денситометра при 550 – 600 нм. Строят калибровочный график, откладывая по оси абсцисс длину пути 1а, пройденного данным белком, а по оси ординат – логарифм его молекулярной массы. Определив длину пути, пройденного белком с неизвестной молекулярной массой 1 x, пользуясь калибровочным графиком, определяют молекулярную массу исследуемого белка. При проведении электрофореза в трубочках часто трудно получить хорошо воспроизводимые результаты на разных трубках. В этом случае определяют не абсолютную, а относительную подвижность белков. Для этого определяют отношение длины пробега белковой зоны либо к общей длине геля, либо к длине пробега лидирующего красителя. После этого строят зависимость относительной подвижности белков от логарифма их молекулярной массы.
МЕТОД ЛЭММЛИ
Реактивы: 1. 30 % раствор акриламида, приготовленного на 0,4 % растворе метиленбисакриламида; 29,6 г акриламида и 0,4 г метиленбисакриламида растворяют в воде и объем раствора доводят до 100 мл.
Внимание! Работу с акриламидом проводят под тягой, в пер чатках!
2. Буфер для приготовления разделяющего геля: 1,5 моль/л трис-НС1 буфер, содержащий 0,4 % раствор ДСН (pH 8,8).
3. Буфер для приготовления концентрирующего геля: 0,5 моль/л трис-НС1 буфер, содержащий 0,4 % раствор ДСН (pH 6,8).
4. Электродный буфер: 0,025 трис-0,192 моль/л глицин (pH 8,6). Необходимую навеску глицина растворяют в воде и добавляют сухой трис до pH 8,6, после чего объем раствора доводят водой до нужной величины. Электродный буфер катодного отделения камеры содержит помимо указанных компонентов ДСН в концентрации 0,1 %.
5. Буфер для приготовления образцов: 0,0625 моль/л трис-НС1 буфер (pH 6,8), 2 % раствор ДСН, 10 % раствор сахарозы (или глицерин), 0,001 % раствор бромфенолового синего. Перед употреблением в указанный раствор добавляют β-меркаптоэтанол до конечной концентрации 5 %.
6. Раствор персульфата аммония – 15 мг/мл.
8. 70 % раствор изопропилового спирта.
9. 10 % раствор уксусной кислоты.
10. 0,04 % раствор кумасси R-250, приготовленного на смеси: изопропанол: этанол: уксусная кислота: вода в соотношении 2:1:1:6.
11. Набор белков-маркеров с известной молекулярной массой. В качестве белков-маркеров можно использовать следующие белки: фосфорилаза (91 000 Да), бычий сывороточный альбумин (68 000 Да), яичный альбумин (42 000 Да), химотрипсиноген А (27 000 Да), РНКаза (14 000 Да), цитохром с (12 000 Да) – 5 мг/мл.
Ход работы. Для полимеризации 30 мл разделяющего геля (12,5 %) смешивают 12,5 мл раствора акриламида, 7,5 мл буфера разделяющего геля и 10 мл воды. К смеси добавляют 16 мг персульфата аммония и 18 мкл ТЕМЕД.
Полученный раствор заливают либо в гелевую ячейку для вертикального электрофореза в пластине, либо в трубки. На поверхность раствора наслаивают дистиллированную воду. После полимеризации удаляют воду шприцем или фильтровальной бумагой.
Готовят смесь для концентрирующего геля. Смешивают 4 мл 30 % раствора акриламида с 5 мл буфера концентрирующего геля и добавляют 11 мл воды (суммарный объем 20 мл). К полученной смеси добавляют 15 мг персульфата аммония и 16 мкл ТЕМЕД и наносят на вершину уже заполимеризовавшегося разделяющего геля. Обычно длина концентрирующего геля в 5 – 6 раз меньше длины разделяющего геля. На поверхность полимеризуемых гелей наслаивают воду.
Исследуемые и стандартные белки-маркеры растворяют в буферном растворе для приготовления образцов в концентрации 5 мг/мл и кипятят на водяной бане 5 мин. Электрофорез и обработку электрофореграмм проводят, как описано для метода Вебера и Осборн.
Дата добавления: 2019-02-26 ; просмотров: 1156 ; Мы поможем в написании вашей работы!
Источник
Молекулярная масса белков
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и более.
.%3C/p%3E%20%3Cp%3E%D0%9D%D0%B5%D0%B4%D0%B0%D0%B2%D0%BD%D0%BE%20%D0%BF%D1%80%D0%B5%D0%B4%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%20%D0%BD%D0%BE%D0%B2%D1%8B%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81-%D1%81%D0%BF%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BC%D0%B5%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%20(%D1%82%D0%B0%D0%BA%20%D0%BD%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC%D1%8B%D0%B9%20%D0%BB%D0%B0%D0%B7%D0%B5%D1%80%D0%BD%D1%8B%D0%B9%20%D0%B4%D0%B5%D1%81%D0%BE%D1%80%D0%B1%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE-%D0%B8%D0%BE%D0%BD%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4),%20%D0%BF%D0%BE%D0%B7%D0%B2%D0%BE%D0%BB%D1%8F%D1%8E%D1%89%D0%B8%D0%B9%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8F%D1%82%D1%8C%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%83%D1%8E%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20%D0%BD%D0%B5%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%B8%D1%85%20%D0%BF%D0%B5%D0%BF%D1%82%D0%B8%D0%B4%D0%BE%D0%B2%20(%D0%B2%D0%B0%D0%B7%D0%BE%D0%BF%D1%80%D0%B5%D1%81%D1%81%D0%B8%D0%BD,%20%D0%B8%D0%BD%D1%81%D1%83%D0%BB%D0%B8%D0%BD)%20%D0%B8%20%D0%BA%D1%80%D1%83%D0%BF%D0%BD%D1%8B%D1%85%20%D0%B1%D0%B8%D0%BE%D0%BF%D0%BE%D0%BB%D0%B8%D0%BC%D0%B5%D1%80%D0%BD%D1%8B%D1%85%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%20%D0%B8,%20%D0%BA%D1%80%D0%BE%D0%BC%D0%B5%20%D1%82%D0%BE%D0%B3%D0%BE,%20%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D1%83%20%D0%B1%D0%B8%D0%BE%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB.%3C/p%3E%20%3Cp%3E%3Ca%20href=)
Molar mass of PrOTeIn = 399.32505 g/mol
Convert grams PrOTeIn to moles
or
moles PrOTeIn to grams
Molecular weight calculation:
140.90765 + 15.9994 + 127.6 + 114.818
Percent composition by element
Element: Indium
Symbol: In
Atomic Mass: 114.818
# of Atoms: 1
Mass Percent: 28.753%
Element: Tellurium
Symbol: Te
Atomic Mass: 127.60
# of Atoms: 1
Mass Percent: 31.954%
Element: Praseodymium
Symbol: Pr
Atomic Mass: 140.90765
# of Atoms: 1
Mass Percent: 35.286%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 1
Mass Percent: 4.007%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
PrOTeIN
PrOTeIn
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.



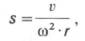
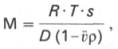


.%20%D0%92%D0%B5%D0%BB%D0%B8%D1%87%D0%B8%D0%BD%D0%B0%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D1%8B%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8,%20%D1%80%D0%B0%D0%B2%D0%BD%D0%B0%D1%8F%201%E2%80%A210%E2%80%9313%20%D1%81,%20%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%BD%D0%BE%20%D0%BF%D1%80%D0%B8%D0%BD%D1%8F%D1%82%D0%B0%20%D0%B7%D0%B0%20%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D1%83%20%D0%B8%20%D0%BD%D0%B0%D0%B7%D0%B2%D0%B0%D0%BD%D0%B0%20%D1%81%D0%B2%D0%B5%D0%B4%D0%B1%D0%B5%D1%80%D0%B3%D0%BE%D0%BC%20(S).%20%D0%97%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8%20%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%B8%D0%BD%D1%81%D1%82%D0%B2%D0%B0%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%BB%D0%B5%D0%B6%D0%B0%D1%82%20%D0%B2%20%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B0%D1%85%201%E2%80%9350%20S,%20%D1%85%D0%BE%D1%82%D1%8F%20%D0%B2%20%D1%80%D1%8F%D0%B4%D0%B5%20%D1%81%D0%BB%D1%83%D1%87%D0%B0%D0%B5%D0%B2%20%D1%8D%D1%82%D0%B8%20%D0%B7%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BF%D1%80%D0%B5%D0%B2%D1%8B%D1%88%D0%B0%D1%8E%D1%82%20100%20S.%3C/p%3E%20%3Cp%3E%D0%94%D0%BB%D1%8F%20%D0%B2%D1%8B%D1%87%D0%B8%D1%81%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20(%D0%9C),%20%D0%BF%D0%BE%D0%BC%D0%B8%D0%BC%D0%BE%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D1%8B%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8,%20%D0%BD%D0%B5%D0%BE%D0%B1%D1%85%D0%BE%D0%B4%D0%B8%D0%BC%D1%8B%20%D0%B4%D0%BE%D0%BF%D0%BE%D0%BB%D0%BD%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5%20%D1%81%D0%B2%D0%B5%D0%B4%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BE%20%D0%BF%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D0%B8%20%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D1%8F%20%D0%B8%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D0%B5%20%D1%81%D0%BE%D0%B3%D0%BB%D0%B0%D1%81%D0%BD%D0%BE%20%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8E%20%D0%A1%D0%B2%D0%B5%D0%B4%D0%B1%D0%B5%D1%80%D0%B3%D0%B0:%3C/p%3E%20%3Cp%20style=)
.%20%D0%9F%D1%80%D0%B8%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8%20%D0%B3%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%B8%20%D0%B2%20%D0%BF%D0%B5%D1%80%D0%B2%D1%83%D1%8E%20%D0%BE%D1%87%D0%B5%D1%80%D0%B5%D0%B4%D1%8C%20%D1%82%D1%80%D0%B5%D0%B1%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%BE%D1%82%D0%BA%D0%B0%D0%BB%D0%B8%D0%B1%D1%80%D0%BE%D0%B2%D0%B0%D1%82%D1%8C%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83.%20%D0%94%D0%BB%D1%8F%20%D1%8D%D1%82%D0%BE%D0%B3%D0%BE%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83%20%D1%81%20%D1%81%D0%B5%D1%84%D0%B0%D0%B4%D0%B5%D0%BA%D1%81%D0%BE%D0%BC%20%D0%BF%D1%80%D0%BE%D0%BF%D1%83%D1%81%D0%BA%D0%B0%D1%8E%D1%82%20%D0%BD%D0%B5%D1%81%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D1%81%20%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8%20%D0%B8%20%D1%81%D1%82%D1%80%D0%BE%D1%8F%D1%82%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA,%20%D0%BE%D1%82%D0%BA%D0%BB%D0%B0%D0%B4%D1%8B%D0%B2%D0%B0%D1%8F%20%D0%B7%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%B2%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%BF%D1%80%D0%BE%D1%82%D0%B8%D0%B2%20%D0%B8%D1%85%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D1%85%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%D0%BE%D0%B2,%20%D0%BA%D0%BE%D1%82%D0%BE%D1%80%D1%8B%D0%B5%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D1%8F%D1%82,%20%D0%BA%D0%B0%D0%BA%20%D0%BF%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D0%BD%D0%BE%20%D0%BD%D0%B0%20%D1%80%D0%B8%D1%81.%201.9.%3C/p%3E%20%3Cp%3E%D0%98%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE,%20%D1%87%D1%82%D0%BE%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%BC%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%B8%D0%BC%D0%B5%D1%8E%D1%89%D0%B5%D0%B3%D0%BE%20%D1%81%D1%84%D0%B5%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D1%83%D1%8E%20%D1%84%D0%BE%D1%80%D0%BC%D1%83,%20%D0%B8%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%BC%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%D0%BE%D0%BC%20%D1%81%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D1%83%D0%B5%D1%82%20%D0%BF%D1%80%D1%8F%D0%BC%D0%B0%D1%8F%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C.%20%D0%9F%D0%BE%D1%8D%D1%82%D0%BE%D0%BC%D1%83%20%D0%BB%D0%B5%D0%B3%D0%BA%D0%BE%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D1%8C%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%83%D1%8E%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20%D0%B8%D1%81%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D0%B5%D0%BC%D0%BE%D0%B3%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%B7%D0%BD%D0%B0%D1%8F%20%D0%B5%D0%B3%D0%BE%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%B8.%20%D0%92%D1%82%D0%BE%D1%80%D0%BE%D0%B9%20%D1%80%D0%B0%D0%B7%D0%BD%D0%BE%D0%B2%D0%B8%D0%B4%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D1%8D%D1%82%D0%BE%D0%B3%D0%BE%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%D0%B0%20%D1%8F%D0%B2%D0%BB%D1%8F%D0%B5%D1%82%D1%81%D1%8F%20%D1%82%D0%BE%D0%BD%D0%BA%D0%BE%D1%81%D0%BB%D0%BE%D0%B9%D0%BD%D0%B0%D1%8F%20%D0%B3%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D1%8F.%20%D0%94%D0%BB%D0%B8%D0%BD%D0%B0%20%D0%BF%D1%80%D0%BE%D0%B1%D0%B5%D0%B3%D0%B0%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20(%D0%B2%20%D0%BC%D0%B8%D0%BB%D0%BB%D0%B8%D0%BC%D0%B5%D1%82%D1%80%D0%B0%D1%85)%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D1%82%D0%BE%D0%BD%D0%BA%D0%B8%D0%B9%20%D1%81%D0%BB%D0%BE%D0%B9%20%D1%81%D0%B5%D1%84%D0%B0%D0%B4%D0%B5%D0%BA%D1%81%D0%B0%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%D1%81%D1%8F%20%D0%B2%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8%20%D0%BE%D1%82%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20(%D1%80%D0%B8%D1%81.%201.10).%3C/p%3E%20%3Cp%20style=)
.%3C/p%3E%20%3Cp%20style=)
%20%D0%B8%20%D0%B8%D1%85%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8%20(%D0%B2%20%D0%BF%D0%BE%D0%BB%D1%83%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B5%20%D0%BA%D0%BE%D0%BE%D1%80%D0%B4%D0%B8%D0%BD%D0%B0%D1%82).%3C/p%3E%20%3Cp%3E%D0%93%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D1%8F,%20%D0%BA%D1%80%D0%BE%D0%BC%D0%B5%20%D0%BF%D1%80%D0%BE%D1%81%D1%82%D0%BE%D1%82%D1%8B%20%D0%B8%20%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE%D1%82%D1%8B,%20%D0%B8%D0%BC%D0%B5%D0%B5%D1%82%20%D0%B4%D0%BE%D0%BF%D0%BE%D0%BB%D0%BD%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5%20%D0%BF%D1%80%D0%B5%D0%B8%D0%BC%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE:%20%D0%BD%D0%B5%20%D1%82%D1%80%D0%B5%D0%B1%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%D1%8B%D0%B4%D0%B5%D0%BB%D1%8F%D1%82%D1%8C%20%D0%B1%D0%B5%D0%BB%D0%BE%D0%BA%20%D0%B2%20%D1%87%D0%B8%D1%81%D1%82%D0%BE%D0%BC%20%D0%B2%D0%B8%D0%B4%D0%B5,%20%D1%82%D0%B0%D0%BA%20%D0%BA%D0%B0%D0%BA%20%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D1%81%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%BD%D0%B5%20%D0%BC%D0%B5%D1%88%D0%B0%D1%8E%D1%82%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8E,%20%D0%BF%D0%BE%D1%81%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D1%83%20%D0%BA%D0%B0%D0%B6%D0%B4%D1%8B%D0%B9%20%D0%B8%D0%B7%20%D0%BD%D0%B8%D1%85%20%D0%BF%D1%80%D0%BE%D1%85%D0%BE%D0%B4%D0%B8%D1%82%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83%20%D1%81%D0%BE%20%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D0%BE%D0%B9%20%D0%B5%D0%BC%D1%83%20%D1%81%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C%D1%8E,%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8F%D0%B5%D0%BC%D0%BE%D0%B9%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D0%BE%D0%B9.%20%D0%AD%D1%82%D0%BE%20%D0%BE%D0%B1%D1%81%D1%82%D0%BE%D1%8F%D1%82%D0%B5%D0%BB%D1%8C%D1%81%D1%82%D0%B2%D0%BE%20%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%BE%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%20%D1%8D%D0%BD%D0%B7%D0%B8%D0%BC%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D0%B8,%20%D0%BA%D0%BE%D0%B3%D0%B4%D0%B0%20%D0%BE%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D1%8B%D0%BC%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B4%D0%B0%D0%B6%D0%B5%20%D0%BE%D1%87%D0%B5%D0%BD%D1%8C%20%D0%BD%D0%B5%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%BE%D0%B3%D0%BE%20%D0%BA%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B0%20%D1%84%D0%B5%D1%80%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%20%D0%B2%20%D0%BF%D1%80%D0%B8%D1%81%D1%83%D1%82%D1%81%D1%82%D0%B2%D0%B8%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2,%20%D0%BD%D0%B5%20%D0%BE%D0%B1%D0%BB%D0%B0%D0%B4%D0%B0%D1%8E%D1%89%D0%B8%D1%85%20%D0%B0%D0%BD%D0%B0%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%BD%D0%BE%D0%B9%20%D0%BA%D0%B0%D1%82%D0%B0%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E.%3C/p%3E%20%3Cp%3E%D0%9F%D1%80%D0%B8%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8%20%D0%B4%D0%B8%D1%81%D0%BA-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%84%D0%BE%D1%80%D0%B5%D0%B7%D0%B0%20%D0%B2%20%D0%BF%D0%BE%D0%BB%D0%B8%D0%B0%D0%BA%D1%80%D0%B8%D0%BB%D0%B0%D0%BC%D0%B8%D0%B4%D0%BD%D0%BE%D0%BC%20%D0%B3%D0%B5%D0%BB%D0%B5%20%D0%B4%D0%BB%D1%8F%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D1%82%D0%B0%D0%BA%D0%B6%D0%B5%20%D1%81%D1%82%D1%80%D0%BE%D1%8F%D1%82%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%BC%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%BA%D0%B0%D0%BB%D0%B8%D0%B1%D1%80%D0%BE%D0%B2%D0%BE%D1%87%D0%BD%D1%8B%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%B8%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%D1%8B%D1%85%20%D1%87%D0%B0%D1%81%D1%82%D0%B8%D1%86%20%D0%B2%20%D0%BF%D0%BE%D0%BB%D0%B8%D0%B0%D0%BA%D1%80%D0%B8%D0%BB%D0%B0%D0%BC%D0%B8%D0%B4%D0%BD%D0%BE%D0%BC%20%D0%B3%D0%B5%D0%BB%D0%B5,%20%D0%B0%20%D0%B7%D0%B0%D1%82%D0%B5%D0%BC,%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D0%B2%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%20%D0%B8%D1%81%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D0%B5%D0%BC%D0%BE%D0%B3%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%BF%D0%BE%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA%D1%83%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D1%8F%D1%82%20%D0%B5%D0%B3%D0%BE%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20(%D1%80%D0%B8%D1%81.%201.11).%20%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%84%D0%BE%D1%80%D0%B5%D0%B7%20%D0%BF%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D1%8F%D1%82%20%D0%B2%20%D0%BF%D1%80%D0%B8%D1%81%D1%83%D1%82%D1%81%D1%82%D0%B2%D0%B8%D0%B8%20%D0%B4%D0%B5%D1%82%D0%B5%D1%80%D0%B3%D0%B5%D0%BD%D1%82%D0%B0%20%D0%B4%D0%BE%D0%B4%D0%B5%D1%86%D0%B8%D0%BB%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82%D0%B0%20%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F,%20%D1%82%D0%B0%D0%BA%20%D0%BA%D0%B0%D0%BA%20%D1%82%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE%20%D0%B2%20%D1%8D%D1%82%D0%BE%D0%BC%20%D1%81%D0%BB%D1%83%D1%87%D0%B0%D0%B5%20%D0%BD%D0%B0%D0%B1%D0%BB%D1%8E%D0%B4%D0%B0%D0%B5%D1%82%D1%81%D1%8F%20%D0%BF%D1%80%D1%8F%D0%BC%D0%B0%D1%8F%20%D0%BF%D1%80%D0%BE%D0%BF%D0%BE%D1%80%D1%86%D0%B8%D0%BE%D0%BD%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D0%BE%D0%B9%20%D0%B8%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2.%20%D0%91%D0%B5%D0%BB%D0%BA%D0%B8%20%D1%81%20%D1%87%D0%B5%D1%82%D0%B2%D0%B5%D1%80%D1%82%D0%B8%D1%87%D0%BD%D0%BE%D0%B9%20%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%BE%D0%B9%20%D0%BF%D1%80%D0%B8%20%D1%8D%D1%82%D0%B8%D1%85%20%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F%D1%85%20%D1%80%D0%B0%D1%81%D0%BF%D0%B0%D0%B4%D0%B0%D1%8E%D1%82%D1%81%D1%8F%20%D0%BD%D0%B0%20%D1%81%D1%83%D0%B1%D1%8A%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D1%8B,%20%D0%BF%D0%BE%D1%8D%D1%82%D0%BE%D0%BC%D1%83%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%20%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%BE%D0%B5%20%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B4%D0%BB%D1%8F%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D1%81%D1%83%D0%B1%D1%8A%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0.%3C/p%3E%20%3Cp%20style=)
