- Относительная атомная и молекулярная масса
- Количество вещества. Постоянная Авогадро
- Молярная масса
- Молярный объем
- Задачи
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Атомная единица массы – внесистемная единица, равная 1/12 массы свободного покоящегося атома углерода (^{12}mathrm{C}), находящегося в основном состоянии. $$ 1 text{а. е. м}approx 1,66cdot 10^{-27} text{кг} $$
Относительная атомная масса – это физическая величина, показывающая, во сколько раз масса данного атома больше атомной единицы массы: $$ A_rapprox frac{m_{at}}{1,66cdot 10^{-27}} $$
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.

Например:
(A_r(mathrm{H})=1,00797 text{а. е. м}) – относительная атомная масса водорода
(A_r(mathrm{C})=12,01115 text{а. е. м}) – относительная атомная масса углерода
(A_r(mathrm{N})=14,0067 text{а. е. м}) – относительная атомная масса азота
(A_r(mathrm{O})=15,9994 text{а. е. м}) – относительная атомная масса кислорода
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
Например: $$ A_r(mathrm{H})=1, A_r(mathrm{C})=12, A_r(mathrm{N})=14, A_r(mathrm{O})=16 $$
Относительная молекулярная масса вещества – это физическая величина, показывающая, во сколько раз масса одной молекулы данного вещества больше атомной единицы массы: $$ M_rapprox frac{m_{mol}}{1,66cdot 10^{-27}} $$ Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, из которых состоит данное вещество: $$ M_r=sum A_r $$
Например:
Найдем относительную молекулярную массу молекулы воды (mathrm{H_2O}), которая состоит из двух атомов водорода и одного атома кислорода $$ M_r(mathrm{H_2O})=2A_r(mathrm{H})+A_r(mathrm{O})=2cdot 1+16=18 $$
Масса молекулы вещества равна произведению относительной молекулярной массы данного вещества на величину 1 а.е.м., выраженную в килограммах: $$ m_{mol}approx 1,66cdot 10^{-27}cdot M_r (text{кг}) $$
Например:
Масса молекулы водорода $$ m(mathrm{H_2O})=approx 1,66cdot 10^{-27}cdot 18approx 2,99cdot 10^{-26} (text{кг}) $$
п.2. Количество вещества. Постоянная Авогадро
Моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
В 1 моле любого вещества содержится одинаковое количество частиц $$ N_Aapprox 6,022cdot 10^{23} $$ Число (N_A) называют постоянной Авогадро.
Количество вещества – физическая величина, равная отношению числа однотипных структурных элементов (атомов, молекул, ионов), содержащихся в веществе, к числу Авогадро: $$ nu=frac{N}{N_A} $$ Единицей измерения количества вещества в СИ является моль.
Например:
В 5 молях углерода будет содержаться (N=5cdot N_Aapprox 6,022cdot 10^{23}approx 3,01cdot 10^{24}) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет (N=5cdot N_Aapprox 3,01cdot 10^{24}) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества.
Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Молярная масса воды $$ mu(mathrm{H_2O})=M_r(mathrm{H_2O})cdot 10^{-3}=18cdot 10^{-3}frac{text{кг}}{text{моль}} $$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева
Шаг 1. По таблице Менделеева найти относительные атомные массы (A_{ri}) для всех элементов, входящих в молекулу вещества.
Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $$ M_r=sum_i A_{ri} $$ Шаг 3. Записать молярную массу в виде $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Найдем молярную массу этилового спирта begin{gather*} A_r(mathrm{C})=12, A_r(mathrm{H})=1, A_r(mathrm{O})=16\ M_r(mathrm{C_2H_5OH})= 2A_r(mathrm{C})+6A_r(mathrm{H}) +A_r(mathrm{O})=2cdot 12+6cdot 1+16=46\ mu(mathrm{C_2H_5OH})=46cdot 10^{-3}frac{text{кг}}{text{моль}} end{gather*}
п.4. Молярный объем
Молярный объем – это объем 1 моля вещества.
Молярный объем равен отношению молярной массы к плотности вещества: $$ V_{mu}=frac{mu}{rho} $$
Например:
Молярный объем воды begin{gather*} V_{mu}(mathrm{H_2O})=frac{18cdot 10^{-3} text{кг/моль}}{10^3 text{кг/м}^3}=18cdot 10^{-6}frac{text{м}^3}{text{моль}}=18frac{text{cм}^3}{text{моль}}=18frac{text{мл}}{text{моль}} end{gather*} Т.е. 1 моль воды занимает объем 18 мл (столовая ложка).
При нормальных условиях (t=0°C, ρ=1 атм) молярные объемы всех идеальных газов одинаковы и равны: $$ V_{mu text{газ}}=22,4frac{text{л}}{text{моль}} $$
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы (mathrm{S_8}) содержится в этом кристалле? (Ответ округлите до двух значащих цифр).
Дано:
(m=16 text{г}=16cdot 10^{-3} text{кг})
(A_r=32)
(N_A=6,022cdot 10^{23})
__________________
(N-?)
Относительная молекулярная масса одной молекулы $$ M_r=8cdot A_r=8cdot 32=256 $$ Молярная масса $$ mu=256cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в кристалле серы: $$ nu=frac{N}{N_A}=frac{m}{mu} $$ Количество молекул в кристалле серы: $$ N=frac{m}{mu}N_A $$ $$ N=frac{1,6cdot 10^{-3}}{256cdot 10^{-3}}cdot 6,022cdot 10^{23}approx 3,8cdot 10^{22} $$ Ответ: (3,8cdot 10^{22})
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода (mathrm{O_2}). Одному космонавту по норме требуется 600 литров кислорода в сутки. Считая условия для газа приблизительно нормальными, определите, на сколько часов космонавту хватит полученного кислорода.
Дано:
(m=1,6 text{кг})
(V_t=600frac{text{л}}{text{сут}}=25frac{text{л}}{text{ч}})
(A_r=16)
(V_{mu}=22,4frac{text{л}}{text{моль}})
__________________
(t-?)
Относительная молекулярная масса молекулы кислорода $$ M_r=2cdot A_r=32 $$ Молярная масса кислорода $$ mu=32cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в полученном кислороде $$ nu=frac{m}{nu}=frac{V}{V_{mu}} $$ Объем полученного кислорода $$ V=frac{m}{mu}=V_{mu} $$ Количество часов для дыхания одного человека begin{gather*} t=frac{V}{V_t}=frac{m}{mu}frac{V_{mu}}{V_t}\[6pt] t=frac{1,6 text{кг}}{32cdot 10^{-3} text{кг/моль}}cdot frac{22,4 text{л/моль}}{25 text{л/ч}}=44,8 text{ч} end{gather*} Ответ: 44,8 ч.
Как узнать относительную молекулярную (атомную) массу?
Значение относительной атомной массы для данного вещества можно узнать из Периодической системы элементов (таблицы Менделеева), округлив приведенное там значение до целого. Например, относительные атомные массы гелия, углерода и кислорода равны, соответственно, 4, 12 и 16.
Чтобы определить относительную молекулярную массу, надо знать химическую формулу данного вещества. Например, молекулярная масса воды (химическая формула 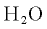 ) равна 18, поскольку молекула воды состоит из двух атомов водорода (относительная атомная масса каждого атома водорода равна 1) и одного атома кислорода (относительная атомная масса атома кислорода равна 16).
) равна 18, поскольку молекула воды состоит из двух атомов водорода (относительная атомная масса каждого атома водорода равна 1) и одного атома кислорода (относительная атомная масса атома кислорода равна 16).
Молекулярная физика и термодинамика.
2014
Как найти относительную молекулярную массу
Относительная молекулярная масса вещества (или просто – молекулярная масса) – это отношение значения массы данного вещества к 1/12 массы одного атома углерода (C).Найти относительную молекулярную массу очень легко.
Вам понадобится
- Таблица Менделеева и таблица молекулярных масс
Инструкция
Относительная молекулярная масса вещества – это сумма его атомных масс. Для того, чтобы узнать атомную массу того или иного химического элемента, достаточно взглянуть на таблицу Менделеева. Ее можно найти на обложке любого учебника по химии, или же приобрести отдельно в книжном магазине. Для школьника вполне подойдет карманный вариант, или лист формата A4. Любой современный кабинет химии оснащен полномасштабной настенной таблицей Менделеева.
Узнав атомную массу элемента, можно приступить к вычислению и молекулярной массы вещества. Это проще всего показать на примере:
Требуется рассчитать молекулярную массу воды (H2O). Из молекулярной формулы видно, что молекула воды состоит из двух атомов водорода H и одно атома кислорода O. Поэтому расчет молекулярной массы воды можно свести к действию:
1.008*2 + 16 = 18.016
Помимо указанного выше способа, данные о молекулярной массе некоторых химических соединений можно подчеркнуть из таблицы молекулярных масс.
Видео по теме
Обратите внимание
Атомная масса как понятие появилось в 1803 году, благодаря трудам известного в те времена химика Джона Дальтона. В те времена масса любого атома сравнивалась с массой атома водорода. Дальнейшее развитие это понятие получило в трудах другого химика – Берцелиуса, в 1818 году, когда он предложил использовать вместо атома водорода атом кислорода. С 1961 года химики всех стран приняла за единицу атомной массы массу 1/16 атома кислорода, либо массу 1/12 атома углерода. Последняя как раз и указана в таблице химических элементов Менделеева.
Полезный совет
При использовании таблицы Менделеева в том виде, в котором она представлена в большинстве учебников по химии и иных справочниках, надо понимать, что данная таблица является укороченным вариантом исходной таблицы Менделеева. В наиболее полном ее варианте, каждому химическому элементу посвящена отдельная строка.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Цели урока:
обучающая: Познакомится с важнейшими величинами, которые используются в молекулярной физике. Понять физический смысл каждой из этих величин и определить их взаимосвязь.
развивающая: развитие умения применять полученные знания на практике, научится пользоваться таблицей Менделеева для решения задач по молекулярной физике.
воспитывающая: воспитание дисциплины и норм поведения, творческого отношения к изучаемому предмету; стимулировать активность учащихся, повышать мотивацию к изучению физики.
Методы:
словесный — беседа;
наглядный — видеоурок;
контролирующий — решение задач с использованием наглядных примеров
Ход урока:
1. Организационный этап.
Добрый день. Прежде чем мы приступим к уроку, хотелось бы, чтобы каждый из вас настроился на рабочий лад.
2. Актуализация знаний.
Совсем недавно мы приступили к изучению молекулярной физики. На сегодняшнем уроке мы дадим представление о массе молекул, а также введем совершенно новую величину, которая называется количеством вещества.
3. Объяснение нового материала.
Как вы понимаете, масса и размеры молекул крайне малы. Например, в одном стакане воды содержится просто огромное количество молекул.
Поэтому, для удобства вводится такая величина, как относительная молекулярная масса. Эта величина определяется как отношение массы молекулы (или атома) данного вещества к одной двенадцатой массы атома углерода. Таким образом, массы всех химических элементов можно выразить в атомных единицах массы.

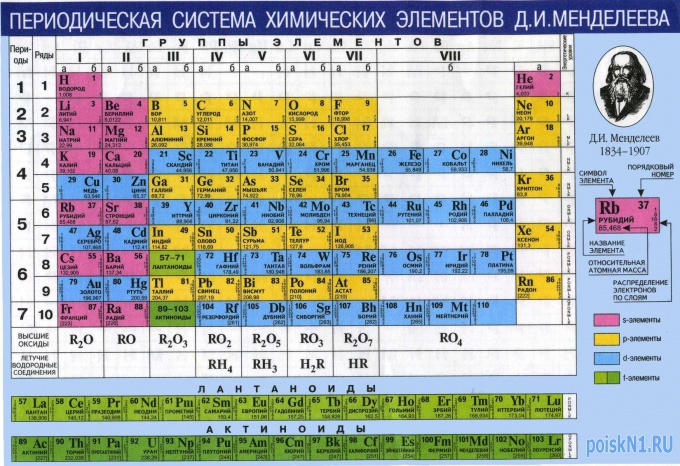
В таблице Менделеева собраны данные обо всех известных химических элементах. В частности, из этой таблицы можно узнать относительную молекулярную массу. На примере соляной кислоты мы научимся, как вычислять относительную молекулярную массу любого соединения с помощью таблицы Менделеева.
Помимо характеристики массы молекул, необходимо характеризовать и количество молекул, содержащихся в той или иной массе данного вещества. Для этого вводится такая величина, как количество вещества. Единицей измерения этой величины является моль. Один моль — это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится атомов в двенадцати граммах углерода.

В связи с этим, вводится еще одна величина, которая называется молярной массой. Молярная масса — это масса данного вещества, взятого в количестве один моль. Эта величина измеряется в килограммах на моль.

Молярную массу также можно взять из таблицы Менделеева. Только обязательно нужно помнить о том, что в таблице Менделеева молярная масса указана в граммах на моль. Ну и конечно, ни в коем случае нельзя путать относительную молекулярную массу с молярной массой, несмотря на то, что в таблице Менделеева эти величины численно равны.

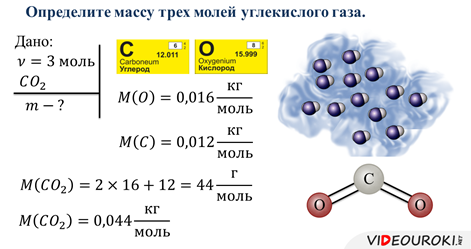
4. Решение задач.
Ну и конечно, необходимо рассмотреть практическое применение полученных знаний, то есть, решение задач.
5. Рефлексия
Хотелось бы услышать ваши отзывы о сегодняшнем уроке: что вам понравилось, что не понравилось, чем бы хотелось узнать еще.
6. Домашнее задание.
7. Итоги урока
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
