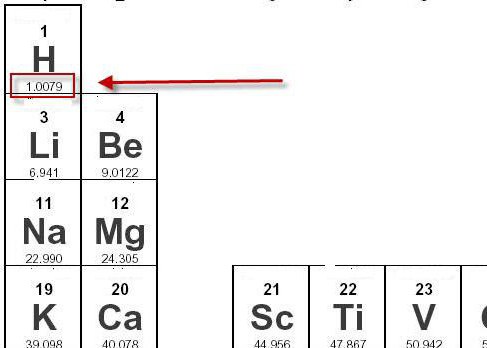
← Молярная и молекулярная масса
- Относительная молекулярная масса H: 1.00794
- Молярная масса H: 1.00794 г/моль (0.00101 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 1 | 1.00794 | 1.00794 |
| 1.00794 |
Расчёт молярной и относительной молекулярной массы H
- Mr[H] = Ar[H] = 1.00794 = 1.00794
- Молярная масса (в кг/моль) = Mr[H] : 1000 = 1.00794 : 1000 = 0.00101 кг/моль
Электронная конфигурация атома водорода
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CrO4Rb2 [286.9293]
H2O3Si [78.09958]
Калькулятор молекулярной массы

- Относительная атомная и молекулярная масса
- Количество вещества. Постоянная Авогадро
- Молярная масса
- Молярный объем
- Задачи
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Атомная единица массы – внесистемная единица, равная 1/12 массы свободного покоящегося атома углерода (^{12}mathrm{C}), находящегося в основном состоянии. $$ 1 text{а. е. м}approx 1,66cdot 10^{-27} text{кг} $$
Относительная атомная масса – это физическая величина, показывающая, во сколько раз масса данного атома больше атомной единицы массы: $$ A_rapprox frac{m_{at}}{1,66cdot 10^{-27}} $$
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
(A_r(mathrm{H})=1,00797 text{а. е. м}) – относительная атомная масса водорода
(A_r(mathrm{C})=12,01115 text{а. е. м}) – относительная атомная масса углерода
(A_r(mathrm{N})=14,0067 text{а. е. м}) – относительная атомная масса азота
(A_r(mathrm{O})=15,9994 text{а. е. м}) – относительная атомная масса кислорода
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
Например: $$ A_r(mathrm{H})=1, A_r(mathrm{C})=12, A_r(mathrm{N})=14, A_r(mathrm{O})=16 $$
Относительная молекулярная масса вещества – это физическая величина, показывающая, во сколько раз масса одной молекулы данного вещества больше атомной единицы массы: $$ M_rapprox frac{m_{mol}}{1,66cdot 10^{-27}} $$ Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, из которых состоит данное вещество: $$ M_r=sum A_r $$
Например:
Найдем относительную молекулярную массу молекулы воды (mathrm{H_2O}), которая состоит из двух атомов водорода и одного атома кислорода $$ M_r(mathrm{H_2O})=2A_r(mathrm{H})+A_r(mathrm{O})=2cdot 1+16=18 $$
Масса молекулы вещества равна произведению относительной молекулярной массы данного вещества на величину 1 а.е.м., выраженную в килограммах: $$ m_{mol}approx 1,66cdot 10^{-27}cdot M_r (text{кг}) $$
Например:
Масса молекулы водорода $$ m(mathrm{H_2O})=approx 1,66cdot 10^{-27}cdot 18approx 2,99cdot 10^{-26} (text{кг}) $$
п.2. Количество вещества. Постоянная Авогадро
Моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
В 1 моле любого вещества содержится одинаковое количество частиц $$ N_Aapprox 6,022cdot 10^{23} $$ Число (N_A) называют постоянной Авогадро.
Количество вещества – физическая величина, равная отношению числа однотипных структурных элементов (атомов, молекул, ионов), содержащихся в веществе, к числу Авогадро: $$ nu=frac{N}{N_A} $$ Единицей измерения количества вещества в СИ является моль.
Например:
В 5 молях углерода будет содержаться (N=5cdot N_Aapprox 6,022cdot 10^{23}approx 3,01cdot 10^{24}) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет (N=5cdot N_Aapprox 3,01cdot 10^{24}) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества.
Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Молярная масса воды $$ mu(mathrm{H_2O})=M_r(mathrm{H_2O})cdot 10^{-3}=18cdot 10^{-3}frac{text{кг}}{text{моль}} $$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева
Шаг 1. По таблице Менделеева найти относительные атомные массы (A_{ri}) для всех элементов, входящих в молекулу вещества.
Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $$ M_r=sum_i A_{ri} $$ Шаг 3. Записать молярную массу в виде $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Найдем молярную массу этилового спирта begin{gather*} A_r(mathrm{C})=12, A_r(mathrm{H})=1, A_r(mathrm{O})=16\ M_r(mathrm{C_2H_5OH})= 2A_r(mathrm{C})+6A_r(mathrm{H}) +A_r(mathrm{O})=2cdot 12+6cdot 1+16=46\ mu(mathrm{C_2H_5OH})=46cdot 10^{-3}frac{text{кг}}{text{моль}} end{gather*}
п.4. Молярный объем
Молярный объем – это объем 1 моля вещества.
Молярный объем равен отношению молярной массы к плотности вещества: $$ V_{mu}=frac{mu}{rho} $$
Например:
Молярный объем воды begin{gather*} V_{mu}(mathrm{H_2O})=frac{18cdot 10^{-3} text{кг/моль}}{10^3 text{кг/м}^3}=18cdot 10^{-6}frac{text{м}^3}{text{моль}}=18frac{text{cм}^3}{text{моль}}=18frac{text{мл}}{text{моль}} end{gather*} Т.е. 1 моль воды занимает объем 18 мл (столовая ложка).
При нормальных условиях (t=0°C, ρ=1 атм) молярные объемы всех идеальных газов одинаковы и равны: $$ V_{mu text{газ}}=22,4frac{text{л}}{text{моль}} $$
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы (mathrm{S_8}) содержится в этом кристалле? (Ответ округлите до двух значащих цифр).
Дано:
(m=16 text{г}=16cdot 10^{-3} text{кг})
(A_r=32)
(N_A=6,022cdot 10^{23})
__________________
(N-?)
Относительная молекулярная масса одной молекулы $$ M_r=8cdot A_r=8cdot 32=256 $$ Молярная масса $$ mu=256cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в кристалле серы: $$ nu=frac{N}{N_A}=frac{m}{mu} $$ Количество молекул в кристалле серы: $$ N=frac{m}{mu}N_A $$ $$ N=frac{1,6cdot 10^{-3}}{256cdot 10^{-3}}cdot 6,022cdot 10^{23}approx 3,8cdot 10^{22} $$ Ответ: (3,8cdot 10^{22})
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода (mathrm{O_2}). Одному космонавту по норме требуется 600 литров кислорода в сутки. Считая условия для газа приблизительно нормальными, определите, на сколько часов космонавту хватит полученного кислорода.
Дано:
(m=1,6 text{кг})
(V_t=600frac{text{л}}{text{сут}}=25frac{text{л}}{text{ч}})
(A_r=16)
(V_{mu}=22,4frac{text{л}}{text{моль}})
__________________
(t-?)
Относительная молекулярная масса молекулы кислорода $$ M_r=2cdot A_r=32 $$ Молярная масса кислорода $$ mu=32cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в полученном кислороде $$ nu=frac{m}{nu}=frac{V}{V_{mu}} $$ Объем полученного кислорода $$ V=frac{m}{mu}=V_{mu} $$ Количество часов для дыхания одного человека begin{gather*} t=frac{V}{V_t}=frac{m}{mu}frac{V_{mu}}{V_t}\[6pt] t=frac{1,6 text{кг}}{32cdot 10^{-3} text{кг/моль}}cdot frac{22,4 text{л/моль}}{25 text{л/ч}}=44,8 text{ч} end{gather*} Ответ: 44,8 ч.
Как найти массу водорода
Молекулярная масса представляет собой молекулярный вес, который также можно назвать значением массы молекулы. Выражается молекулярная масса в атомных единицах массы. Если разобрать значение молекулярной массы по частям, то получится, что сумма масс всех атомов, входящих в состав молекулы и представляет собой её молекулярную массу. Если говорить о единицах измерения массы, то преимущественно все измерения производятся в граммах.
Инструкция
Само понятие молекулярной массы связано с понятием молекулы. Но нельзя сказать, что это условие можно применить только к таким веществам, где молекула, например, водорода, находится отдельно. Для случаев, когда молекулы находятся не отдельно от остальных, а в тесной взаимосвязи, все вышеперечисленные условия и определения также действительны.
Для начала, чтобы определить массу водорода, вам потребуется какое-либо вещество, в состав которого входит водород и из которого его можно будет несложно выделить. Это может быть какой-либо спиртовой раствор или другая смесь, часть компонентов которой при определённых условиях меняет своё состояние и легко освобождает раствор от своего присутствия. Найдите раствор, из которого можно и спарить необходимые или ненужные вещества при помощи нагревания. Это самый лёгкий способ. Теперь определитесь, будете вы испарять вещество, которое вам не нужно или же это будет водород, молекулярную массу которого вы и планируете измерять. Если испарится ненужное вещество – ничего страшного, главное, чтобы оно было не токсично. в случае же испарения искомого вещества, вам необходимо приготовить оборудование, что все испарения сохранились в колбе.
После того, как вы отделили от состава всё ненужное, приступайте к измерениям. Для этого вам подойдёт число Авогадро. Именно с его помощью вы сможете вычислить относительную атомную и молекулярную массу водорода. Найдите все необходимые параметры водорода которые присутствуют в любой таблице, определите плотность полученного газа, так как она пригодится для одной из формул. Затем подставьте все полученные результаты и, если необходимо, поменяйте единицу измерения на граммы, о чём уже говорилось выше.
Понятие молекулярной массы наиболее актуально для случаев, когда речь идёт о полимерах. Именно для них важнее вводить понятие средней молекулярной массы, ввиду неоднородности входящих в их состав молекул. Также по средней величине молекулярной массы можно судить о том, насколько высока степень полимеризации того или иного вещества.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
ответы
По таблице Менделеева находим, что относительные атомные массы водорода и гелия равны соответственно: Mr(Н) = 1, М(Hе) = 4. Химическая формула водорода — Н2. Следовательно, его относительная молекулярная масса и молярная масса равны соответственно: Мr(Н2) = 2∙1=2, М(Н2) = 10-3 • Мr(Н2) = 2 • 10-3 кг/моль. Химическая формула гелия — Не. Следовательно, его относительная молекулярная масса и молярная масса равны соответственно Mr(He) = 4, М(Не) = 10-3 ∙ Мr(Hе) = 4 • 10-3 кг/моль.
ваш ответ
похожие темы
похожие вопросы 5
Задачи из школьного курса химии довольно часто предлагают самостоятельно обращаться к справочникам постоянных величин. Так учащиеся получают навыки самостоятельной работы со справочной литературой и учатся получать информацию из комбинированных источников. Так, старшеклассникам предлагается самостоятельно узнать, чему равна молярная масса водорода, или попытаться определить ее самостоятельно. Для решения подобных задач нужно четко понимать, что такое молярная масса, как она определяется и для чего это нужно.
Определение
Впервые понятие молярной массы было введено в обращение непосредственно после признание меры «моль» в качестве меры количества вещества. Измеряется эта величина в [г /моль]. Таким образом, молярная масса водорода – это определенная его масса, заключенная в одном моле данного элемента.
Поскольку в молях измеряется количество, выраженное в количестве самых малых частиц исследуемого вещества, разницы между молекулярной и молярной массой нет. эти единицы тождественны.
Молекулярная и молярная масса водорода
Абсолютными значениями молекулярных масс, в силу их чрезвычайно малой величины, пользоваться очень затруднительно. Например, абсолютная масса атома водорода, выраженная в стандартах системы СИ, составляет 1,67 × 10 -24 грамм.
Поэтому в химии используют относительную атомную массу. Ее величина составляет 1/12 массы атома углерода. В этой шкале водород имеет наименьший молекулярный вес, так как его атом – самый легкий среди всех существующих элементов.
Определение молярной массы
Молярная масса водорода может быть легко определена при помощи периодической таблицы. Внизу возле каждого химического элемента обозначена величина его относительной атомной массы. Так, возле водорода стоит значение 1,0079.
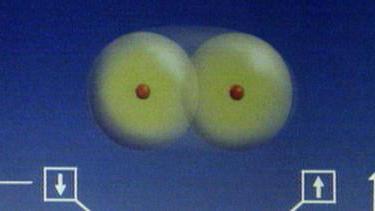
Из курса неорганической химии известно, что водород в атомарном состоянии в естественных условиях практически не встречается. Атомы этого элемента в свободном состоянии стремятся объединиться в молекулы. Поскольку валентность водорода равна 1, атом Н может присоединить к себе еще только один атом другого элемента. Таким образом, молекула водорода выглядит так:
А в химических записях формула молекулы водорода имеет вид Н2. Зная формулу элемента, легко вычислить его относительную молекулярную (а значит, и молярную) массу. Из полученных данных легко вычисляется молярная масса водорода:
1,00 × 2 = 2,00 г/моль. Точное химическое взвешивание дает значение 2,016 г/моль.