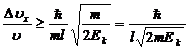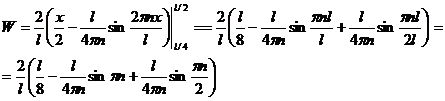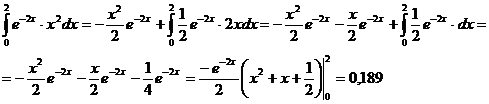Соотношение неопределённостей
Обнаружение волновых
свойств микрочастиц означает, что
классическая механика не может дать
правильного описания поведения
микрообъектов. Новая физическая теория,
устанавливающая законы движения и
взаимодействия микрочастиц и фотонов
с учетом их волновых и корпускулярных
свойств, была разработана, главным
образом, тремя физиками: Э. Шредингером
(австр.), В. Гейзенбергом (нем.) и П. Дираком
(англ.) в начале ХХ века и получила
название волновой или квантовой
механики.
В
классической механике всякая частица
движется по определённой траектории,
так что ее координаты и импульс могут
быть точно рассчитаны для любого момента
времени. Совсем по иному обстоит дело,
если рассматривается вопрос о локализации
волнового процесса, т.е. о месте нахождения
волны в данный момент времени. Ведь
волна не имеет ни определенной траектории,
ни определенной координаты. Т.о. возникает
необходимость внести некоторые
ограничения в применении к объектам
микромира понятий классической механики.
Эти
ограничения сформулированы Гейзенбергом
и получили название соотношений
неопределенностей. Основное из них
гласит: чем
точнее определены какие-либо из координат
частицы, тем больше неопределенность
в значении составляющей импульса (или
скорости) в том же направлении, и наоборот.
Количественно это записывается так:
Δx·Δpx
≥ ђ Δx·Δυx
≥ ђ/m,
Δy·Δpy
≥ ђ
Δy·Δυy
≥ ђ/m,
(3)
Δz·Δpz
≥ ђ
Δz·Δυ
z ≥
ђ/m,
где
Δx,
Δy,
Δz
– неопределенности координат; Δpx,
Δpy,
Δpz
– неопределенности проекций импульса
на оси – x,
y,
z;
Δυx,
Δυy
, Δυz
– неопределенности проекций скоростей
на соответствующие оси; m – масса
микрочастицы; ђ = h/2π – постоянная Планка
с крышечкой.
Из
соотношения неопределенностей следует:
если
положение частицы точно известно
(Δx=0),
то в этом состоянии проекция импульса
на ось х-ов совершенно не определена
(Δpх
→
∞), и
наоборот.
Покажем, что
соотношение неопределенностей
действительно вытекает из волновых
свойств микрочастиц.
Рассмотрим мысленный опыт по дифракции
потока электронов на щели шириной Δx
~ λ, расположенной
перпендикулярно к направлению движения
частиц (рис. 3).
Д
прохождения через щель pх
= 0; ∆pх = 0, а координатаxне определена, т.е. ∆x→ ∞. В
момент прохождения через щель координата
электрона имеет неопределенность ∆xравную ширине щели. В то же время, из-за
дифракции, электроны отклоняются от
первоначального направления и будут
двигаться в пределах угла 2φ, где φ –
угол дифракции. Теперь появляется
неопределенность в значении составляющей
импульса вдоль осиx-ов:
∆pх
= p∙sinφ = h sinφ /λБ
. (4)
Если
даже ограничиться электронами,
попадающими на экран в пределах
центрального максимума, то sinφ найдем
из условия 1-ого минимума на щели (bsinφ
= kλ,
где b
– ширина щели, k
– порядок минимума):
∆x∙sinφ
= λБ. (5)
Подставляя
выражение для sinφ в (4), после преобразования
получим
Δx·Δpx
= h
(6)
Учитывая
главные max более высоких порядков, куда
тоже попадают электроны, окончательно
будем иметь:
Δx·Δpx
≥ h ≥
ђ (7)
Следует
подчеркнуть, что невозможность
одновременного и точного определения
координаты и соответствующей составляющей
импульса не связана с несовершенством
наших знаний или неточностью приборов,
а является следствием специфических
и вместе с тем объективных свойств
микрообъектов.
Проиллюстрируем
оценку границ применимости теории на
примерах.
-
Скорость
движения электрона в электроннолучевой
трубке составляет υх=106
м/с и
определена с точностью до Δυх=102
м/с. Тогда
неопределенность координаты:
Δx·Δυx
≥ ђ/m,
.
Т.е.
в данном случае можно говорить о точке
падения каждого отдельного электрона
на экран и о траектории.
-
Скорость
движения электрона в атоме водорода
υх
~ 106
м/с,
неопределенность координаты порядка
диаметра атома Δx
= d ~10-10
м. Тогда
неопределенность величины скорости
Т.е.
неопределенность скорости соизмерима
с самой скоростью. Это означает, что
электрон не может теперь рассматриваться
как дискретная частица.
Соотношение
неопределенностей может быть записано
для любой пары взаимосвязанных
характеристик состояния микрочастиц,
например, для энергии и времени пребывания
в этом энергетическом состоянии:
ΔЕ·Δt
≥ ђ. (8)
Из
данного соотношения видно, что разброс
энергии ΔЕ = ђ/Δt возрастает с уменьшением
среднего времени пребывания системы в
состоянии с энергией Е. Отсюда, следует,
что частота излученного фотона также
должна иметь неопределенность:
Δv
= ΔЕ / h,
(9)
т.е. линии
спектра, обусловленные переходом
электронов между уровнями Е1и
Е2 с ΔЕ = Е1– Е2, будут
иметь размытие по частоте равное Δv=
v0 ±ΔЕ / h, что подтверждается
опытом.
ВОЛНОВАЯ
ФУНКЦИЯ
Дифракционная картина, наблюдаемая для
микрочастиц, характеризуется неодинаковым
распределением рассеянных частиц по
разным направлениям. С точки зрения
волновой теории это означает, что
направлениям максимумов соответствует
наибольшая интенсивность волн де Бройля,
а минимумам – наименьшая. Т.е. интенсивность
волны де Бройля в данной точке пространства
определяет число частиц, попавших в эту
точку. Т.о. дифракционная картина
для микрочастиц является проявлением
статистической закономерности. Это
означает, что описание поведения
микрочастиц должно носить вероятностный
характер, что и является важнейшей
отличительной особенностью квантовой
механики от классической.
Состояние микрочастиц в квантовой
механике описывается с помощью, так
называемой, волновой функции вида ψ =
f(x,y,z,t). Ее называют
еще ψ-функция. Квадрат модуля ψ-функции
определяет вероятность обнаружения
частицы в момент времени t в области с
координатами:xиx+ dx;yиy+ dy;z иz+ dz–
т.е. в элементе объема dV = dxdydz:
dW = | ψ |2dV. (10)
Величина
| ψ |2
= dW /dV – имеет смысл плотности вероятности,
т.е. определяет вероятность нахождения
частицы в единичном объеме в окрестностях
точки с координатами x,y,z.
Т.о. физический
смысл имеет не сама ψ-функция, а квадрат
её модуля –
|ψ|2,
которым и задается интенсивность волн
де Бройля.
Теперь вероятность найти частицу в
момент времени t в объеме V будет:
. (11)
Очевидно, что
объективность существования частицы
во времени и в пространстве будет
выражаться вероятностью достоверного
события:
. (12)
Это соотношение
является условием нормировки ψ- функции.
Волновая функция
позволяет рассчитать вероятность
реализации тех или иных значений
параметров микрообъекта или их средние
величины, например, расстояние электрона
от ядра атома или вероятность перехода
электрона с одного энергетического
уровня на другой, что в свою очередь
позволяет оценить относительную
интенсивность спектральных линий.
Что бы ψ-функция
являлась объективной характеристикой
состояния микрочастицы она должна
удовлетворять следующим условиям: быть
1) конечной, т.к. W ≤ 1; 2) однозначной,
т.к. вероятность не может быть неоднозначной;
3) непрерывной, т.к. вероятность не может
изменяться скачком.
Соседние файлы в папке Физика
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Автор
Тема: Определить относительную неопределенность скорости электрона (Прочитано 2606 раз)
0 Пользователей и 1 Гость просматривают эту тему.

cobra369
- Новичок
- Сообщений: 1
-

Определить относительную неопределенность скорости электрона
« : 13 Мая 2012, 21:37:58 »
Здравствуйте! Надеюсь на Вашу помощь в решении задачи по физике.
Начну:
Что я сделал:
т.к. (дельта)x*P>=h/2*pi => V=h/2*pi*m*(дельта)*x – это будет являться относительной неопределенность скорости электрона?
или же так:
т.к.mV*V=2*Eкинет.=> P=(2*Eкинет.)/v => (дельта)x*(2*Eкинет.)/v>=h/2*pi => V=[(дельта)x*2*Eкинет.*2*pi]/h – или такой вариант?)
Определение длины волны. Относительная неопределенность скорости электрона. Функции частицы
1. Найти дебройлевскую длину волны молекул водорода,
соответствующую их наиболее вероятной скорости при .
Дано:
Решение:
Длина
волны де Бройля определяется по формуле:
– постоянная Планка.
– импульс частицы,
.
Средняя квадратичная скорость молекул газа определяется
выражением (Проверьте формулу)
,
где
– универсальная газовая постоянная,
– молярная масса водорода.
Массу одной молекулы найдем делением ее молярной массы на
постоянную Авогадро (моль-1):
Тогда импульс частицы можно выразить формулой:
,
а длину волны де Бройля – соотношением
.
Произведя вычисления по этой формуле, получим:
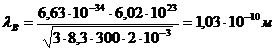
. Электрон с кинетической энергией локализован в области размером
. Оценить с помощью соотношения неопределенностей
относительную неопределенность
его скорости.
Дано:
Решение
Соотношение неопределенностей Гейзенберга для координаты и
импульса имеет вид:
,
где – неопределенность координаты,
– неопределенность импульса,
– постоянная Планка,
Поскольку неопределенность координаты не больше линейного размера структуры
, а неопределенность импульса можно
выразить через неопределенность скорости , получаем:
, Откуда
.
Для определения относительной неопределенности скорости необходимо
значение скорости; выразим ее из кинетической энергии для классического случая,
поскольку выполняется условие Ек << Е0
(энергия покоя электрона Е0 составляет 0,511 МэВ):
Находим относительную неопределенность скорости
Подставляя значения величин, находим:
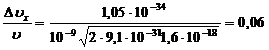
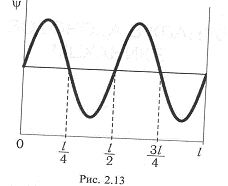
. Частица находится в одномерном потенциальном ящике с бесконечно
высокими стенками. – функция имеет вид, показанный на
рисунке. Найти вероятность пребывания частицы в области .
Дано
Вероятность пребывания микрочастицы в окрестностях точки х (в
одномерном случае):
.
Волновая функция частицы, находящейся в бесконечно глубоком
одномерном прямоугольном потенциальном ящике:
.
Определим состояние частицы из графических соображений. Как видно из рисунка,
,
поэтому можем записать равенства
.
Очевидно, что выполняются при любых значениях
.
Для того чтобы волновая функция обращалась в нуль во всех
требуемых точках, аргументы функции синуса должны удовлетворять также условиям
,
где – целое число. Таким образом,
должны быть целочисленными, откуда
следует, что .
Находим вероятность пребывания электрона во второй четверти ящика:
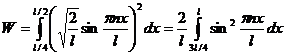
Воспользовавшись тригонометрическим тождеством
,
приходим к выражению:
Подставляя значения величин, находим
.
Заметим, что графический метод определения вероятности дает такой
же результат (площадь фигуры, ограниченной графиком функции в указанных
пределах, составляет четверть от площади фигуры, ограниченной графиком на всей
длине ящика). Ответ:
. Электрон в атоме находится в – состоянии. Найти орбитальный момент импульса
электрона и максимальное значение
проекции момента импульса на направление внешнего магнитного поля.
Дано:
– состояние
Решение
,
где
– орбитальное квантовое число.
– постоянная Планка.
– состоянию электрона соответствует значение орбитального
квантового числа .
Проекция вектора орбитального момента импульса на направление
внешнего магнитного поля так же квантуется, то есть может принимать лишь
целочисленные значения, кратные :
,
где
– магнитное квантовое число, может принимать значения
.
Нетрудно видеть, что максимальное значение магнитного квантового
числа равно орбитальному квантовому числу , поэтому максимальное значение проекции момента импульса
на направление внешнего магнитного поля
определяется выражением:
.
Подставляем численные значения и вычисляем:
,
.
Ответ: ;
. Пси-функция основного состояния водородного атома имеет вид
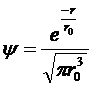
где
– радиус первой боровской орбиты.
Вычислить вероятность того, что электрон в основном состоянии
атома водорода находится от ядра на расстоянии, превышающем значение .
Дано:
Решение
Квадрат модуля волновой функции определяет вероятность нахождения микрочастицы в некоторой
области пространства, то есть вероятность найти электрон в элементарном объеме , находящемся на расстоянии
от ядра, равна
.
В силу сферической симметрии функции элементарным объемом
, все точки которого удалены на одинаковое
расстояние от ядра, будет шаровой слой радиуса
и толщиной
, то есть
, тогда
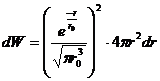
Вероятность пребывания частицы на расстоянии, превышающем значение
, находим интегрированием в пределах от
до
:
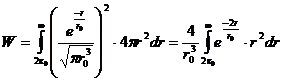
Удобнее вычислить интеграл в пределах от 0 до , найдя вероятность
пребывания электрона внутри этой области,
а искомую вероятность найти как
,
поскольку полная вероятность нахождения электрона в области от до
равна 1.
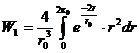
Введем переменную , тогда интеграл в иной форме будет выглядеть:
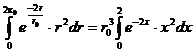
а выражение для вероятности примет вид:
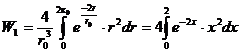
После интегрирования по частям получаем:
электрон скорость частица волна
– вероятность пребывания электрона внутри сферы радиусом
, тогда искомая вероятность того, что
электрон окажется за ее пределами
. Ответ:
ramzes
Знаток
(378),
закрыт
8 лет назад
оценить неопределенность дельта V скорости электрона, если неопределенность координаты равна дебройлевской длине волны 0.35нм
Cooler Viktor ▶
Просветленный
(28673)
8 лет назад
Элементарно.
Соотношение неопределенностей Гейзенберга пишешь:
∆V = ħ / (m·∆x) ❶
По условию неопределенность координаты
∆x = λ = 0,35·10⁻⁹ м
ħ=1,05·10⁻³⁴ Дж·с – штрихованная постоянная Планка
m=9,11·10⁻³¹ кг – масса электрона
Эти числа подставляешь в соотношение неопределенностей ❶, подсчитываешь и в ответе пишешь размерность неопределенности скорости (м/с).
Как известно, электрон в атоме не имеет какого-то определенного положения, тогда откуда взялась скорость электрона вокруг ядра атома?
Ответ точный, но устаревший. Мой вопрос относится к современному представлению об атоме. Недавно сделано фото атома водорода. Оттуда следуют следующие выводы.
1. Нету электрона в виде частицы в атоме.
2. Теория Бора окончательно опровергнута.
3. Никакого пустого пространства в атоме не существует.
Других же теорий доказывающих скорость электрона в атоме, как я понял, в науке нету.
Это фото также опровергает представление атома в виде стадиона. Которое очень популярно здесь на кью.
Clo Barrot
4 декабря 2020 · 20,7 K
Понятие скорости электрона в атоме следует из квазиклассического приближения Бора-Зоммерфельда. Здесь важны первые два принципа модели:
- Электроны могут находиться только на определенных дискретных круговых орбитах или в стационарных состояниях, имея дискретный набор возможных радиусов и энергий;
- Электроны не излучают, находясь в одном из этих стационарных состояний.
Модель хорошо описывает атом водорода и в большинстве случаев результаты согласуются или очень близки с результатами, следующими из уравнения Шредингера. Расхождения возникают только для многоэлектронных атомов. Основные недостатки предсказаний модели Бора связаны с отсутствием спина электрона в модели.
Модель Бора точно предсказывает энергетические уровни атома Водорода: E(eV) = −13.6/n², из которого, приравняв эту энергию к кинетической энергии электрона (Ek = mv²/2), следует скорость электрона на первой (n = 1) Боровской орбите : v = √(2E/m) ≈ 2.2×10⁶ м/сек. Кстати, где-то мне повстречалась более красивая формула v = αc ≈ 2.2×10⁶ м/сек, где α — постоянна тонкой структуры, а c — скорость света. Из этой формулы пахнет чем-то фундаментальным.
И ещё. Оценим скорость электрона из квантовой механики — неопределённости Гейзенберга: ΔpΔx ≥ ħ. Откуда следует неопределённость скорости Δv ≥ ħ/mΔx ≈ 2.2×10⁶ м/сек, где Δx — радиус боровский орбиты электрона.
2,5 K
Здесь показано, что квантовая физика развивалась и не нужно путать понятия одного этапа развития с другим
Комментировать ответ…Комментировать…
Физик, доктор, интересны квантовая механика и гравитация · 26 мая 2021
Когда открыли электрон в физике были только частицы и волны. Было трудно понять как живет электрон в атоме и объяснить спектр излучения атома. Первым прорывом было открытие Резерфордом положительного ядра атома, но при этом движение электронов вокруг атомов должно было приводит к непрерывному излучению и к падению электрона на ядро. Бор заметил, что из правила Ритца… Читать далее
7,1 K
По принципу неопределённости электрон в атоме имеет импульс p=h/a где a-размер атома, h- постоянная Планка… Читать дальше
Комментировать ответ…Комментировать…
Я открою вам секрет, почти никакая частица не имеет определённого положения, а скорость быть может. Более того, как верно пишут принцип неопределённости гайзенберга ниже, только у частицы с неопределённым положением и можно говорить о скорости.
Более конкретно на ваш вопрос: “скорость электрона вокруг ядора” взялась из представлений 100+ летней давности, когда думали… Читать далее
384
Комментировать ответ…Комментировать…
А что такое скорость для стоячей волны?
Вот какова скорость света в луче лазера пока он еще в резонаторе в форме стоячей волны? Там тоже ничего не движется.
Стационарные оболочки электронов в атомах это тоже стоячие волны.
И у таких волн как ни странно есть такой атрибут как импульс. Что он для них значит? Но он есть.
Фундаментальный вопрос рациональности: почему ты веришь в то, во что веришь?
Перейти на hpmor.ru
756
Стоячая волна-это результат интерференции двух бегущих.
Комментировать ответ…Комментировать…
Алкающий знания и удовольствия… · 18 мая
При скорости электрона на орбите атома в 2 млн 200 тыс метров в секунду не существует у человечества фотоаппарата с таким высокоскоростным затвором способным мгновенно сфотографировать электрон в конкретном месте орбиты. Слишком он шустрый… Чтобы скрыть эту технологическую неспособность человечества и был придуман принцип неопределённости и прочая фигня…
Читать далее
Комментировать ответ…Комментировать…
широкий круг научных интересов в основном физика · 30 июл 2022
По фотографии не следует судить о строении атома водорода . сделано много фотографий атомов и везде не видно электронов. что теория атома Бора неверна?здесь работает принцип неопределенности Гейзенберга : дельта х*дельта р порядка постоянной Планка . где х-координата электрона р-его импульс.Чем точнее определяется координата тем неопределеннее импульс и наоборот -чем… Читать далее
187
Комментировать ответ…Комментировать…
Для того, чтобы говорить о скорости материальной точки, нужно представлять себе траекторию движения этой точки. Но у квантовой частицы траектории нету. Что и описывается соотношением неопределённости Гайзенберга. В опыте интерференции электрон, будучи материальной точкой ОДНОВРЕМЕННО пролетает через две разнесённые в пространстве щели. Это противоречит всему… Читать далее
318
Ну всё же отсутствие траекторий не запрещает нам говорить о скоростях и импульсах частиц в кантовой механике, тут… Читать дальше
Комментировать ответ…Комментировать…