Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительно всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называют безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Можно выделить несколько типов математического описания: массовая концентрация, молярная концентрация, концентрация частиц и объемная концентрация[3].
Эти стаканы, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавлены, по сравнению с более концентрированными растворами справа.
Массовая доля[править | править код]
| определение | Массовая доля компонента — отношение массы данного компонента к сумме масс всех компонентов. |
|---|---|
| обозначение |  — по рекомендациям ИЮПАК[4]. — по рекомендациям ИЮПАК[4].
В технической литературе:
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |  где: где:
|
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля[править | править код]
| определение | Объёмная доля — отношение объёма компонента к сумме объёмов компонентов до смешивания. |
|---|---|
| обозначение | 
|
| единицы измерения | доли единицы,
%об (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
где:
|
При смешивании жидкостей их суммарный объём может уменьшаться, поэтому не следует заменять сумму объёмов компонентов на объём смеси.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)[править | править код]
| определение | Молярность — количество вещества (число молей) компонента в единице объёма смеси. |
|---|---|
| обозначение | По рекомендации ИЮПАК, обозначается буквой  или или ![{displaystyle [B]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6c6caf9d188e4a608dfdac98bbcd140a9ea106) , где B — вещество, концентрация которого указывается.[6] , где B — вещество, концентрация которого указывается.[6]
|
| единицы измерения | В системе СИ — моль/м³
На практике чаще — моль/л или ммоль/л. Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам. |
| формула |
где:
|
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)[править | править код]
| определение | Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. |
|---|---|
| обозначение |  , ,  , , 
|
| единицы измерения | Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. |
| формула |
где:
|
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля[править | править код]
| определение | Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. |
|---|---|
| обозначение | ИЮПАК рекомендует обозначать мольную долю буквой  (а для газов — (а для газов —  )[7], также в литературе встречаются обозначения )[7], также в литературе встречаются обозначения  , ,  . .
|
| единицы измерения | Доли единицы или %мольн (ИЮПАК не рекомендует добавлять дополнительные метки после знака %) |
| формула |
|
Мольная доля может использоваться, например, для количественного описания уровня загрязнений в воздухе, при этом её часто выражают в частях на миллион (ppm — от англ. parts per million). Однако, как и в случае с другими безразмерными величинами, во избежание путаницы, следует указывать величину, к которой относится указанное значение.
Моляльность (молярная весовая концентрация, моляльная концентрация)[править | править код]
| определение | Моляльная концентрация (моляльность,[5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. |
|---|---|
| обозначение |  Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как Примечание: чтобы не путать с массой, в тех формулах где применяется моляльность, массу обозначают как 
|
| единицы измерения | моль/кг.
Также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. |
| формула |
где:
|
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Массовая концентрация (Титр)[править | править код]
| определение | Массовая концентрация — отношение массы растворённого вещества к объёму раствора. |
|---|---|
| обозначение |  или или  — по рекомендации ИЮПАК[8]. — по рекомендации ИЮПАК[8].
|
| единицы измерения | доли,
%масс (для выражения в %масс следует умножить указанное выражение на 100 %) |
| формула |
где:
|
В аналитической химии используется понятие титр по растворённому или по определяемому веществу (обозначается буквой 
Концентрация частиц[править | править код]
| определение | Концентрация частиц — отношение числа частиц N к объёму V, в котором они находятся |
|---|---|
| обозначение |  — по рекомендации ИЮПАК[9]. — по рекомендации ИЮПАК[9].
однако также часто встречается обозначение |
| единицы измерения | м−3 — в системе СИ,
1/л |
| формула |
где:
|
Весообъёмные (массо-объёмные) проценты[править | править код]
Иногда встречается использование так называемых «весообъёмных процентов»[10], которые соответствуют массовой концентрации вещества, где единица измерения г/(100 мл) заменена на процент. Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[11] Стоит отметить, что поскольку масса и объём имеют разные размерности, использование процентов для их соотношения формально некорректно. Также международное бюро мер и весов[12] и ИЮПАК[13] не рекомендуют добавлять дополнительные метки (например «% (m/m)» для обозначения массовой доли) к единицам измерения.
Другие способы выражения концентрации[править | править код]
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, при приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства[править | править код]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим[править | править код]
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От молярности к нормальности[править | править код]
,
где:
От молярности к титру[править | править код]
,
где:
— молярная концентрация;
— молярная масса растворённого вещества.
Если молярная концентрация выражена в моль/л, а молярная масса — в г/моль, то для выражения ответа в г/мл его следует разделить на 1000 мл/л.
От массовой доли к молярности[править | править код]
,
где:
Если плотность раствора выражена в г/мл, а молярная масса в г/моль, то для выражения ответа в моль/л выражение следует домножить на 1000 мл/л. Если массовая доля выражена в процентах, то выражение следует также разделить на 100 %.
От массовой доли к титру[править | править код]
,
где:
От моляльности к молярности[править | править код]

где:
— моляльность,
— масса растворителя,
— суммарный объём раствора,
От моляльности к мольной доле[править | править код]
,
где:
— моляльность,
— молярная масса растворителя.
Если моляльность выражена в моль/кг, а молярная масса растворителя в г/моль, то единицу в формуле следует представить как 1000 г/кг, чтобы слагаемые в знаменателе имели одинаковые единицы измерения.
Сводная таблица[править | править код]
| ωB | φB | xB | cB | CB | mB | TB | |||
|---|---|---|---|---|---|---|---|---|---|
| массовая доля | г/г | ωB | 
|

|

|

|

|

|

|
| объёмная доля | л/л | φB | 
|

|
|||||
| мольная доля | моль/моль | xB | 
|

|

|

|
|||
| молярность | моль/л | cB | 
|

|

|

|
|||
| нормальность | моль-экв/л | c((1/z) B) | 
|

|
|||||
| концентрация частиц | 1/л | CB | 
|

|

|
||||
| моляльность | моль/кгр-ля | mB | 
|

|
|||||
| титр | г/мл | TB | 
|

|

|
— моляльность вещества B,
— масса вещества B,
— масса растворителя,
— масса раствора,
— титр (массовая концентрация) B,
— плотность вещества B,
— плотность раствора,
— суммарный объём раствора,
— постоянная Авогадро,
— количество частиц вещества В,
— количество вещества В,
— количество раствора,
— молярная масса,
Примечания[править | править код]
- ↑ International Union of Pure and Applied Chemistry. concentration (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.C01222. Архивировано 20 июля 2018 года.
- ↑ International Union of Pure and Applied Chemistry. fraction (англ.) // IUPAC Compendium of Chemical Terminology. — Research Triagle Park, NC: IUPAC. — ISBN 0967855098. — doi:10.1351/goldbook.F02494. Архивировано 20 августа 2018 года.
- ↑ IUPAC Gold Book internet edition: «concentration».
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass fraction, w (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 13 декабря 2018 года.
- ↑ 1 2 3 Z. Sobecka, W. Choiński, P. Majorek. Dictionary of Chemistry and Chemical Technology: In Six Languages: English / German / Spanish / French / Polish / Russian. — Elsevier, 2013-09-24. — С. 641. — 1334 с. — ISBN 9781483284439.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount concentration, c (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 21 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – amount fraction, x ( y for gaseous mixtures) (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – mass concentration, γ, ρ (англ.). goldbook.iupac.org. Дата обращения: 16 декабря 2018. Архивировано 7 декабря 2018 года.
- ↑ International Union of Pure and Applied Chemistry. IUPAC Gold Book – number concentration, C,n (англ.). goldbook.iupac.org. Дата обращения: 11 декабря 2018. Архивировано 22 декабря 2018 года.
- ↑ Способы приготовления растворов на МедКурс. Ru. Дата обращения: 24 апреля 2012. Архивировано 29 октября 2012 года.
- ↑ Бернштейн И. Я., Каминский Ю. Л. Спектрофотометрический анализ в органической химии. — 2-е изд. — Ленинград: Химия, 1986. — с. 5
- ↑ The International System of Units (SI). www.bipm.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 14 августа 2017 года.
- ↑ Quantities, Units and Symbols in Physical Chemistry. www.iupac.org. Дата обращения: 23 декабря 2018. Архивировано из оригинала 20 декабря 2016 года.
Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.

Авогадро (1776—1856)
Интересно знать
Из курса химии 8-го класса вы уже знакомы с постоянной Авогадро, равной 6,02 ∙ 1023 моль–1, которая показывает, сколько частиц содержится в одном моле вещества. Эта величина названа в честь выдающегося итальянского учёного Амедео Авогадро, внёсшего значительный вклад в развитие молекулярной физики, электрохимии и других областей естествознания. На основании исследования соотношения объёмов реагирующих и образующихся газов, таких как водород и хлор, кислород и азот, Авогадро впервые предположил, что молекулы азота, кислорода, водорода и хлора состоят из двух атомов. Это предположение, сначала долго не находившее понимания у учёных того времени, впоследствии блестяще подтвердилось.
Из закона Авогадро вытекают два основных следствия.
Первое следствие. Один моль любого газа при одинаковых условиях занимает одинаковый объём. Этот объём называется молярным объёмом газа (Vm), и измеряется в дм3/моль. Молярный объём газа равен отношению объёма газа к его количеству:
.
Величина Vm зависит от температуры и давления. Например, при нагревании газы расширяются. Значит, при нагревании увеличивается молярный объём газа. В связи с этим сравнение характеристик различных газовых смесей необходимо осуществлять при одинаковых условиях — температуре и давлении. В качестве эталона таких условий приняты нормальные условия (н. у.): температура таяния льда (0 °С или 273,15 K) и атмосферное давление (101,3 кПа). При нормальных условиях Vm = 22,4 дм3/моль.
Таким образом, из закона Авогадро следует, что 22,4 дм3 любого газа при нормальных условиях содержат 6,02 ∙ 1023 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 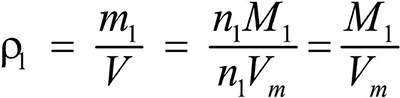
газ 2: 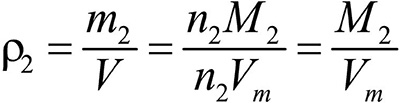
Разделив плотность первого газа на плотность второго, получим: 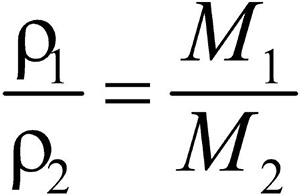
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
М(Х) = М(Н2) ∙ D = 2 ∙ 8 = 16 г/моль.
Газ с такой молярной массой — метан СH4.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль;
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль.
Углеводород с такой молярной массой — бутан С4Н10.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 3СО2 + 4Н2О
Из закона Авогадро следует, что равные объёмы различных газов содержат одинаковое количество (моль) веществ. Пусть объём пропана равен 1 дм3. Тогда, согласно приведённому уравнению, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода. Следовательно, для сжигания 2 дм3 пропана потребуется:
1 дм3 С3Н8 — 5 дм3 O2,
2 дм3 С3Н8 — 10 дм3 О2
Ответ: V(О2) = 10 дм3.
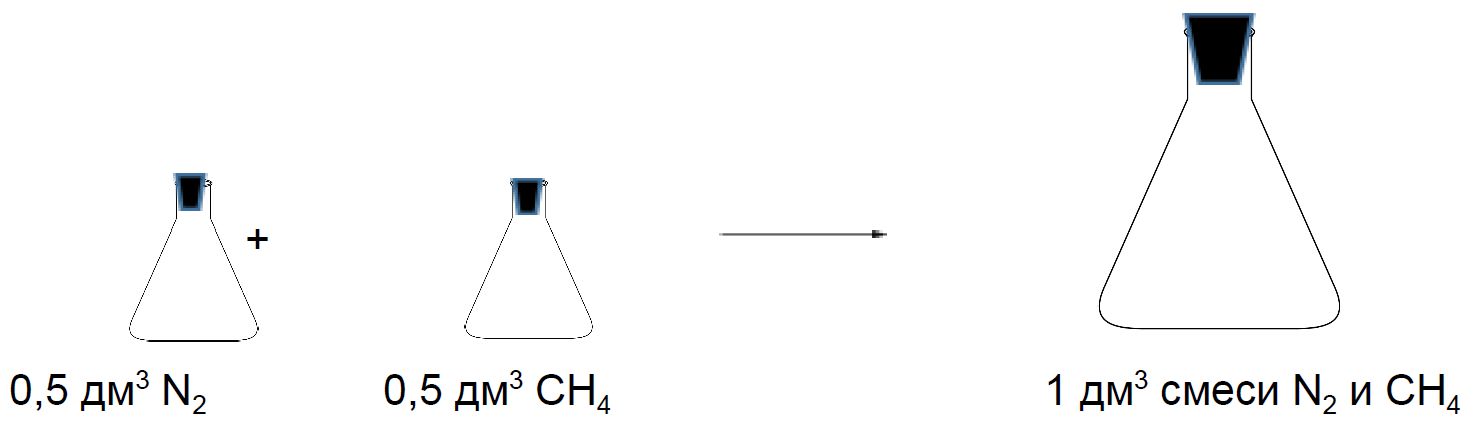
Смеси газов
Рассмотрим две колбы объёмом 0,5 дм3. Одна колба заполнена азотом, а другая метаном. Давление и температура в колбах одинаковые. Если смешать содержимое этих колб, то полученная смесь займёт при таких же условиях объём 1 дм3.
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = = 0,5, или 50 %.
Пример 4. В результате пропускания 150 дм3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль):
n(СаСО3) = 0,201/100 = 0,00201 моль.
По уравнению реакции:
n(СаСО3) = n(СО2).
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм3;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Ответ: φ(СО2) = 0,03 %.
Пример 5. Объём смеси водорода с хлором составляет 50 см3. После взаимодействия газов осталось 10 см3 хлора. Найдите состав исходной смеси в объёмных долях. Все объёмы измерены при н. у.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 2HCl
Поскольку после взаимодействия осталось 10 см3 хлора, то 40 см3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см3 хлора и водорода. Поскольку осталось 10 см3 хлора, то в первоначальной смеси было 20 см3 водорода и 30 см3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(H2) = 20/50 = 0,4, или 40 %;
φ(Cl2) = 30/50 = 0,6, или 60 %.
Ответ: φ(H2) = 40 %; φ(Cl2) = 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
22,4 дм3. Эта величина называется молярным объёмом газа (Vm).
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Газы, имеющие молярную массу более 29 г/моль, тяжелее воздуха, а менее 29 г/моль — легче воздуха.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
Масса и количество вещества. Массу вещества (m) измеряют в граммах, а количество вещества (n) в молях. Если обозначить вещество буквой Х, то тогда его масса может быть обозначена как m (X), а количество – n (X).
- Моль–количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода-12.
- При использовании термина моль следует указывать частицы, к которым относится этот термин. Соответственно, можно говорить «моль молекул», «моль атомов», «моль ионов» и т.д. (например, моль молекул водорода, моль атомов водорода, моль ионов водорода). Так как 0,012 кг углерода-12 содержит ~ 6,022х1023атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х1023структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса (М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Любое соединение (вещество), кроме молярной массы, характеризуется относительной молекулярной или атомной массой. Существует и эквивалентная масса Е, равная молекулярной, умноженной на фактор эквивалентности (см. далее).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м3 или г/м3, кг/дм3или г/дм3(г/л), кг/см3, или г/см3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10–5мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация – это отношение массы к объему системы !!!! а отношение массы к массе это – массовая доля 🙂
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр. Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см3, г/см3, г/мл и др.
Моляльность (b) –отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная (! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн–1,ppm), миллиардных (млрд–1,ppb), триллионных (трлн–1,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω) –отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м3(дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв (Х) = n (1/Z X) / V (смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ (1/Z X) = nэ (Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 АlCl3) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв (Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв (H2SО4) = 1/2,fэкв (NaOH) = 1
- fэкв (H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н+), а соответственноfэкв (NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4– + 8Н++5е–→ Мп2+– 2e–+ 4 Н2О
- 5 Fe2+ – 2e– → Fe3+
- fэкв (KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этом fэкв (Fe2+) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв (H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моля позволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента вещества X. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода12 С (6,02 1023). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности fэкв (Х) на молярную массу вещества М (Х)1.
- Молярную массу эквивалента обозначают как М [fэкв (Х) Х] или с учетом равенства Эх = fэкв (Х) Х ее обозначают М [Эх]:
- М (Эх)= fэкв (Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м3 | Производная (СИ) |
|
| кг/дм3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация, молярность(с) | моль/м3 | Производная (СИ) |
|
| моль/дм3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация, моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная = моль/моль. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 8. Массовая доля (ω) | Относительная = кг / кг. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,ppt или в др. ед. |
Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 9. Объемная доля (φ) | Относительная = м3/м3(илил/л, илимл/мл, или в %, или в млн–1,ppm, в млрд–1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др.. Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.