Как рассчитать плотность аммиака по воздуху?
Андрей григогрьев
Профи
(753),
закрыт
11 лет назад
Лучший ответ
Незнакомка
Мудрец
(18920)
11 лет назад
Плотность одного газа по другому рассчитывается как отношение относительных молекулярных масс (Мr) . В данном случае Мr(NH3) =14+3=17 Мr(воздуха) =29 17:29=0,586
Остальные ответы
Вячек
Высший разум
(391245)
11 лет назад
Плотность одного газа по другому рассчитывается как отношение их молярных масс:
D(возд.) =М (NH3)/M(возд.) = 17 г/моль/ 29 г/моль = 0,586
Похожие вопросы
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа) / Mr (воздуха) , где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) – относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная) , следовательно формула будет иметь вид:
D (воздух) = Mr (газа) / 29.
2
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа) / Mr (водорода) ;
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) – относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа) / 2.
Относительная плотность аммиака по воздуху.
Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д. И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака) / Mr (воздуха) ;
D (воздух) = Mr (аммиака) / 29;
D (воздух) = 17/ 29 = 0, 59.
Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- – периодическая система химических элементов Д.И. Менделеева;
- – калькулятор.
Инструкция
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) – относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) – относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.

Таблицы DPVA.ru – Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
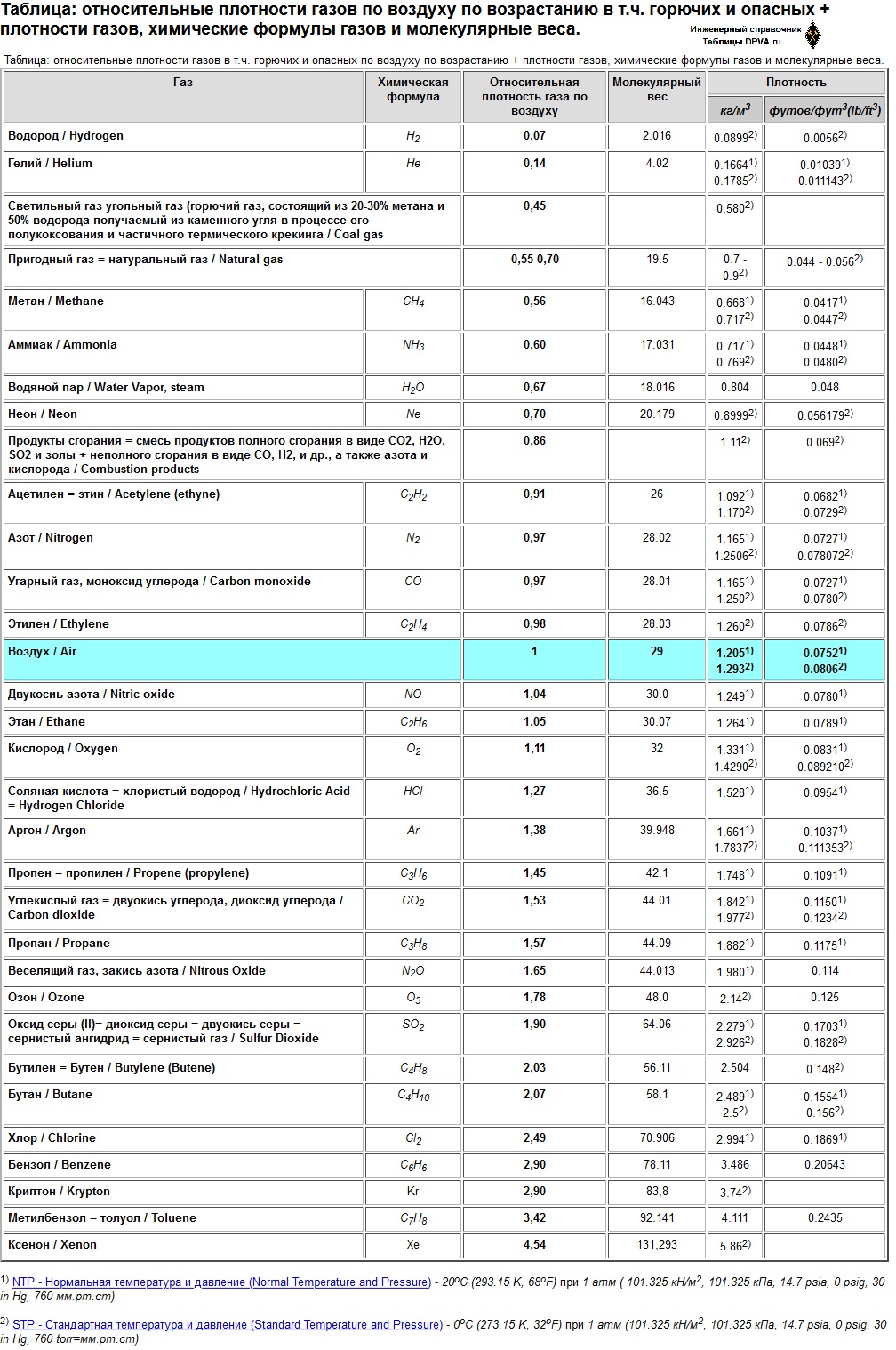
Таблица. Относительные плотности газов по воздуху по возрастанию в т.ч. горючих и опасных + плотности газов, химические формулы газов и молекулярные веса.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
wherdelmef
Вопрос по химии:
Расчитайте относительную плотность аммиака NH3 по воздуху
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
juntenghevre
Молярную массу воздуха принимают равной 29 гр/моль.
M(NH₃) = 14 + 1·3 = 17 гр/моль.
D = 17/29 ≈ 0.586
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.