Лучший ответ
Татьяна Иванова
Гений
(56765)
14 лет назад
Относительная плотность одного газа по другому (D) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
Так, чтобы найти относительную плотность газа по воздуху, нужно молярную массу газа разделить на 2 (молярную массу молекулярного водорода) : D(Н2) = М/2
Относительная плотность газа по воздуху равна молярной массе газа, деленной на 29 (молярную массу воздуха) : D(возд) = М/29
Остальные ответы
вероника
Знаток
(312)
14 лет назад
О тношение относительной молекулярной массы газа к относительной молекулярной массе водорода-2 или воздуха-29
Джема
Ученик
(159)
14 лет назад
Могу проще, Плотность это растояние между молекулами какого-то вещества. могу и ошибаться, школу закончила давно!
Адиль Каирбеков
Профи
(519)
6 лет назад
ф
Радион Харазия
Ученик
(163)
6 лет назад
спасиба
Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- – периодическая система химических элементов Д.И. Менделеева;
- – калькулятор.
Инструкция
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) – относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) – относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Объёмные отношения газов при химических реакциях. Относительная плотность газов
I. Закон объемных отношений
“Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа”.
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1:V2:V3 = ν1:ν2:ν3.
Примеры:
2CO + O2 → 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
V(CO):V(О2):V(CO2) = ν(CO):ν(О2):ν(CO2) = 2 : 1 : 2
При синтезе аммиака из элементов:
N2 + 3H2 → 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака – объем исходной газообразной реакционной массы уменьшится в 2 раза.
V(N2):V(H2):V(NH3) = ν(N2):ν(H2):ν(NH3) = 1 : 3 : 2
II. Решите задачу по образцу
Вычислите объём кислорода, который потребуется для сжигания 5 м3 метана СН4н.у.?
Образец:
Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана С3Н8 (н.у.)?
|
Дано: V(С3Н8) = 10 м3 |
Решение: 1. Запишем УХР С3Н8 +5О2 → 3СО2+ 4Н2О 1моль 5моль 2. Согласно закону объёмных отношений для газов: V(С3Н8):V(О2) = ν(С3Н8):ν(О2) = 1 : 5 10 м3 :V(О2) = 1 : 5 V(О2) = (10 · 5) /1= 50 м3 Ответ: для сжигания 10 м3 пропана потребуется 50 м3 кислорода. |
|
Найти: V(О2) = ? |
III. Относительная плотность газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N2 по воздуху?
|
Дано: N2 М(воздуха) = 29 |
Решение: Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29. Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97 |
|
Найти: Dвоздух – ? |
Ответ: газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97 |
Задачи для самостоятельного решения
- Найдите относительную плотность газа О2 по водороду?
- Найдите относительную плотность газа СО2 по воздуху?
Решите задачуи для закрепления:
- Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
- Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
- Параграф 39
- Стр. 130 упр. 2,3 (письменно); тест
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.

Авогадро (1776—1856)
Интересно знать
Из курса химии 8-го класса вы уже знакомы с постоянной Авогадро, равной 6,02 ∙ 1023 моль–1, которая показывает, сколько частиц содержится в одном моле вещества. Эта величина названа в честь выдающегося итальянского учёного Амедео Авогадро, внёсшего значительный вклад в развитие молекулярной физики, электрохимии и других областей естествознания. На основании исследования соотношения объёмов реагирующих и образующихся газов, таких как водород и хлор, кислород и азот, Авогадро впервые предположил, что молекулы азота, кислорода, водорода и хлора состоят из двух атомов. Это предположение, сначала долго не находившее понимания у учёных того времени, впоследствии блестяще подтвердилось.
Из закона Авогадро вытекают два основных следствия.
Первое следствие. Один моль любого газа при одинаковых условиях занимает одинаковый объём. Этот объём называется молярным объёмом газа (Vm), и измеряется в дм3/моль. Молярный объём газа равен отношению объёма газа к его количеству:
![]() .
.
Величина Vm зависит от температуры и давления. Например, при нагревании газы расширяются. Значит, при нагревании увеличивается молярный объём газа. В связи с этим сравнение характеристик различных газовых смесей необходимо осуществлять при одинаковых условиях — температуре и давлении. В качестве эталона таких условий приняты нормальные условия (н. у.): температура таяния льда (0 °С или 273,15 K) и атмосферное давление (101,3 кПа). При нормальных условиях Vm = 22,4 дм3/моль.
Таким образом, из закона Авогадро следует, что 22,4 дм3 любого газа при нормальных условиях содержат 6,02 ∙ 1023 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 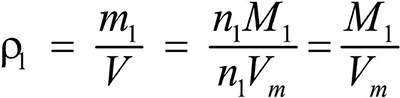 ;
;
газ 2: 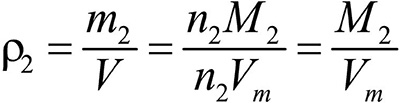 .
.
Разделив плотность первого газа на плотность второго, получим: 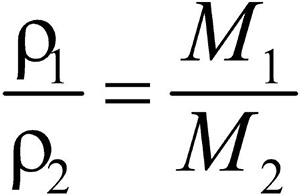 .
.
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:

Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
М(Х) = М(Н2) ∙ D = 2 ∙ 8 = 16 г/моль.
Газ с такой молярной массой — метан СH4.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль;
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль.
Углеводород с такой молярной массой — бутан С4Н10.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 ![]() 3СО2 + 4Н2О
3СО2 + 4Н2О
Из закона Авогадро следует, что равные объёмы различных газов содержат одинаковое количество (моль) веществ. Пусть объём пропана равен 1 дм3. Тогда, согласно приведённому уравнению, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода. Следовательно, для сжигания 2 дм3 пропана потребуется:
1 дм3 С3Н8 — 5 дм3 O2,
2 дм3 С3Н8 — 10 дм3 О2
Ответ: V(О2) = 10 дм3.
Смеси газов
Рассмотрим две колбы объёмом 0,5 дм3. Одна колба заполнена азотом, а другая метаном. Давление и температура в колбах одинаковые. Если смешать содержимое этих колб, то полученная смесь займёт при таких же условиях объём 1 дм3.
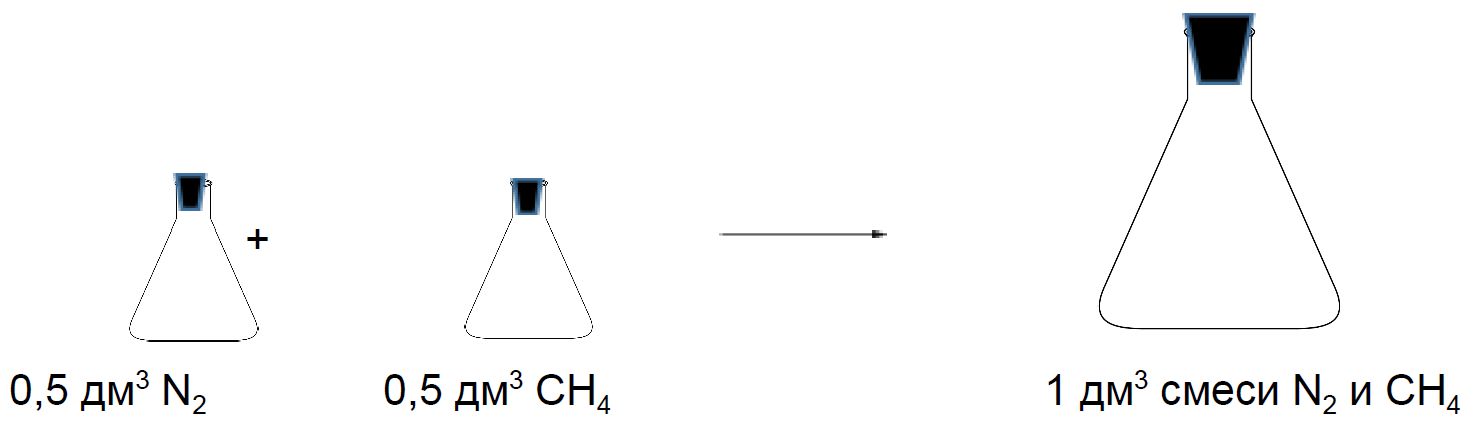
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = ![]() = 0,5, или 50 %.
= 0,5, или 50 %.
Пример 4. В результате пропускания 150 дм3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3![]() + Н2О
+ Н2О
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль):
n(СаСО3) = 0,201/100 = 0,00201 моль.
По уравнению реакции:
n(СаСО3) = n(СО2).
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм3;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Ответ: φ(СО2) = 0,03 %.
Пример 5. Объём смеси водорода с хлором составляет 50 см3. После взаимодействия газов осталось 10 см3 хлора. Найдите состав исходной смеси в объёмных долях. Все объёмы измерены при н. у.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 ![]() 2HCl
2HCl
Поскольку после взаимодействия осталось 10 см3 хлора, то 40 см3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см3 хлора и водорода. Поскольку осталось 10 см3 хлора, то в первоначальной смеси было 20 см3 водорода и 30 см3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(H2) = 20/50 = 0,4, или 40 %;
φ(Cl2) = 30/50 = 0,6, или 60 %.
Ответ: φ(H2) = 40 %; φ(Cl2) = 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
22,4 дм3. Эта величина называется молярным объёмом газа (Vm).
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Газы, имеющие молярную массу более 29 г/моль, тяжелее воздуха, а менее 29 г/моль — легче воздуха.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Относительная плотность газа – сравнение относительной молекулярной или молярной массы одного газа с таким же показателем другого газа. Как правило, он определяется по отношению к самому легкому газу – водороду. Также часто газы сравнивают с воздухом.
Для того чтобы показать, какой газ выбирается для сравнения, перед символом относительной плотности исследуемого добавляют индекс, а само название записывают в скобках. Например, DH2(SO2). Это означает, что плотность оксида серы была рассчитана по водороду. Читается это как «плотность оксида серы по водороду».
Чтобы рассчитать плотность газа по водороду, необходимо с помощью периодической таблицы определить молярные массы исследуемого газа и водорода. Если это хлор и водород, то показатели будут выглядеть так: M(Cl2) = 71 г/моль и M(H2) = 2 г/моль. Если плотность водорода разделить на плотность хлора (71:2), в результате получится 35,5. То есть хлор в 35,5 раз тяжелее, чем водород.
Относительная плотность газа от внешних условий никак не зависит. Это объясняется всеобщими законами состояния газов, которые сводятся к тому, что изменение температуры и давления не приводит к изменению их объема. При любых изменениях этих показателей измерения производятся совершенно одинаково.
Для определения плотности газа опытным путем понадобится колба, куда его можно будет поместить. Колбу с газом необходимо взвесить дважды: первый раз – откачав из нее весь воздух; второй – наполнив ее исследуемым газом. Также заранее необходимо измерить объем колбы.
Сначала нужно рассчитать разность масс и разделить ее на значение объема колбы. В результате получится плотность газа по заданным условиям. С помощью уравнения состояния можно высчитать нужный показатель при нормальных либо идеальных условиях.
Узнать плотность некоторых газов можно по сводной таблице, в которой есть готовые сведения. Если газ занесен в таблицу, то брать эту информацию можно без каких-либо дополнительных расчетов и использования формул. К примеру, плотность пара воды можно узнать по таблице свойств воды (Справочник Ривкина С.Л. и др.), ее электронному аналогу или с помощью программ типа WaterSteamPro и других.
Однако у разных жидкостей равновесие с паром наступает при различной плотности последнего. Это объясняется различием сил межмолекулярного взаимодействия. Чем выше оно, тем быстрее наступит равновесие (к примеру, ртуть). У летучих жидкостей (например, эфир) равновесие может наступить лишь при значительной плотности пара.
Плотность различных природных газов варьируется от 0,72 до 2,00 кг/м3 и выше, относительная – от 0,6 до 1,5 и выше. Самая высокая плотность у газов с наибольшим содержанием тяжелых углеводородов H2S, СО2 и N2, самая низкая – у сухих метановых.
Свойства природного газа определяются его составом, температурой, давлением и плотностью. Последний показатель определяется лабораторным путем. Он зависит от всех вышеназванных. Определить его плотность можно разными методами. Самый точный – взвешивание на точных весах в тонкостенном стеклянном баллоне.
Плотность воздуха больше этого же показателя природных газов. В практике принимают это соотношение как 0,6:1. Статическое давление воздуха уменьшается быстрее по сравнению с газом. При давлении до 100 МПа плотность природного газа способна превышать 0,35 г/см3.
Установлено, что увеличение плотности природного газа может сопровождаться увеличением температуры гидратообразования. Природный газ низкой плотности образовывает гидраты при более высокой температуре по сравнению с газами с повышенной плотностью.
В газовой промышленности измерители плотности только начинают использоваться и остается еще много вопросов, которые связаны с особенностями их эксплуатации и проверки.
