Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.

Авогадро (1776—1856)
Интересно знать
Из курса химии 8-го класса вы уже знакомы с постоянной Авогадро, равной 6,02 ∙ 1023 моль–1, которая показывает, сколько частиц содержится в одном моле вещества. Эта величина названа в честь выдающегося итальянского учёного Амедео Авогадро, внёсшего значительный вклад в развитие молекулярной физики, электрохимии и других областей естествознания. На основании исследования соотношения объёмов реагирующих и образующихся газов, таких как водород и хлор, кислород и азот, Авогадро впервые предположил, что молекулы азота, кислорода, водорода и хлора состоят из двух атомов. Это предположение, сначала долго не находившее понимания у учёных того времени, впоследствии блестяще подтвердилось.
Из закона Авогадро вытекают два основных следствия.
Первое следствие. Один моль любого газа при одинаковых условиях занимает одинаковый объём. Этот объём называется молярным объёмом газа (Vm), и измеряется в дм3/моль. Молярный объём газа равен отношению объёма газа к его количеству:
![]() .
.
Величина Vm зависит от температуры и давления. Например, при нагревании газы расширяются. Значит, при нагревании увеличивается молярный объём газа. В связи с этим сравнение характеристик различных газовых смесей необходимо осуществлять при одинаковых условиях — температуре и давлении. В качестве эталона таких условий приняты нормальные условия (н. у.): температура таяния льда (0 °С или 273,15 K) и атмосферное давление (101,3 кПа). При нормальных условиях Vm = 22,4 дм3/моль.
Таким образом, из закона Авогадро следует, что 22,4 дм3 любого газа при нормальных условиях содержат 6,02 ∙ 1023 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 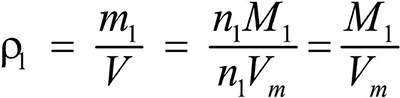 ;
;
газ 2: 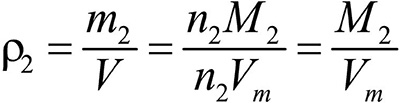 .
.
Разделив плотность первого газа на плотность второго, получим: 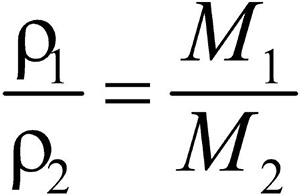 .
.
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:

Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
М(Х) = М(Н2) ∙ D = 2 ∙ 8 = 16 г/моль.
Газ с такой молярной массой — метан СH4.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль;
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль.
Углеводород с такой молярной массой — бутан С4Н10.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 ![]() 3СО2 + 4Н2О
3СО2 + 4Н2О
Из закона Авогадро следует, что равные объёмы различных газов содержат одинаковое количество (моль) веществ. Пусть объём пропана равен 1 дм3. Тогда, согласно приведённому уравнению, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода. Следовательно, для сжигания 2 дм3 пропана потребуется:
1 дм3 С3Н8 — 5 дм3 O2,
2 дм3 С3Н8 — 10 дм3 О2
Ответ: V(О2) = 10 дм3.
Смеси газов
Рассмотрим две колбы объёмом 0,5 дм3. Одна колба заполнена азотом, а другая метаном. Давление и температура в колбах одинаковые. Если смешать содержимое этих колб, то полученная смесь займёт при таких же условиях объём 1 дм3.
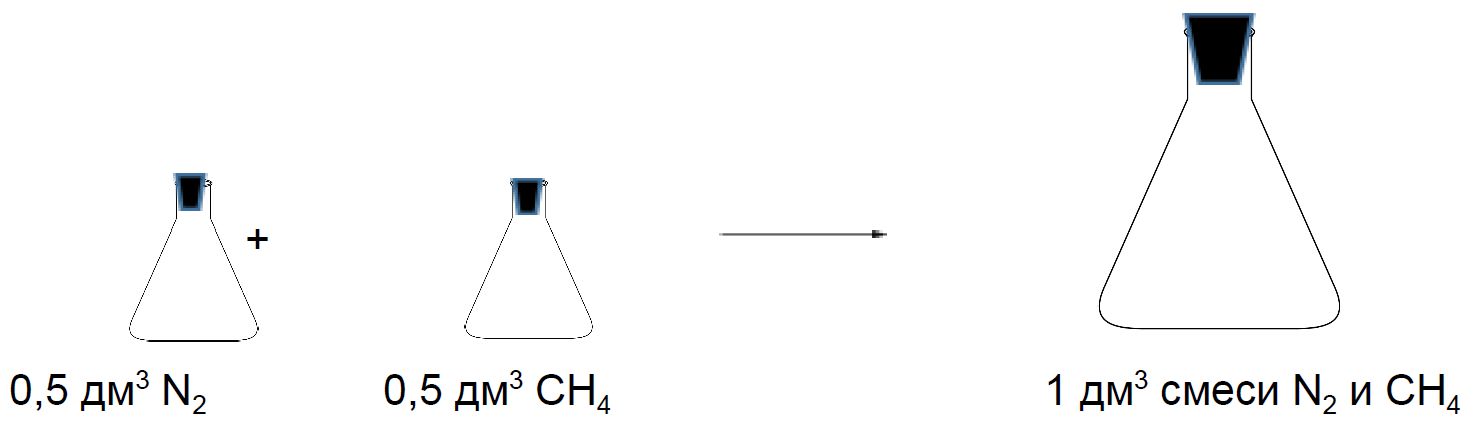
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = ![]() = 0,5, или 50 %.
= 0,5, или 50 %.
Пример 4. В результате пропускания 150 дм3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3![]() + Н2О
+ Н2О
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль):
n(СаСО3) = 0,201/100 = 0,00201 моль.
По уравнению реакции:
n(СаСО3) = n(СО2).
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм3;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Ответ: φ(СО2) = 0,03 %.
Пример 5. Объём смеси водорода с хлором составляет 50 см3. После взаимодействия газов осталось 10 см3 хлора. Найдите состав исходной смеси в объёмных долях. Все объёмы измерены при н. у.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 ![]() 2HCl
2HCl
Поскольку после взаимодействия осталось 10 см3 хлора, то 40 см3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см3 хлора и водорода. Поскольку осталось 10 см3 хлора, то в первоначальной смеси было 20 см3 водорода и 30 см3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(H2) = 20/50 = 0,4, или 40 %;
φ(Cl2) = 30/50 = 0,6, или 60 %.
Ответ: φ(H2) = 40 %; φ(Cl2) = 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
22,4 дм3. Эта величина называется молярным объёмом газа (Vm).
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Газы, имеющие молярную массу более 29 г/моль, тяжелее воздуха, а менее 29 г/моль — легче воздуха.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Объёмные отношения газов при химических реакциях. Относительная плотность газов
I. Закон объемных отношений
“Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа”.
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1:V2:V3 = ν1:ν2:ν3.
Примеры:
2CO + O2 → 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
V(CO):V(О2):V(CO2) = ν(CO):ν(О2):ν(CO2) = 2 : 1 : 2
При синтезе аммиака из элементов:
N2 + 3H2 → 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака – объем исходной газообразной реакционной массы уменьшится в 2 раза.
V(N2):V(H2):V(NH3) = ν(N2):ν(H2):ν(NH3) = 1 : 3 : 2
II. Решите задачу по образцу
Вычислите объём кислорода, который потребуется для сжигания 5 м3 метана СН4н.у.?
Образец:
Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана С3Н8 (н.у.)?
|
Дано: V(С3Н8) = 10 м3 |
Решение: 1. Запишем УХР С3Н8 +5О2 → 3СО2+ 4Н2О 1моль 5моль 2. Согласно закону объёмных отношений для газов: V(С3Н8):V(О2) = ν(С3Н8):ν(О2) = 1 : 5 10 м3 :V(О2) = 1 : 5 V(О2) = (10 · 5) /1= 50 м3 Ответ: для сжигания 10 м3 пропана потребуется 50 м3 кислорода. |
|
Найти: V(О2) = ? |
III. Относительная плотность газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N2 по воздуху?
|
Дано: N2 М(воздуха) = 29 |
Решение: Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29. Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97 |
|
Найти: Dвоздух – ? |
Ответ: газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97 |
Задачи для самостоятельного решения
- Найдите относительную плотность газа О2 по водороду?
- Найдите относительную плотность газа СО2 по воздуху?
Решите задачуи для закрепления:
- Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
- Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
- Параграф 39
- Стр. 130 упр. 2,3 (письменно); тест
МБОУ «Новофедоровская школа-лицей
имени Героя Российской Федерации Т.А.Апакидзе»
Конспект урока химии
«Относительная плотность
газов.»
для 8 класса
Подготовила:
Гончарук Ирина Александровна
учитель биологии и химии
Тема урока: Относительная плотность газов
Цель урока: Научить
вычислять по химическим уравнениям объём газа (по известной массе или
количеству вещества),
массу или количество вещества (по известному
объёму газа)
одного из вступивших в реакцию или
получившихся в результате реакции веществ. Сформировать представления об
относительной плотности газов. Научить производить расчёты, используя понятие
«относительная плотность газов».
|
Тип урока |
урок «открытия» нового знания |
|
Предметные результаты |
познакомиться научиться рассчитывать по химическому уравнению массу, |
|
Личностные результаты |
Формировать ответственное отношение к учению. |
|
Развивать умения ставить и формулировать для себя новые задачи в |
Основные понятия:
Относительная плотность газов, плотность вещества, количество вещества, молярный
объём газов.
Ресурсы:
Учебник, раздаточный материал.
Содержание и технология урока
1.Организационный момент -1 минута.
Приветствие.
Проверка
готовности
учащихся
к
уроку.
2.Актуализация
опорных знаний – 12 минут
Проверка домашнего задания. К
доске
вызывается
два ученика
для
выполнения
индивидуального
задания,
остальные
учащиеся
отвечают на вопросы
учителя по принципу поднятой руки или побуждение к ответу по выбору учителя. По
готовности, ученик у доски объясняет решение выполненной задачи из домашнего
задания с предыдущего урока.
Вопросы
для фронтального опроса:
–
Какими свойствами обладают газы по сравнению с твердыми веществами?
– Какие
предположения и доказательства выдвинул А. Авогадро когда формулировал свой
закон? Сформулируйте закон Авогадро для газов.
– Что
означает величина молярный объём газа?
– Какой
объём занимает 1 моль любого газа при нормальных условиях.
–
Как доказать, что 1 моль любого газа занимает объём равный 22,4литра.
Задания
для учащихся у доски:
1.
Вычислите массу кислорода, взятого объемом 400 л. (571,4 г)
2.
Масса газа объемом 448 л составляет 88 г. Определите молярную массу этого газа.
(44г/моль)
3.Мотивация учебной деятельности.
– 3 минуты
Есть математическое обоснование понятия «относительная плотность
газов».
-Существуют
понятия масса и относительная атомная масса, чем они отличаются?
Ar и mатома ; Mr и mмолекулы ?
Относительные
массы равны отношению фактической массы к 1/12 массы атома естественного
изотопа углерода С-12
– Вспомните из курса физики, что такое
плотность вещества?
Физическая величина равная отношению массы
тела к его объёму.
![]()
-Как можно определить плотность газа при
нормальных условиях?
![]()
В ходе урока мы «избавимся» от физической
величины – плотность и научимся использовать – относительную плотность газов
для количественных расчетов в химии.
4.Изучение нового
материала -10 минут.
Любые параметры предметов окружающего мира
можно сравнить относительно друг друга, если речь идет об одних и тех же
величинах: длину, ширину, объём, вес и Т.Д., используя выражение, «больше –
меньше»
Давайте представим, что у нас есть два
различных газа.
Согласно основной формуле
для газообразного вещества 1 справедливо ρ1
= М1 /
Vm
для газообразного вещества 2 справедливо ρ2
= М2 /
Vm .
Значит, если газы будут «выяснять
отношения», то ρ1 / ρ2 = М1 / Vm : М2
/ Vm
Молярный объём как величина одинаковая при равных условиях,
сократится, и мы получим ρ1 / ρ2 = М1 / М2
Для
того чтобы «избавиться» от отношения плотностей, ввели понятие «относительная
плотность газов», которое показывает во сколько раз один газ тяжелее или легче
другого.
M1 m1
D = —— = ——-
M2 m2
Отношение масс одинаковых объёмов различных газов при одинаковых
условиях равно отношению их молярных масс.
D – как все
относительные величины не имеет единицы измерения.
Например:
DНе (О2) = М(О2) / М(Не) = 32г/моль / 4г/моль = 8 > 1 ,
значит азот тяжелее гелия
D О2 (N2) =
М(N2) / М(О2) = 28г/моль / 32г/моль = 0,875 < 1, значит азот легче кислорода
Есть стандартный, наиболее используемый
«набор» относительных плотностей – относительная плотность газа по кислороду, водороду
и воздуху.
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29
5.
Первичное закрепление знаний -5 минут.
Расчеты с
использованием относительной плотности газов
Задача 1. Определите относительную плотность кислорода по
гелию.
DНе (О2) = М(О2) / М(Не) = 32 / 4
= 8 > 1, значит азот тяжелее гелия в 8 раз
Задача
2.
Относительная
плотность газа по воздуху равна 2. Чему равна молярная масса этого газа?
Dвоздуха (Х)
= М(Х) / М(воздуха) = М(Х) / 29; значит
М(Х) = Dвоздуха (Х)
* 29 = 2 * 29 = 58 г/моль
6.Формирование
умений и навыков – 10 минут
Существуют
ситуации, когда ядовитые газообразные вещества образуются в бытовых ситуациях
или происходит их утечка из резервуаров хранилища при техногенных катастрофах. Например, хлор(Cl2), аммиак (NH3),
угарный газ (СО). Используя знания, полученные на этом уроке, определите
относительную плотность этих газов по воздуху и дайте обоснованные рекомендации
по поиску укрытия с целью предотвращения отравления ими населения.
Класс
делится на 3 группы по вариантам. Дети делают расчёты и выборочно по принципу
поднятой руки озвучивают результаты.
1
вариант
Хлор при обычных условиях — ядовитый газ желтовато-зелёного цвета, с
резким запахом и
сладковатым, «металлическим» вкусом.
Dвоздуха (Cl2) = М(Cl2) / М(воздуха) = 71 / 29 = 2,45 > 1, значит хлор
тяжелее воздуха и он будет распространяться по низу, заполняя все пустоты
(впадины , подвалы и т.д.). Поэтому искать убежище необходимо, наверху здания,
например на чердаке.
2
Вариант
Аммиак (NH3), при обычных условиях — бесцветный газ с резким
характерным запахом.
Dвоздуха (NH3) = М(NH3) / М(воздуха) = 17 / 29 = 0,6 < 1, значит
аммиак легче воздуха и он будет распространяться по верху. Поэтому искать
убежище необходимо, в нижней части здания, например в подвале.
3
Вариант
Угарный газ(CO)
— бесцветный чрезвычайно токсичный газ без вкуса и запаха.
Dвоздуха (СО) = М(СО)
/ М(воздуха) = 28 / 29 = 0,97 < 1, значит угарный газ немного легче воздуха,
а с учётом повышенной температуры (пожар), будет собираться в верхней части
помещения.
Вывод:
1) При оповещении об утечке хлора прячемся …
(на чердаке).
2) При оповещении об утечке аммиака прячемся …
(в подвале).
Дополнительные
задания (на каждой парте распечатка) для тех кто справился раньше.
1)
Определить относительную плотность неона по воздуху. Он легче или тяжелее
воздуха?( на 3)
2)
Определите относительную молекулярную массу газа, который в 32 раз тяжелее
водорода. (на 4)
3)
Относительная плотность паров белого фосфора по водороду равна 62. Найдите
формулу белого фосфора.(на 5)
6.Итоги урока. Рефлексия – 3 минуты.
1.
Чему мы сегодня научились? Понравился ли вам урок?
2.
Возникли ли у вас трудности при выполнении самостоятельной работы?
3.
Как вы считаете, можно ли использовать знания, полученные на уроке, в
повседневной жизни?
7. Домашнее задание – 1 минута.
Выучить параграф 38, задания 2, 3 стр 128.
Дополнительные задания размещаю на странице класса на Дневник.ру
1)
Определить относительную плотность углекислого газа (СО2) по
воздуху. Он легче или тяжелее воздуха? (3)
2)
Определите относительную молекулярную массу газа, который в 16 раз тяжелее
гелия.
(4
)
3)
Относительная плотность паров серы по неону равна 12,8. Найдите формулу
простого вещества серы. (5)
Плотность и относительная плотность газов.
Цели:
раскрыть суть понятия «относительная плотность газов», научить производить расчёты относительной плотности газов, показать практическое значение этих расчётов;
развивать умения выполнять познавательные и практические задания, готовность к решению задач, в том числе и творческих;
воспитывать отношение к химии как к одному из фундаментальных компонентов естествознания.
Ход урока.
На предыдущем уроке мы познакомились с законом Авогадро и молярным объёмом газов, научились решать задачи по этой теме.
Закон Авогадро? ( в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул ; 1811г, итальянский учёный Амедео Авогадро).
1 следствие из закона Авогадро?
1 следствие:
(Один моль любого газа при нормальных условиях занимает объём 22,4 л)
(Vm = 22,4 л/моль).
2)Решите задачи:
1. Вычислите массу кислорода, взятого объемом 200 л. (285,7 г)
2. Вычислите число молекул сероводорода, если его объем равен 112 л. (30,1 * 1023)
3. Масса газа объемом 4,48 л составляет 8,8 г. Определите молярную массу этого газа. (44г/моль)
Разгадайте ребус и впишите правильный ответ.
Эта физическая величина определяется как отношение массы тела (вещества) к занимаемому этим телом (веществом) объёму. У воды при 4 °С она составляет 1 г/см3, у оливкового масла – 0,92 г/см3, у серной кислоты – 1,84 г/см3.
– Вспомните из курса физики, что такое плотность вещества?
(физическая величина, характеризующая физические свойства вещества и равная отношению массы тела к его объёму, показывает массу единицы объёма вещества )
![]() (г/см3; кг/м3)
(г/см3; кг/м3)
– Как можно определить плотность газа при нормальных условиях?
![]()
ρ1 / ρ2 – ? (относительная плотность)
Цель нашего сегодняшнего урока познакомиться с понятием «относительная плотность газов», научиться производить расчёты относительной плотности газов, убедиться, что эти знания необходимы в нашей повседневной жизни и могут помочь сохранить жизнь и здоровье человеку.
3.Пользуясь материалами видеоурока составьте конспект!
https://resh.edu.ru/subject/lesson/2731/main/
D – показывает во сколько раз один газ легче или тяжелее другого и является безразмерной величиной.
Например:
DНе (О2) = М(О2) / М(Не) = 32г/моль / 4г/моль = 8 1 , значит азот тяжелее гелия
D О2 (N2) = М(N2) / М(О2) = 28г/моль / 32г/моль = 0,875
Расчеты с использованием относительной плотности газов
Задача 1. Определите относительную плотность азота по гелию.
DНе (N2) = М(N2) / М(Не) = 28 / 4 = 7 1, значит азот тяжелее гелия в 7 раз
Задача 2.
Относительная плотность газа по воздуху равна 2. Чему равна молярная масса этого газа?
Dвоздуха (Х) = М(Х) / М(воздуха) = М(Х) / 29; значит
М(Х) = Dвоздуха (Х) * 29 = 2 * 29 = 58 г/моль
Образец: Найдите относительную плотность газа N2 по воздуху?
|
Дано: N2 М(воздуха) = 29 |
Решение: Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29. Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97 Ответ: Газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97 |
|
Найти: Dвоздух – ? |
4. Формирование умений и навыков.
На территории г.Донецка и Донецкой области существуют хранилища химических веществ, представляющих угрозу жизни и здоровья человека в случае их утечки в результате техногенной аварии либо нарушения целостности ёмкости. Это хранилища аммиака на предприятии «Стирол» в г. Горловке и хлора на Донецкой фильтровальной станции. Кроме того, опасность представляет и угарный газ, образующийся при пожаре.
Используя знания, полученные на этом уроке, определите относительную плотность этих газов по воздуху и дайте обоснованные рекомендации по поиску укрытия с целью предотвращения отравления ими населения.
Вывод:
1) При оповещении об утечке хлора прячемся … (на чердаке).
2) При оповещении об утечке аммиака прячемся … (в подвале).
Д.з.
1.п29 повторить №29.17
29.17. Заполните в таблице клеточки со знаками вопроса:
|
№ |
Вещество |
Vm, л/моль |
М, г/моль |
, моль |
V, л |
m, г |
N |
|
1. |
Сl2 |
? |
? |
? |
6,72 л |
? |
? |
|
2. |
СН4 |
? |
? |
5 моль |
? |
? |
? |
|
3. |
SO2 |
? |
? |
? |
? |
12,8 г |
? |
|
4. |
NH3 |
? |
? |
? |
? |
? |
0,6·1023 молекул |
|
5. |
? |
? |
? |
? |
112 л |
1,60 г |
? |
2.п.30 выучить № 30.2,30.5 решить
