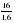Определите истинную формулу углеводорода, при сжигании 4,4 грамм которого получили 13,2 грамм диоксида углерода (CO2) и 7,2 грамм воды (H2O). Относительная плотность по водороду (H2) 22.
Решение задачи
Предлагаю, искомую формулу углеводорода обозначить CхHуOz?, наличие кислорода под вопросом, так как в условии задачи не указано какой углеводород (кислород содержащий или нет).
Рассчитаем молярные массы интересующих нас веществ: диоксид углерода (CO2), воды (H2O):
M (CO2) = 12 + 2 ⋅ 16 = 44 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль).
Найдем массу углерода (Cх) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 44 г диоксид углерода (CO2) содержится 12 г углерода (C)
в 13,2 г диоксид углерода (CO2) содержится Cх г
Откуда:
![]()
Найдем массу водорода (Hу) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 18 г воды (H2O) содержится 2 г водорода (H)
в 7,2 г воды (H2O) содержится Hу г
Откуда:
![]()
Рассчитаем массу углеводорода (CхHуOz?):
m (CхHуOz?)= 3,6 + 0,8 = 4,4 (г), что соответствует условию задачи.
Следовательно, искомую формула углеводорода CхHу.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
![]()
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
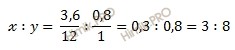
Число атомов углерода (C) и водорода (H) относятся 3 : 8, следовательно простейшая формула углеводорода – C3H8.
Молярная масса (C3H8) равна:
M (C3H8) = 3 ⋅ 12 + 8 = 44 (г/моль).
Найдем относительную молярную массу углеводорода (C3H8), зная, что относительная плотность по водороду (H2) равна 22, по формуле:
![]()
Учитывая, что молярная масса водорода (H2) равна 2 г/моль, получаем:
M (CxHy) = 22 ∙ 2 = 44 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) ”вмещает” молярную массу (C3H8):
M (CxHy)/ M (CH) = 44/44 = 1.
Следовательно, молекулярная формула углеводорода C3H8 (пропан).
Ответ:
молекулярная формула углеводорода C3H8.
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
|
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
|
– на основании массовых долей (%) атомов элементов |
1 |
M |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
|
– на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
|
– по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
|
– на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
|
– по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
|
Дано: |
Решение: M кислоты |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: |
Решение:
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
|
Дано: |
Решение: |
|
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
|
Дано: |
Решение: |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
|
Дано: |
Решение: Составляем пропорции: |
|
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
|
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
|
Вывести формулу соединения |
Вернуться к табл.1
Анна Валерьевна Дзенис
Задачи на вывод молекулярной формулы углеводородов
I. По массовым долям элементов
Опорная информация:
1) Пусть имеется углеводород СхНу, тогда ω%(C) – массовая доля углерода 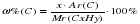 ,
,
преобразуя эту формулу, можно выразить «х» – число атомов углерода: 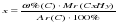 .
.
Аналогично: 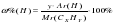 ,
,
преобразуем эту формулу, выражая число атомов водорода («у»):
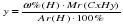 .
.
[Примечание: если по условию задачи известна массовая доля только одного элемента, то массовую долю второго элемента можно определить из формулы:  .]
.]
2) Относительную молекулярную массу углеводорода можно вычислить, зная величину относительной плотности данного углеводорода по какому-либо газу «А» (водород, кислород, гелий, азот или воздух и др):
Mr(СхНу ) = DА(СхНу) · Mr (А),
где DА(СхНу) – относительная плотность газообразного углеводорода СхНу по газу «А»; Mr ср.(воздуха) =29
DА(СхНу) – относительная плотность газообразного углеводорода СхНу по газу «А»; Mr ср.(воздуха) =29
Задача-образец: Определите молекулярную формулу углеводорода, содержащего 84% углерода, если относительная плотность данного вещества по азоту = 3,57.
|
Общая схема решения задачи |
Решение задачи-образец |
|
Дано: а) ω % (C) или ω % (Н) б) DА (СXHY) или ρ Найти: СхНу Последовательность действий: 1) Находим Mr (СXHY) : Если известна DА (СXHY), то Mr(СXHY) = DА (СXHY) • Mr(A) 2) Находим индексы (х и у): а) б) ω % (H) = 100 % – ω % (C) в) |
Дано: а) ω % (C) = 84% б) DN2 (СXHY) = 3,57 Найти: СхНу Решение: 1) Находим Mr (СXHY) : Mr(СXHY) = DN2 (СXHY) • Mr(N2) = 3,57 • 28 = 99,96 2) Находим индексы (х и у): а) б) ω % (H) = 100 % – ω % (C) = 100 % – 84%= 16% в) Ответ: С7Н16 |
1) Задача: Массовая доля углерода в углеводороде составляет 83,3%. Относительная плотность паров этого углеводорода по водороду = 36. Определите молекулярную формулу этого углеводорода.
2) Задача: Определите молекулярную формулу углеводорода, если массовая доля углерода в нем составляет 85,71%, а относительная плотность данного вещества по кислороду равна 1,3125.
3) Задача: Определите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 15,79%. Относительная плотность паров этого вещества по воздуху равна 3,93.
4) Задача: Определите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 18,2%. Относительная плотность данного вещества по азоту равна 1,57.
II. По продуктам сгорания
Задача-образец: При сгорании 92,8 г углеводорода образовалось 143,36 л оксида углерода (IV) и 144 г воды. Относительная плотность углеводорода по воздуху равна двум. Определите молекулярную формулу данного вещества.
|
Общая схема решения задачи |
Решение задачи-образец |
|
Дано: а) m(CXHY) или V(CXHY) б) m(CO2) или V(CO2) в) m(H2O) г) DА (СXHY) Найти: СхНу Последовательность действий: 1) а) Если известна m (CXHY), то сначала определяют М(CXHY): Mr(СXHY) = DА (СXHY) • Mr(A) б) Если известен V(CXHY), то переходим ко 2 действию. 2) Вычисляем : а) n (CXHY) ; б) n(CО2) ; в) n (H2O) по одной из формул: n(A) 3) Вычисляем: а) n (C) = n (CО2) ; б) n (H) = 2• n (H2O). (Примечание: проверка на наличие атомов кислорода: m (О)= m (в-ва) – m (С) – m (Н) = m (в-ва) – 12 · n (C) – 1 · n (Н) ) 4) Записываем соотношение: n (CXHY) : n (C) : n(H) Делим на наименьшее число. 5) Ответ: в 1 молекуле CXHY содержится …. атомов углерода и …. атомов водорода. |
Дано: а) m(CXHY) = 92,8 г б) V(CO2) = 143,36 л в) m(H2O) = 144 г г) Dвоздух (СXHY) = 2 Найти: СхНу Решение: 1) Так как известна m (CXHY), то сначала определяют М(CXHY): Mr(СXHY) = Dвоздух (СXHY) • Mr(воздух) = 2 • 29 = 58 2) Вычисляем : а) n (CXHY) = б) n(CО2) = в) n (H2O) = 3) Вычисляем: а) n (C) = n (CО2) = 6,4 б) n (H) = 2 • n (H2O) = 2 • 8 = 16 (Так как по условию задачи известно, что сожгли углеводород, проверку на кислород делать не нужно) 4) Записываем соотношение: n (CXHY) : n (C) : n(H) 1,6 : 6,4 : 16 Делим на наименьшее число – на 1,6 : 1 : 4 : 10 5) Ответ: С4Н10 |
5) Задача: Относительная плотность углеводорода по водороду равна
14. Определите молекулярную формулу этого вещества, если при сгорании 42 г его образовалось 54 г воды и 67,2 л углекислого газа.
6) Задача: 20,16 л углеводорода сожгли, в результате чего было получено 80,64 л оксида углерода (IV) и 64,8 г воды. Какова молекулярная формула исходного углеводорода?
7) Задача: При сжигании 6,72 л некоторого углеводорода образовалось 26,4 г оксида углерода (IV) и 10,8 г воды. Определите молекулярную формулу данного вещества.
8) Задача: Относительная плотность паров некоторого углеводорода по водороду = 64. В результате сгорания 3,2 г этого вещества образовалось 9,9 г углекислого газа и 4,5 г воды. Определите молекулярную формулу этого углеводорода.
9) Задача: При сжигании 28 л углеводорода было получено 84 л оксида углерода (IV) и 67,5 г воды. Плотность газа по водороду равна 21. Найти молекулярную формулу газа.
10) Задача: При сгорании 17,6 г углеводорода образовалось 52,8 г углекислого газа и 28,8 г воды. Относительная плотность исходного вещества по воздуху равна 1,517. Какова его молекулярная формула?
Морфемный разбор слова:
Однокоренные слова к слову:
Как вычислять относительную плотность вещества

Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.

Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
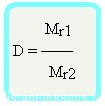
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:

Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.

Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
Наше вещество — C3H6 — пропен
Еще на эту тему:
Обсуждение: «Относительная плотность по… задачи»
Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 гмоль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 гмоль
и, наконец,
4) D = Mr (( С5H10Br2 ) Mr(O2) = 23032 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз ? ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! ?
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 гмоль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99гмоль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 гмоль — получаем либо кремний: SiCl4 SiBr4, либо галогеналкен: C2Cl4 С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=mMr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=mn=12.15 = 80 гмоль
Ar(Me)=(80-48)2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=mMr=413.244 = 9.4 моль
n(оксида)=n(CO2)
Mr=mn = … не получается
Проверьте условие задачи. Что-то там не то с числами…
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Относительная плотность вещества по воздуху = M(вещества) M(воздуха) (29 гмоль)
Относительная плотность вещества по водороду = M(вещества) M(H2)
M(вещества)=M(N2)*D=28гмоль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)12 гмоль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан ?
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 гмоль = 42 гмоль
M(Hy)=42 гмоль* 0.143 = 6 гмоль
y = M(Hy)Ar(H) = 66 = 1
значит, M(Cy)=42-6 = 36 гмоль
y = M(Cy)Ar(C) = 3612 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 гмоль = 28 гмоль, предположим, что в оксиде 1 атом О, тогда 12 гмоль — атомная масса элемента. Это С
M( оксида 2) = 15*2 гмоль = 30 гмоль. Если у нас 1 атома О, то 14 гмоль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 гмоль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси
Источник
Что такое относительная плотность по водороду?
плотность вещества по водороду формула
Что такое относительная плотность вещества по водороду?
![]()
Отношение относительной молекулярной массы газа к относительной молекулярной массе водорода-2 или воздуха-29
![]()
Более подробную информацию можно прочитать в книжке И.П Неумывакина «Перекись водорода»,именно в книге написана и инструкция применения, и при каких заболеваниях принимают.
![]()
В 1989 году на Калининской АЭС произошёл врыв водорода под крышкой реактора, который там накопился вследствие радиолиза.
![]()
Давление водорода (да и любого газа) внутри шарика определяется давлением на него оболочки шара плюс давлением воздуха снаружи. И чем больше это давление, тем меньше объём шарика. Ведь при увеличении давления объём уменьшается и наоборот. И всем давно известно, что атмосферное давление с высотой уменьшается. А в космосе так вообще к нулю приближается. Поэтому при наборе шариком высоты соответственно у него и увеличивается объём. Просто выравнивается давление внутри и снаружи шара.
![]()
Надежного способа для хранения водорода нет. Сейчас его хранят под большим давлением в баллонах. Но он постоянно оттуда испаряется. Конечно, взрывоопасных концентраций не создается, но баллоны охлаждаются ощутимо.
Именно поэтому водород отметается, как источник питания двигателей будущего. Пока все указывает на метанол.

![]()
Источник
Химик.ПРО – решение задач по химии бесплатно
Определите истинную формулу углеводорода, при сжигании 4,4 грамм которого получили 13,2 грамм диоксида углерода (CO2) и 7,2 грамм воды (H2O). Относительная плотность по водороду (H2) 22.
Решение задачи
Рассчитаем молярные массы интересующих нас веществ: диоксид углерода (CO2), воды (H2O):
M (CO2) = 12 + 2 ⋅ 16 = 44 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль).
в 44 г диоксид углерода (CO2) содержится 12 г углерода (C)
в 13,2 г диоксид углерода (CO2) содержится Cх г
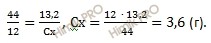
в 18 г воды (H2O) содержится 2 г водорода (H)
в 7,2 г воды (H2O) содержится Hу г
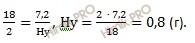
Следовательно, искомую формула углеводорода CхHу.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
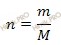
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
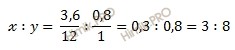
Число атомов углерода (C) и водорода (H) относятся 3 : 8, следовательно простейшая формула углеводорода – C3H8.
Найдем относительную молярную массу углеводорода (C3H8), зная, что относительная плотность по водороду (H2) равна 22, по формуле:
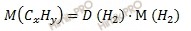
Учитывая, что молярная масса водорода (H2) равна 2 г/моль, получаем:
M (CxHy) = 22 ∙ 2 = 44 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) ”вмещает” молярную массу (C3H8):
M (CxHy)/ M (CH) = 44/44 = 1.
Следовательно, молекулярная формула углеводорода C3H8 (пропан).
Ответ:
молекулярная формула углеводорода C3H8.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется плотность по водороду, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову “Как пишется плотность по водороду”, предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
как найти относительную плотность пропана и бутана за водородом ? распишите вкратце пожалуйста
Профи
(581),
закрыт
9 лет назад
NiNa Martushova
Искусственный Интеллект
(153334)
11 лет назад
Я так поняла, -определить относительную плотность по водороду? Это значит узнать на сколько эти газы тяжелее водорода (это, если совсем просто) . Вычисление делаем по формуле D(H2) = M(C3H8) : M(H2); M-это молярная масса
или масса 1 моль вещества. М (С3Н8) = 44 гмоль. Плотность по водороду равна D(H2)= 44:2=22. М (С4Н10)=48:2=24.
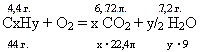
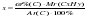
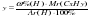
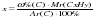 =
= 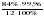 = 6,99
= 6,99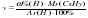 =
=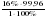 = 15,99
= 15,99 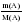 или n(A)
или n(A) 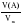
 =
= 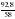 = 1,6
= 1,6 =
= 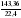 = 6,4
= 6,4 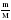 =
= 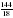 = 8
= 8 :
:  :
: