Относительная плотность по… задачи
24-Фев-2013 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
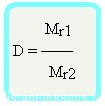
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 гмоль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 гмоль • D (обратите внимание, Mr(воздуха) принята равной 29 гмоль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Обсуждение: “Относительная плотность по… задачи”
(Правила комментирования)
Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- – периодическая система химических элементов Д.И. Менделеева;
- – калькулятор.
Инструкция
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) – относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) – относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
| Specific gravity | |
|---|---|
|
Common symbols |
SG |
| SI unit | Unitless |
|
Derivations from |
 |
Relative density, or specific gravity,[1][2] is the ratio of the density (mass of a unit volume) of a substance to the density of a given reference material. Specific gravity for liquids is nearly always measured with respect to water at its densest (at 4 °C or 39.2 °F); for gases, the reference is air at room temperature (20 °C or 68 °F). The term “relative density” (often abbreviated r.d. or RD) is often preferred in scientific usage, whereas the term “specific gravity” is deprecated.[citation needed]
If a substance’s relative density is less than 1 then it is less dense than the reference; if greater than 1 then it is denser than the reference. If the relative density is exactly 1 then the densities are equal; that is, equal volumes of the two substances have the same mass. If the reference material is water, then a substance with a relative density (or specific gravity) less than 1 will float in water. For example, an ice cube, with a relative density of about 0.91, will float. A substance with a relative density greater than 1 will sink.
Temperature and pressure must be specified for both the sample and the reference. Pressure is nearly always 1 atm (101.325 kPa). Where it is not, it is more usual to specify the density directly. Temperatures for both sample and reference vary from industry to industry. In British brewing practice, the specific gravity, as specified above, is multiplied by 1000.[3] Specific gravity is commonly used in industry as a simple means of obtaining information about the concentration of solutions of various materials such as brines, must weight (syrups, juices, honeys, brewers wort, must, etc.) and acids.
Basic calculation[edit]
Relative density (

where 



The reference material can be indicated using subscripts: 
The relative density of gases is often measured with respect to dry air at a temperature of 20 °C and a pressure of 101.325 kPa absolute, which has a density of 1.205 kg/m3. Relative density with respect to air can be obtained by
where 
Those with SG greater than 1 are denser than water and will, disregarding surface tension effects, sink in it. Those with an SG less than 1 are less dense than water and will float on it. In scientific work, the relationship of mass to volume is usually expressed directly in terms of the density (mass per unit volume) of the substance under study. It is in industry where specific gravity finds wide application, often for historical reasons.
True specific gravity of a liquid can be expressed mathematically as:
where 

The apparent specific gravity is simply the ratio of the weights of equal volumes of sample and water in air:
where 

It can be shown that true specific gravity can be computed from different properties:
where g is the local acceleration due to gravity, V is the volume of the sample and of water (the same for both), ρsample is the density of the sample, ρH2O is the density of water, WV represents a weight obtained in vacuum, 

The density of water varies with temperature and pressure as does the density of the sample. So it is necessary to specify the temperatures and pressures at which the densities or weights were determined. It is nearly always the case that measurements are made at 1 nominal atmosphere (101.325 kPa ± variations from changing weather patterns). But as specific gravity usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products), variations in density caused by pressure are usually neglected at least where apparent specific gravity is being measured. For true (in vacuo) specific gravity calculations, air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr), with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures, we note that, while SGH2O = 1.000000 (20 °C/20 °C), it is also the case that SGH2O = 0.998203⁄0.999840 = 0.998363 (20 °C/4 °C). Here, temperature is being specified using the current ITS-90 scale and the densities[4] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale, the densities at 20 °C and 4 °C are 0.9982071 and 0.9999720 respectively, resulting in an SG (20 °C/4 °C) value for water of 0.9982343.
As the principal use of specific gravity measurements in industry is determination of the concentrations of substances in aqueous solutions and as these are found in tables of SG versus concentration, it is extremely important that the analyst enter the table with the correct form of specific gravity. For example, in the brewing industry, the Plato table lists sucrose concentration by weight against true SG, and was originally (20 °C/4 °C)[5] i.e. based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density, ρH2O equal to 999.972 kg/m3 in SI units (0.999972 g/cm3 in cgs units or 62.43 lb/cu ft in United States customary units). The ASBC table[6] in use today in North America, while it is derived from the original Plato table is for apparent specific gravity measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries, sucrose concentration by weight is taken from a table prepared by A. Brix, which uses SG (17.5 °C/17.5 °C). As a final example, the British SG units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).
Given the specific gravity of a substance, its actual density can be calculated by rearranging the above formula:
Occasionally a reference substance other than water is specified (for example, air), in which case specific gravity means density relative to that reference.
Temperature dependence[edit]
- See Density for a table of the measured densities of water at various temperatures.
The density of substances varies with temperature and pressure so that it is necessary to specify the temperatures and pressures at which the densities or masses were determined. It is nearly always the case that measurements are made at nominally 1 atmosphere (101.325 kPa ignoring the variations caused by changing weather patterns) but as relative density usually refers to highly incompressible aqueous solutions or other incompressible substances (such as petroleum products) variations in density caused by pressure are usually neglected at least where apparent relative density is being measured. For true (in vacuo) relative density calculations air pressure must be considered (see below). Temperatures are specified by the notation (Ts/Tr) with Ts representing the temperature at which the sample’s density was determined and Tr the temperature at which the reference (water) density is specified. For example, SG (20 °C/4 °C) would be understood to mean that the density of the sample was determined at 20 °C and of the water at 4 °C. Taking into account different sample and reference temperatures we note that while SGH2O = 1.000000 (20 °C/20 °C) it is also the case that RDH2O = 0.998203/0.998840 = 0.998363 (20 °C/4 °C). Here temperature is being specified using the current ITS-90 scale and the densities[7] used here and in the rest of this article are based on that scale. On the previous IPTS-68 scale the densities at 20 °C and 4 °C are, respectively, 0.9982071 and 0.9999720 resulting in an RD (20 °C/4 °C) value for water of 0.9982343.
The temperatures of the two materials may be explicitly stated in the density symbols; for example:
- relative density: 8.1520 °C
4 °C; or specific gravity: 2.43215
0
where the superscript indicates the temperature at which the density of the material is measured, and the subscript indicates the temperature of the reference substance to which it is compared.
Uses[edit]
Relative density can also help to quantify the buoyancy of a substance in a fluid or gas, or determine the density of an unknown substance from the known density of another. Relative density is often used by geologists and mineralogists to help determine the mineral content of a rock or other sample. Gemologists use it as an aid in the identification of gemstones. Water is preferred as the reference because measurements are then easy to carry out in the field (see below for examples of measurement methods).
As the principal use of relative density measurements in industry is determination of the concentrations of substances in aqueous solutions and these are found in tables of RD vs concentration it is extremely important that the analyst enter the table with the correct form of relative density. For example, in the brewing industry, the Plato table, which lists sucrose concentration by mass against true RD, were originally (20 °C/4 °C)[8] that is based on measurements of the density of sucrose solutions made at laboratory temperature (20 °C) but referenced to the density of water at 4 °C which is very close to the temperature at which water has its maximum density of ρ(H
2O) equal to 0.999972 g/cm3 (or 62.43 lb·ft−3). The ASBC table[9] in use today in North America, while it is derived from the original Plato table is for apparent relative density measurements at (20 °C/20 °C) on the IPTS-68 scale where the density of water is 0.9982071 g/cm3. In the sugar, soft drink, honey, fruit juice and related industries sucrose concentration by mass is taken from this work[3] which uses SG (17.5 °C/17.5 °C). As a final example, the British RD units are based on reference and sample temperatures of 60 °F and are thus (15.56 °C/15.56 °C).[3]
Measurement[edit]
Relative density can be calculated directly by measuring the density of a sample and dividing it by the (known) density of the reference substance. The density of the sample is simply its mass divided by its volume. Although mass is easy to measure, the volume of an irregularly shaped sample can be more difficult to ascertain. One method is to put the sample in a water-filled graduated cylinder and read off how much water it displaces. Alternatively the container can be filled to the brim, the sample immersed, and the volume of overflow measured. The surface tension of the water may keep a significant amount of water from overflowing, which is especially problematic for small samples. For this reason it is desirable to use a water container with as small a mouth as possible.
For each substance, the density, ρ, is given by
When these densities are divided, references to the spring constant, gravity and cross-sectional area simply cancel, leaving
Hydrostatic weighing[edit]
Relative density is more easily and perhaps more accurately measured without measuring volume. Using a spring scale, the sample is weighed first in air and then in water. Relative density (with respect to water) can then be calculated using the following formula:
where
- Wair is the weight of the sample in air (measured in newtons, pounds-force or some other unit of force)
- Wwater is the weight of the sample in water (measured in the same units).
This technique cannot easily be used to measure relative densities less than one, because the sample will then float. Wwater becomes a negative quantity, representing the force needed to keep the sample underwater.
Another practical method uses three measurements. The sample is weighed dry. Then a container filled to the brim with water is weighed, and weighed again with the sample immersed, after the displaced water has overflowed and been removed. Subtracting the last reading from the sum of the first two readings gives the weight of the displaced water. The relative density result is the dry sample weight divided by that of the displaced water. This method allows the use of scales which cannot handle a suspended sample. A sample less dense than water can also be handled, but it has to be held down, and the error introduced by the fixing material must be considered.
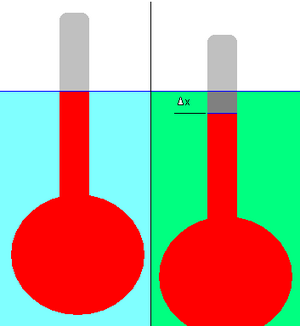
Hydrometer[edit]
The relative density of a liquid can be measured using a hydrometer. This consists of a bulb attached to a stalk of constant cross-sectional area, as shown in the adjacent diagram.
First the hydrometer is floated in the reference liquid (shown in light blue), and the displacement (the level of the liquid on the stalk) is marked (blue line). The reference could be any liquid, but in practice it is usually water.
The hydrometer is then floated in a liquid of unknown density (shown in green). The change in displacement, Δx, is noted. In the example depicted, the hydrometer has dropped slightly in the green liquid; hence its density is lower than that of the reference liquid. It is necessary that the hydrometer floats in both liquids.
The application of simple physical principles allows the relative density of the unknown liquid to be calculated from the change in displacement. (In practice the stalk of the hydrometer is pre-marked with graduations to facilitate this measurement.)
In the explanation that follows,
- ρref is the known density (mass per unit volume) of the reference liquid (typically water).
- ρnew is the unknown density of the new (green) liquid.
- RDnew/ref is the relative density of the new liquid with respect to the reference.
- V is the volume of reference liquid displaced, i.e. the red volume in the diagram.
- m is the mass of the entire hydrometer.
- g is the local gravitational constant.
- Δx is the change in displacement. In accordance with the way in which hydrometers are usually graduated, Δx is here taken to be negative if the displacement line rises on the stalk of the hydrometer, and positive if it falls. In the example depicted, Δx is negative.
- A is the cross sectional area of the shaft.
Since the floating hydrometer is in static equilibrium, the downward gravitational force acting upon it must exactly balance the upward buoyancy force. The gravitational force acting on the hydrometer is simply its weight, mg. From the Archimedes buoyancy principle, the buoyancy force acting on the hydrometer is equal to the weight of liquid displaced. This weight is equal to the mass of liquid displaced multiplied by g, which in the case of the reference liquid is ρrefVg. Setting these equal, we have
or just
|
|
(1) |
Exactly the same equation applies when the hydrometer is floating in the liquid being measured, except that the new volume is V − AΔx (see note above about the sign of Δx). Thus,
|
|
(2) |
Combining (1) and (2) yields
|
|
(3) |
But from (1) we have V = m/ρref. Substituting into (3) gives
|
|
(4) |
This equation allows the relative density to be calculated from the change in displacement, the known density of the reference liquid, and the known properties of the hydrometer. If Δx is small then, as a first-order approximation of the geometric series equation (4) can be written as:
This shows that, for small Δx, changes in displacement are approximately proportional to changes in relative density.
Pycnometer[edit]
An empty glass pycnometer and stopper
A pycnometer (from Greek: πυκνός (puknos) meaning “dense”), also called pyknometer or specific gravity bottle, is a device used to determine the density of a liquid. A pycnometer is usually made of glass, with a close-fitting ground glass stopper with a capillary tube through it, so that air bubbles may escape from the apparatus. This device enables a liquid’s density to be measured accurately by reference to an appropriate working fluid, such as water or mercury, using an analytical balance.[citation needed]
If the flask is weighed empty, full of water, and full of a liquid whose relative density is desired, the relative density of the liquid can easily be calculated. The particle density of a powder, to which the usual method of weighing cannot be applied, can also be determined with a pycnometer. The powder is added to the pycnometer, which is then weighed, giving the weight of the powder sample. The pycnometer is then filled with a liquid of known density, in which the powder is completely insoluble. The weight of the displaced liquid can then be determined, and hence the relative density of the powder.
A gas pycnometer, the gas-based manifestation of a pycnometer, compares the change in pressure caused by a measured change in a closed volume containing a reference (usually a steel sphere of known volume) with the change in pressure caused by the sample under the same conditions. The difference in change of pressure represents the volume of the sample as compared to the reference sphere, and is usually used for solid particulates that may dissolve in the liquid medium of the pycnometer design described above, or for porous materials into which the liquid would not fully penetrate.
When a pycnometer is filled to a specific, but not necessarily accurately known volume, V and is placed upon a balance, it will exert a force
where mb is the mass of the bottle and g the gravitational acceleration at the location at which the measurements are being made. ρa is the density of the air at the ambient pressure and ρb is the density of the material of which the bottle is made (usually glass) so that the second term is the mass of air displaced by the glass of the bottle whose weight, by Archimedes Principle must be subtracted. The bottle is filled with air but as that air displaces an equal amount of air the weight of that air is canceled by the weight of the air displaced. Now we fill the bottle with the reference fluid e.g. pure water. The force exerted on the pan of the balance becomes:
If we subtract the force measured on the empty bottle from this (or tare the balance before making the water measurement) we obtain.
where the subscript n indicated that this force is net of the force of the empty bottle. The bottle is now emptied, thoroughly dried and refilled with the sample. The force, net of the empty bottle, is now:
where ρs is the density of the sample. The ratio of the sample and water forces is:
This is called the apparent relative density, denoted by subscript A, because it is what we would obtain if we took the ratio of net weighings in air from an analytical balance or used a hydrometer (the stem displaces air). Note that the result does not depend on the calibration of the balance. The only requirement on it is that it read linearly with force. Nor does RDA depend on the actual volume of the pycnometer.
Further manipulation and finally substitution of RDV, the true relative density (the subscript V is used because this is often referred to as the relative density in vacuo), for ρs/ρw gives the relationship between apparent and true relative density:
In the usual case we will have measured weights and want the true relative density. This is found from
Since the density of dry air at 101.325 kPa at 20 °C is[10] 0.001205 g/cm3 and that of water is 0.998203 g/cm3 we see that the difference between true and apparent relative densities for a substance with relative density (20 °C/20 °C) of about 1.100 would be 0.000120. Where the relative density of the sample is close to that of water (for example dilute ethanol solutions) the correction is even smaller.
The pycnometer is used in ISO standard: ISO 1183-1:2004, ISO 1014–1985 and ASTM standard: ASTM D854.
Types
- Gay-Lussac, pear shaped, with perforated stopper, adjusted, capacity 1, 2, 5, 10, 25, 50 and 100 mL
- as above, with ground-in thermometer, adjusted, side tube with cap
- Hubbard, for bitumen and heavy crude oils, cylindrical type, ASTM D 70, 24 mL
- as above, conical type, ASTM D 115 and D 234, 25 mL
- Boot, with vacuum jacket and thermometer, capacity 5, 10, 25 and 50 mL
Digital density meters[edit]
Hydrostatic Pressure-based Instruments: This technology relies upon Pascal’s Principle which states that the pressure difference between two points within a vertical column of fluid is dependent upon the vertical distance between the two points, the density of the fluid and the gravitational force. This technology is often used for tank gaging applications as a convenient means of liquid level and density measure.
Vibrating Element Transducers: This type of instrument requires a vibrating element to be placed in contact with the fluid of interest. The resonant frequency of the element is measured and is related to the density of the fluid by a characterization that is dependent upon the design of the element. In modern laboratories precise measurements of relative density are made using oscillating U-tube meters. These are capable of measurement to 5 to 6 places beyond the decimal point and are used in the brewing, distilling, pharmaceutical, petroleum and other industries. The instruments measure the actual mass of fluid contained in a fixed volume at temperatures between 0 and 80 °C but as they are microprocessor based can calculate apparent or true relative density and contain tables relating these to the strengths of common acids, sugar solutions, etc.
Ultrasonic Transducer: Ultrasonic waves are passed from a source, through the fluid of interest, and into a detector which measures the acoustic spectroscopy of the waves. Fluid properties such as density and viscosity can be inferred from the spectrum.
Radiation-based Gauge: Radiation is passed from a source, through the fluid of interest, and into a scintillation detector, or counter. As the fluid density increases, the detected radiation “counts” will decrease. The source is typically the radioactive isotope caesium-137, with a half-life of about 30 years. A key advantage for this technology is that the instrument is not required to be in contact with the fluid—typically the source and detector are mounted on the outside of tanks or piping.[11]
Buoyant Force Transducer: the buoyancy force produced by a float in a homogeneous liquid is equal to the weight of the liquid that is displaced by the float. Since buoyancy force is linear with respect to the density of the liquid within which the float is submerged, the measure of the buoyancy force yields a measure of the density of the liquid. One commercially available unit claims the instrument is capable of measuring relative density with an accuracy of ± 0.005 RD units. The submersible probe head contains a mathematically characterized spring-float system. When the head is immersed vertically in the liquid, the float moves vertically and the position of the float controls the position of a permanent magnet whose displacement is sensed by a concentric array of Hall-effect linear displacement sensors. The output signals of the sensors are mixed in a dedicated electronics module that provides a single output voltage whose magnitude is a direct linear measure of the quantity to be measured.[12]
The relative density in soil mechanics[edit]
The relative density 
in which 

Examples[edit]
| Material | Specific gravity |
|---|---|
| Balsa wood | 0.2 |
| Oak wood | 0.75 |
| Ethanol | 0.78 |
| Olive oil | 0.91 |
| Water | 1 |
| Ironwood | 1.5 |
| Graphite | 1.9–2.3 |
| Table salt | 2.17 |
| Aluminium | 2.7 |
| Cement | 3.15 |
| Iron | 7.87 |
| Copper | 8.96 |
| Lead | 11.35 |
| Mercury | 13.56 |
| Depleted uranium | 19.1 |
| Gold | 19.3 |
| Osmium | 22.59 |
(Samples may vary, and these figures are approximate.)
Substances with a relative density of 1 are neutrally buoyant, those with RD greater than one are denser than water, and so (ignoring surface tension effects) will sink in it, and those with an RD of less than one are less dense than water, and so will float.
Example:
Helium gas has a density of 0.164 g/L;[13] it is 0.139 times as dense as air, which has a density of 1.18 g/L.[13]
- Urine normally has a specific gravity between 1.003 and 1.030. The Urine Specific Gravity diagnostic test is used to evaluate renal concentration ability for assessment of the urinary system.[14] Low concentration may indicate diabetes insipidus, while high concentration may indicate albuminuria or glycosuria.[14]
- Blood normally has a specific gravity of approximately 1.060.[15]
- Vodka 80° proof (40% v/v) has a specific gravity of 0.9498.[16]
See also[edit]
- API gravity
- Baumé scale
- Buoyancy
- Fluid mechanics
- Gravity (beer)
- Hydrometer
- Jolly balance
- Plato scale
References[edit]
- ^ Dana, Edward Salisbury (1922). A text-book of mineralogy: with an extended treatise on crystallography… New York, London(Chapman Hall): John Wiley and Sons. pp. 195–200, 316.
- ^ Schetz, Joseph A.; Allen E. Fuhs (1999-02-05). Fundamentals of fluid mechanics. Wiley, John & Sons, Incorporated. pp. 111, 142, 144, 147, 109, 155, 157, 160, 175. ISBN 0-471-34856-2.
- ^ a b c Hough, J.S., Briggs, D.E., Stevens, R and Young, T.W. Malting and Brewing Science, Vol. II Hopped Wort and Beer, Chapman and Hall, London, 1991, p. 881
- ^ Bettin, H.; Spieweck, F. (1990). “Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990”. PTB-Mitteilungen 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ Bettin, H.; Spieweck, F. (1990). Die Dichte des Wassers als Funktion der Temperatur nach Einführung des Internationalen Temperaturskala von 1990 (in German). PTB=Mitt. 100. pp. 195–196.
- ^ ASBC Methods of Analysis Preface to Table 1: Extract in Wort and Beer, American Society of Brewing Chemists, St Paul, 2009
- ^ ASBC Methods of Analysis op. cit. Table 1: Extract in Wort and Beer
- ^ DIN51 757 (04.1994): Testing of mineral oils and related materials; determination of density
- ^ Density – VEGA Americas, Inc. Ohmartvega.com. Retrieved on 2011-09-30.
- ^ Process Control Digital Electronic Hydrometer. Gardco. Retrieved on 2011-09-30.
- ^ a b “Lecture Demonstrations”. physics.ucsb.edu.
- ^ a b Lewis, Sharon Mantik; Dirksen, Shannon Ruff; Heitkemper, Margaret M.; Bucher, Linda; Harding, Mariann (5 December 2013). Medical-surgical nursing : assessment and management of clinical problems (9th ed.). St. Louis, Missouri. ISBN 978-0-323-10089-2. OCLC 228373703.
- ^ Shmukler, Michael (2004). Elert, Glenn (ed.). “Density of blood”. The Physics Factbook. Retrieved 2022-01-23.
- ^ “Specific Gravity of Liqueurs”. Good Cocktails.com.
Further reading[edit]
- Fundamentals of Fluid Mechanics Wiley, B.R. Munson, D.F. Young & T.H. Okishi
- Introduction to Fluid Mechanics Fourth Edition, Wiley, SI Version, R.W. Fox & A.T. McDonald
- Thermodynamics: An Engineering Approach Second Edition, McGraw-Hill, International Edition, Y.A. Cengel & M.A. Boles
- Munson, B. R.; D. F. Young; T. H. Okishi (2001). Fundamentals of Fluid Mechanics (4th ed.). Wiley. ISBN 978-0-471-44250-9.
- Fox, R. W.; McDonald, A. T. (2003). Introduction to Fluid Mechanics (4th ed.). Wiley. ISBN 0-471-20231-2.
External links[edit]
- Specific Gravity Weights Of Materials
Совет 1: Как вычислять относительную плотность вещества
Такая колляция, как относительная плотность вещества, показывает, во сколько раз оно тяжелее либо легче иного соединения. Данный параметр дозволено определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты касательно воздуха либо водорода. Впрочем могут попадаться задания, в которых нужно вычислить относительную плотность и по иным газам, таким как кислород, аммиак либо сероводород. В любом случае правило решения задания целен.
Вам понадобится
- – периодическая система химических элементов Д.И. Менделеева;
- – калькулятор.
Инструкция
1. Для того дабы совладать с задачей, нужно применять формулы на определение относительной плотности:D (воздух) = Mr (газа)/ Mr (воздуха), где:D (воздух) – относительная плотность; Mr (газа) – относительная молекулярная масса газообразного вещества; Mr (воздуха) – относительная молекулярная масса воздуха.Все три параметра единиц измерения не имеют. Mr (воздуха) = 29 (величина непрерывная), следственно формула будет иметь вид:D (воздух) = Mr (газа)/ 29.
2. По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что взамен воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.D (водород) = Mr (газа)/ Mr (водорода);D (водород) – относительная плотность; Mr (газа) – относительная молекулярная масса газообразного вещества; Mr (водорода) – относительная молекулярная масса водорода.Mr (водорода) = 2, следственно и формула будет иметь вид:D (воздух) = Mr (газа)/ 2.
3. Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3. Вначале обнаружьте относительную молекулярную массу аммиака, которую дозволено рассчитать по таблице Д.И. Менделеева. Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсель Mr (NH3) = 14 + 3 = 17Подставьте полученные данные в формулу на определение относительной плотности по воздуху:D (воздух) = Mr (аммиака)/ Mr (воздуха);D (воздух) = Mr (аммиака)/ 29;D (воздух) = 17/ 29 = 0, 59.
4. Пример № 2. Вычислите относительную плотность аммиака по водороду.Подставьте данные в формулу на определение относительной плотности по водороду:D (водород) = Mr (аммиака)/ Mr (водорода);D (водород) = Mr (аммиака)/ 2;D (водород) = 17/ 2 = 8, 5.
Совет 2: Как определить плотность водорода
Водород (от латинского «Hydrogenium» – «порождающий воду») – 1-й элемент таблицы Менделеева. Обширно распространен, существует в виде 3 изотопов – протия, дейтерия и трития. Водород представляет собою легкий бесцветный газ (в 14,5 раз легче воздуха). В смеси с воздухом и кислородом крайне взрывоопасен. Применяется в химической, пищевой промышленности, а также в качестве ракетного топлива. Ведутся изыскания по вероятности применения водорода в качестве топлива для автомобильных моторов. Плотность водорода (как и всякого иного газа) дозволено определить различными методами.
Инструкция
1. Во-первых, исходя из универсального определения плотности – число вещества в единице объема. В том случае, если чистый водород находится в герметичном сосуде, плотность газа определяется элементарно, по формуле (М1 – М2)/V, где М1 – всеобщая масса сосуда с газом, М2 – масса пустого сосуда, а V – внутренний объем сосуда.
2. Если же требуется определить плотность водорода , имея такие начальные данные, как его температура и давление, здесь на подмога приходит универсальное уравнение состояния совершенного газа, либо уравнение Менделеева – Клапейрона: PV = (mRT)/M.P – давление газаV – его объемR – универсальная газовая постояннаяТ – температура газа в градусах КельвинаM – молярная масса газаm – фактическая масса газа.
3. Безупречным газом считается такая математическая модель газа, в которой потенциальной энергией взаимодействия молекул по сопоставлению с их кинетической энергией дозволено пренебречь. В модели безукоризненного газа между молекулами не действуют силы притяжения либо отталкивания, а столкновения частиц с другими частицами либо стенками сосуда, безусловно упруги.
4. Разумеется, ни водород, ни иной газ не является безукоризненным, но эта модель дозволяет проводить вычисления с довольно высокой точностью при условиях, близких к атмосферному давлению и комнатной температуре. Скажем, дана задача: обнаружить плотность водорода при давлении 6 атмосфер и температуре 20 градусов по Цельсию.
5. Вначале переведите все начальные величины в систему СИ (6 атмосфер = 607950 Па, 20 градусов Ц=293 градуса К). После этого напишите уравнение Менделеева-Клапейрона PV = (mRT)/M. Преобразуйте его в виде: P = (mRT)/MV. От того что m/V есть плотность (отношение массы вещества к его объему), то получаете: плотность водорода = PM/RT, причем все нужные данные для решения у нас есть. Вы знаеете величину давления (607950), температуру (293), универсальную газовую непрерывную (8,31), молярную массу водорода (0,002).
6. Подставив эти данные в формулу, вы получите: плотность водорода при заданных условиях давления и температуры равна 0,499 кг/кубический метр, либо приблизительно 0,5.
Совет 3: Как вычислить плотность
Плотность – это одна из колляций вещества, такая же, как масса, объем, температура, площадь. Она равна отношению массы к объему. Основная задача – обучиться вычислять эту величину и знать, от чего она зависит.
Инструкция
1. Плотность вещества – это численное отношение массы к объему вещества. Если вы хотите определить плотность вещества, а вам вестимы его масса и объем, нахождение плотности не составит вам труда. Самый легкой метод обнаружить плотность в данном случае – это p = m/V. Она измеряется в кг/м^3 в системе СИ. Впрочем вдалеке не неизменно даны эти два значения, следственно следует знать несколько методов, с поддержкой которых дозволено вычислить плотность.
2. Плотность имеет различные значения в зависимости от вида вещества. Помимо того, плотность веществ меняется и от степени солености и температуры. При уменьшении температуры плотность нарастает, а при понижении степени солености понижается и плотность. Скажем, плотность Красного моря по-бывшему считается высокой, а в Балтийском море она теснее поменьше. Все вы примечали, что если в воду подлить масла, оно всплывает наверх. Все это происходит из-за того, что масло имеет больше низкую плотность, нежели вода. Металлы и каменные вещества, напротив тонут, потому что их плотность выше. На основании плотности тел появилась теория об их плавании.
3. Вследствие теории плавания тел возникла формула, по которой дозволено обнаружить плотность тела, зная плотность воды, объем каждого тела и объем его погруженной части. Эта формула имеет вид:Vпогруж. части / V тела = p тела / p жидк.Отсель следует, что плотность тела дозволено обнаружить дальнейшим образом:р тела = V погруж. части * р жидк / V тела.Это условие выполняется исходя из табличных данных и заданных объемов V погруж. части и V тела.
Видео по теме
Совет 4: Как вычислить относительную молекулярную массу вещества
Относительная молекулярная масса – это безразмерная величина, показывающая во сколько раз масса молекулы огромнее 1/12 массы атома углерода. Соответственно, масса атома углерода равна 12 единиц. Определить относительную молекулярную массу химического соединения дозволено, сложив массы атомов, из которых состоит молекула вещества.
Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор;
- – таблица Менделеева.
Инструкция
1. Запишите химическую формулу соединения, относительную молекулярную массу которого требуется вычислить. Скажем, ортофосфорная кислота H3PO4. Из формулы вы можете увидеть, что молекула кислоты состоит из 3 атомов водорода, одного атома фосфора и четырех атомов кислорода.
2. Обнаружьте в таблице Менделеева ячейки элементов, из которых состоит данная молекула. Значения относительных ядерных масс (Ar) для всего вещества указаны в левом нижнем углу ячейки. Перепишите их, округлив до целого числа: Ar(H) – 1; Ar( P) – 31; Ar(O) – 16.
3. Определите относительную молекулярную массу соединения (Mr). Для этого умножьте ядерную массу всякого элемента на число атомов в молекуле. После этого сложите получившиеся значения. Для ортофосфорной кислоты: Mr(н3ро4) = 3*1 + 1*31 + 4*16 = 98.
4. Относительная молекулярная масса численно совпадает с молярной массой вещества. В некоторых задачах применяется эта связь. Пример: газ при температуре 200 К и давлении 0,2 MПа имеет плотность 5,3 кг/мз. Определить его относительную молекулярную массу.
5. Используйте уравнение Менделеева-Клайперона для безукоризненного газа: PV = mRT/M, где V – объем газа, м3; m – масса данного объела газа, кг; M – молярная масса газа, кг/моль; R – универсальная газовая непрерывная. R=8.314472 м2кг с-2 К-1 Моль-1; T – температура газа, К; P – безусловное давление, Па. Выразите из этой зависимости молярную массу: М = mRT/(PV).
6. Как знаменито, формула плотности: p = m/V, кг/м3. Подставьте ее в выражение: М = рRT/P. Определите молярную массу газа: М = 5,3*8,31*200/(2*10^5) = 0,044 кг/моль. Относительная молекулярная масса газа: Mr = 44. Вы можете предположить, что это углекислый газ: Mr(CO2) = 12 + 16*2 = 44.
Совет 5: Как обнаружить относительную плотность
В химических лабораториях и при проведения химических навыков в домашних условиях зачастую бывает нужно определить относительную плотность того либо другого вещества. Относительная плотность представляет собой отношение плотности определенного вещества к плотности иного при определенных условиях либо к плотности эталонного вещества, за которое принимается дистиллированная вода. Относительная плотность выражается отвлеченным числом.
Вам понадобится
- – таблицы и справочники;
- – ареометр, пикнометр либо особые весы.
Инструкция
1. Относительную плотность веществ по отношению к плотности дистиллированной воды определяйте по формуле: d=p/p0, где d – желанная относительная плотность, p – плотность исследуемого вещества, p0 – плотность эталонного вещества. Конечный параметр табличный и определен достаточно верно: при 20оС дистиллированная вода имеет плотность 998,203 кг/куб.м, а максимальной плотности она достигает при 4оС – 999,973 кг/куб.м. Перед вычислениями не забывайте, что р и р0 обязаны быть выражены в идентичных единицах измерения.
2. Помимо того, относительную плотность вещества дозволено узнать в физических и химических справочниках. Числовое значение относительной плотности неизменно равно относительному удельному весу того же вещества в одних и тех же условиях. Итог: пользуйтесь таблицами относительных удельных весов так же, как если бы это были таблицы относительной плотности.
3. Определяя относительную плотность, неизменно рассматривайте температуру исследуемого и эталонного вещества. Дело в том, что плотность веществ уменьшается при нагревании и возрастает при охлаждении. Если температура исследуемого вещества отличается от температуры стандарта, внесите поправку. Ее вычислите как среднее метаморфоза относительной плотности на 1оС. Необходимые данные ищите по номограммам температурных поправок.
4. Для стремительного вычисления относительной плотности жидкостей на практике используйте ареометр. Для измерения относительной плотности газов и сухих веществ используйте пикнометры и особые весы. Типичный ареометр представляет собой стеклянную трубку, расширяющуюся в нижней части. На нижнем конце трубки имеется резервуар с дробью либо особым веществом. На верхней части трубки нанесены деления, показывающие числовое значение относительной плотности исследуемого вещества. Многие ареометры добавочно оснащают термометрами для измерений температуры исследуемого вещества.
5. Погрузите ареометр в исследуемую жидкость либо раствор. Чем ниже будет относительная плотность исследуемой жидкости, тем глубже в нее погрузится ареометр под действием его собственного веса. Следственно при проведении измерений прибор не следует придерживать рукой. Дождавшись, когда поверхность вещества утихомирится и ареометр застынет, по делениям шкалы узнайте относительную плотность исследуемой жидкости.
Видео по теме
Совет 6: Что такое относительная плотность
Расстояния между частицами газообразного вещества гораздо огромнее, чем в жидкостях либо твердых телах. Эти расстояния также мощно превышают и размеры самих молекул. Следственно объем газа определяется не размером его молекул, а пространством между ними.
Закон Авогадро
Отдаленность молекул газообразного вещества друг от друга зависит от внешних условий: давления и температуры. При идентичных внешних условиях интервалы между молекулами разных газов идентичны. Закон Авогадро, открытый в 1811 году, гласит: в равных объемах различных газов при идентичных внешних условиях (температуре и давлении) содержится идентичное число молекул. Т.е. если V1=V2, T1=T2 и P1=P2, то N1=N2, где V – объем, T – температура, P – давление, N – число молекул газа (индекс «1» у одного газа, «2» – у иного).
Первое следствие из закона Авогадро, молярный объем
В первом следствии из закона Авогадро утверждается, что идентичное число молекул всяких газов при одних и тех же условиях занимает идентичный объем: V1=V2 при N1=N2, T1=T2 и P1=P2. Объем одного моля каждого газа (молярный объем) – непрерывная величина. Напомним, что в 1 моле содержится Авогадрово число частиц – 6,02х10^23 молекул.Таким образом, молярный объем газа зависит только от давления и температуры. Традиционно рассматривают газы при типичном давлении и типичной температуре: 273 К (0 градусов Цельсия) и 1 атм (760 мм рт. ст., 101325 Па). При таких типичных условиях, обозначаемых «н.у.», молярный объем всякого газа равен 22,4 л/моль. Зная эту величину, дозволено рассчитать объем всякий заданной массы и всякого заданного числа газа.
Второе следствие из закона Авогадро, относительные плотности газов
Для расчета относительных плотностей газов используется второе следствие из закона Авогадро. По определению, плотность вещества – это отношение его массы к его объему: ?=m/V. Для 1 моля вещества масса равна молярной массе M, а объем – молярному объему V(M). Отсель плотность газа составляет ?=M(газа)/V(M).Пускай имеются два газа – X и Y. Их плотности и молярные массы – ?(X), ?(Y), M(X), M(Y), связанные между собой соотношениями: ?(X)=M(X)/V(M), ?(Y)=M(Y)/V(M). Относительной плотностью газа X по газу Y, обозначаемой как Dy(X) именуется отношение плотностей этих газов ?(X)/?(Y): Dy(X)=?(X)/?(Y)=M(X)xV(M)/V(M)xM(Y)=M(X)/M(Y). Молярные объемы сокращаются, и из этого дозволено сделать итог, что относительная плотность газа X по газу Y равна отношению их молярных либо относительных молекулярных масс (численно они равны).Плотности газов часто определяют по отношению к водороду, самому легкому из всех газов, молярная масса которого – 2 г/моль. Т.е. если в задаче сказано, что неведомый газ X имеет плотность по водороду, скажем, 15 (относительная плотность – безразмерная величина!), то обнаружить его молярную массу не составит труда: M(X)=15xM(H2)=15×2=30 г/моль. Зачастую указывают также относительную плотность газа по воздуху. Тут нужно знать, что средняя относительная молекулярная масса воздуха равна 29, и умножать теснее нужно не на 2, а на 29.