Ответы на билеты по химии
БИЛЕТ 1.
1. Периодический закон и периодическая система химических элементов д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В
1869 г. Д.
И. Менделеев на основе анализа свойств
простых веществ и соединений сформулировал
Периодический закон:
Свойства
простых тел… и соединений элементов
находятся в периодической зависимости
от величины атомных масс элементов.
На основе
периодического закона была составлена
периодическая система элементов. В ней
элементы со сходными свойствами оказались
объединены в вертикальные столбцы
— группы.
В некоторых случаях при размещении
элементов в Периодической системе
приходилось нарушать последовательность
возрастания атомных масс, чтобы
соблюдалась периодичность повторения
свойств. Например, пришлось “поменять
местами” теллур и йод, а также аргон
и калий.
Причина состоит
в том, что Менделеев предложил периодической
закон в то время, когда не было ничего
известно о строении атома.
После того, как
в
XX веке
была предложена планетарная модель
атома, периодический закон формулируется
следующим образом:
Свойства
химических элементов и соединений
находятся в периодической зависимости
от зарядов атомных ядер.
Заряд
ядра равен номеру элемента в периодической
системе и числу электронов в электронной
оболочке атома.
Эта формулировка
объяснила “нарушения” Периодического
закона.
В Периодической
системе номер периода равен числу
электронных уровней в атоме, номер
группы для элементов главных подгрупп
равен числу электронов на внешнем
уровне.
Причиной
периодического изменения свойств
химических элементов является
периодическое заполнение электронных
оболочек. После заполнения очередной
оболочки начинается новый период.
Периодическое изменение элементов ярко
видно на изменении состава и свойств и
свойств оксидов.
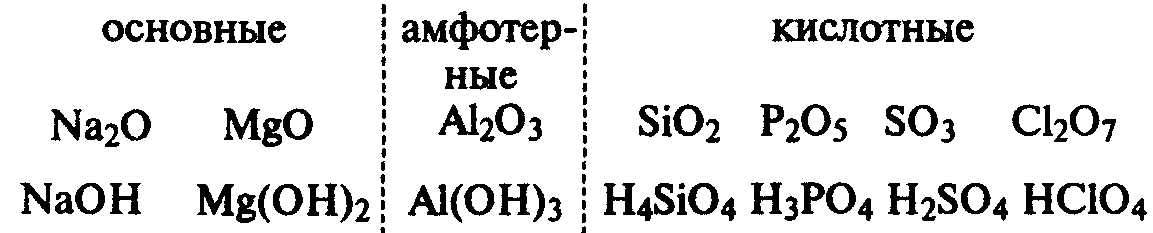
Научное значение
периодического закона. Периодический
закон позволил систематизировать
свойства химических элементов и их
соединений. При составлении периодической
системы Менделеев предсказал существование
многих еще не открытых элементов, оставив
для них свободные ячейки, и предсказал
многие свойства неоткрытых элементов,
что облегчило их открытие.
2. Предельные углеводороды
Алканами называются
предельные (насыщенные) углеводороды,
содержащие только простые связи С-С.
Общая формула алканов
– СnН2n+2.
Названия простейших алканов сложились
исторически, для остальных
– производятся
от греческих числительных добавлением
суффикса
–
ан.
|
СН4 |
метан |
С5Н10 |
пентан |
С9Н20 |
нонан |
|
С2Н6 |
этан |
С6Н12 |
гексан |
С10Н22 |
декан |
|
С3Н8 |
пропан |
С7Н16 |
гептан |
С11Н24 |
ундекан |
|
С4Н10 |
бутан |
С8Н18 |
октан |
С12Н26 |
додекан |
Алканы с числом
атомов углерода больше четырех имеют
скелетные изомеры. Разветвленные
предельные углеводороды рассматривают
как алканы, в которых некоторые атомы
водорода заменены на радикалы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Билет №1 (3)
Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
|
Дано: |
Решение: |
|
Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% |
Mвозд = 29 г/моль M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г ν(C) : ν(H) = M(C4H10) = 48 + 10 = 58 г/моль |
|
CxHy – ? |
Ответ: С4Н10 |
Билет №2 (3)
Осуществить превращения:
Натрий → гидроксид натрия → карбонат натрия → хлорид натрия → нитрат натрия
Na NaOH
Na2CO3
NaCl
NaNO3
0 +1 -2 +1 -2 +1 0
- 2Na + 2H2O → 2NaOH + H2↑
в-ль ок-ль
Na0 – 1e– → Na+1 | 2
2H+1 + 2e– → H2 | 1
- 2NaOH + CO2 → Na2CO3 + H2O
2Na+ + 2OH– + CO2 → 2Na+ + CO32– + H2O
2OH– + CO2 → CO32– + H2O
- Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32– + 2H+ + 2Cl– → 2Na+ + 2Cl– + CO2↑ + H2O
CO32– + 2H+ → CO2↑ + H2O
- NaCl + AgNO3 → NaNO3 + AgCl↓
Na+ + Cl– + Ag+ + NO3– → Na+ + NO3– + AgCl↓
Cl– + Ag+ → AgCl↓
Билет №3 (3)
Какой объём хлора прореагирует с натрием массой 34,5г. Определить массу хлорида натрия.
|
Дано: |
Решение: |
|
m(Na) = 34,5г |
34,5 г x л y л 2Na + Cl2 → 2NaCl 2 моль 1 моль 2 моль 46 г 22,4 л 117 г m = M ∙ ν V = Vm ∙ ν M(Na) = 23 г/моль M(NaCl) = 58,5 г/моль m(Na) = 23 г/моль ∙ 2 моль = 46 г m(NaCl) = 58,5 г/моль ∙ 2 моль = 117 г Vm = 22,4 л/моль V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(Cl2) – ? m(NaCl) – ? |
Ответ: V(Cl2) = 16,8 л; m(NaCl) = 87,8 г |
Билет №4 (3)
Осуществить превращения:
Магний → хлорид магния → гидроксид магния → оксид магния → сульфат магния
Mg MgCl2
Mg(OH)2
MgO
MgSO4
0 +1 -1 +2 -1 0
- Mg + 2HCl
MgCl2 + H2↑
в-ль ок-ль
Mg0 – 2e– → Mg+2 | 1
2H+ + 2e– → H20 | 1
- MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg2+ + 2Cl– + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + 2Cl–
Mg2+ + 2OH– → Mg(OH)2↓
- Mg(OH)2
MgO + H2O
- MgO + H2SO4 → MgSO4 + H2O
MgO + 2H+ + SO42– → Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №5 (3)
Какой объём хлора прореагирует с железом массой 400г, если массовая доля примесей в нём 20%?
|
Дано: |
Решение: |
|
mобр(Fe) = 400 г ωприм = 20% |
320 г x л 2Fe + 3Cl2 → 2FeCl3 2 моль 3 моль 112 г 67,2 л mприм = 0,2 ∙ 400 г = 80 г m(Fe) = mобр – mприм = 400 г – 80 г = 320 г M(Fe) = 56 г/моль; m(Fe) = 56 г/моль ∙ 2 моль = 112 г Vm = 22,4 л/моль V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л |
|
V(Cl2) – ? |
Ответ: V(Cl2) = 192 л |
Билет №6 (3)
Осуществить превращения:
Медь → хлорид меди (II) → гидроксид меди (II) → оксид меди (II) → медь
Cu CuCl2
Cu(OH)2
CuO
Cu
0 0 +2 –1
- Cu + Cl2 → CuCl2
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 1
Cl2 + 2e– → 2Cl– | 1
- CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + 2Cl–
Cu2+ + 2OH– → Cu(OH)2↓
- Cu(OH)2
CuO + H2O
+2 –2 0 t 0 +1 –2
- CuO + H2
Cu + H2O
ок-ль в-ль
Cu+2 + 2e– → Cu0 | 1
H20 – 2e– → 2H+1 | 1
Билет №7 (3)
При прокаливании 300 г известняка, содержащего 10% примесей, получено 75 г негашеной извести. Найти массовую долю выхода продукта реакции от теоретически возможного.
|
Дано: |
Решение: |
|
mобр(CaCO3) = 300г ωприм = 10% mпракт(CaO) = 75г |
270 г x г CaCO3 1 моль 1 моль 100 г 56 г mприм = 300 г ∙ 0,1 = 30 г m(CaCO3) = 300 г – 30 г = 270 г
= 49,6% |
|
η(CaO) – ? |
Ответ: η(CaO) = 49,6 % |
Билет №8 (3)
Какова масса соли, получившейся в результате взаимодействия 100 г соляной кислоты с 14 г оксида кальция?
|
Дано: |
Решение: |
|
m(HCl) = 100 г m(CaO) = 14 г |
0,25 моль х моль CaO + 2HCl → CaCl2 + H2O 1 моль 2 моль 1 моль m = M ∙ ν M(CaCl2) = 40 + 71 = 111 г/моль m(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г |
|
m(CaCl2) – ? |
Ответ: m(CaCl2) = 27,8 г |
Билет №9 (3)
Какой объём ацетилена необходимо сжечь для получения 24 л оксида углерода (IV)?
|
Дано: |
Решение: |
|
V(CO2) = 24 л |
x л 24 л 2C2H2 + 5O2 → 4CO2 + 2H2O 2V 4V |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 12 л |
Билет №10 (3)
Осуществить превращения:
Гидроксид меди (II) → сульфат меди (II) → медь →
→ оксид меди (II) → нитрат меди (II)
CuO CuSO4
Cu
CuO
Cu(NO3)2
- CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42– + H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
- CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
- 2Cu + O2 → 2CuO
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
- CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
|
Дано: |
Решение: |
|
mобр(CaC2) = 100 г ωприм = 15% |
85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2
Fe(OH)2
FeSO4
FeCl2
0 +1 –1 +2 –1 0
- Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
- FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
- Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
- FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
|
Дано: |
Решение: |
|
m(CH3COOH) = 120 г m(NaOH) = 60 г |
1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль
M(CH3COOH) = 60 г/моль M(NaOH) = 40 г/моль
m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
|
m(CH3COONa) – ? |
Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
|
Дано: |
Решение: |
|
m(CaC2) = 38,4 г |
38,4 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
|
Дано: |
Решение: |
|
m (HCl) = 73 г ω(NaOH) = 4% |
2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г |
|
mр-ра(NaOH) – ? |
Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу вещества, содержащего 80% углерода и 20% водорода, если плотность по водороду равна 15.
|
Дано: |
Решение: |
|
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% |
M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г ν(C) : ν(H) = M(C2H6) = 24 + 6 = 30 г/моль |
|
CxHy – ? |
Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4 CH3Cl
C2H6
C2H4
C2H5OH
- CH4 + Cl2
CH3Cl + HCl
- 2CH3Cl + 2Na
CH3–CH3 + 2NaCl
- CH3–CH3
CH2=CH2 + H2
- CH2=CH2 + H2O
CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2 CH3–CH3
CH3CH2Cl
CH3CH2OH
CH2=CH2
- CH2=CH2 + H2
CH3–CH3
- CH3–CH3 + Cl2
CH3CH2Cl + HCl
- CH3CH2Cl + KOH(водный р-р) → CH3CH2OH + KCl
- CH3CH2OH
CH2=CH2 + H2O
19. Оксид кальция, полученный при прокаливании 20г карбоната кальция, обработали водой. Вычислите массу полученного продукта.
Дано: 20 г t X г
CaCO3 → CaO + CO2
m(CaCO3) = 20г 1 моль 1 моль
100г 56г
m(Ca(OH)2) – ?
x = 20 г * 56 г = 11,2г
100г
11,2г Yг
CaO + H2O → Ca(OH)2
1 моль 1 моль
56г 84г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
20. Относительная плотность паров органического соединения по водороду равна 71. При сжигании 2,84г этого вещества образуется 4,48л углекислого газа и 3,96г воды. Выведите молекулярную формулу этого соединения.
Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г
CxHy – ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л
C CO2 x = 12г * 4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г
2Н Н2О y = 2г * 36г =0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г
V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22)=120+22=142 г/моль
Ответ: C10H22
Ученик
(111),
на голосовании
6 лет назад
Дополнен 6 лет назад
Билет № 13
1. Основания (определение, примеры, классификация). Химические свойства щелочей: взаимодействие с кислотами, кислотными оксидами, солями (на примере гидроксида натрия)
2. Задача. Какова масса осадка, образующегося при сливании раствора сульфата меди (II) с раствором содержащим 24г гидроксида натрия
Билет № 14
1. Водород: положение этого химического элемента в периодической системе, строение его атома и молекулы. Физические и химические свойства водорода, получение и применение.
2. Определить классы неорганических веществ, укажите классификацию внутри класса, назовите вещество.
N2O5, CaCl2, Fe(OH)2, Li2O, NaOH, HPO3, Mg(NO3)2, Zn3(PO4)2, BaO, NaHSO4, ZnO, K2O, Na3PO4, FeO, HBr, H2SiO3, Al2(SO3)3, Mn2O7.
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксидам кальция, оксиду cepы (IV). Основные загрязнители природной воды.
2. Опыт. Получение реакций обмена нерастворимого основания (гидроксида меди (II)) и про¬ведение реакций, характеризующих его свойства.
Билет № 16
1. Физические и химические явления, признаки. Уравнения химических реакций
2. Определить классы неорганических веществ, укажите классификацию внутри класса, назовите вещество. HI, K2SiO3, MgO, CaBr2, CrO3, LiOH, Cu(OH)2, Cu(OH)2 ZnCl2, Na2SO3, H3PO4, Na2O, HNO3, SO3, H2S, FeS, Ba3(PO4)2, Al(NO3)3, Li2SO4.
Билет № 17
1.Оксиды: их классификация и химические свойства (взаимодействие с водой, кислотами и щелочами).
2. Задача. Магний массой 12г вступил в реакцию с раствором серной кислоты. Вычисление объем выделившегося водорода.
Билет № 18
1.Чистые вещества и смеси. Основные способы разделения смесей.
2.Что обозначает запись? (какое вещество простое или сложное, сколько частиц-атомов и молекул) О2 ;3О; 5О2 SO2 ;2H2O;O;Fe;
Дополнен 6 лет назад
Билет № 18
1.Чистые вещества и смеси. Основные способы разделения смесей.
2.Что обозначает запись? (какое вещество простое или сложное, сколько частиц-атомов и молекул) О2 ;3О; 5О2 SO2 ;2H2O;O;Fe;5H2;2Na3PO4
Билет № 19
1. Соли, их классификация, химические свойства (взаимодействие с кислотами, щелочами, солями, металлами.
2. Задача. К 200г раствора хлорида калия с массовой долей 15% добавили 100г воды. Определите массовую долю хлорида калия в полученном растворе.
Билет № 20
1. Атомно-молекулярное учение.
2. Задача. На гидроксид кальция подействовали 3,15г чистой азотной кислотой. Какая масса гидроксида кальция была израсходована.
Билет № 21
1. Соляная кислота, получение, ее химические свойства (взаимодействие с металлами, оксидами металлов, основаниями и солями).
2. Что обозначает запись. (какое вещество простое или сложное, сколько частиц-атомов и молекул) 6Mg;K2O;S8;3O2;O;5O;O2 ; 3H2SO4.
Билет № 22
1. Закон сохранения массы веществ. Химические уравнения.
1. Опыт. Осуществление превращения соль -» нерастворимое основа¬ние -> оксид металла. CuSO4 –» Cu(OH)2 –» Cuo
Билет № 23
1. Кислород: положение этого химического элемента в периодической системе, строение его атома и молекулы. Физические и химические свойства кислорода, получение и применение.
2. Задача. Вычислите, сколько (по массе) соли и воды необходимо для приготовления 125 г 20% раствора соли.
Билет № 24
1. Воздух его состав, горение простых и сложных веществ на воздухе.
2. Задача. В 550 г воды растворили 30 г хлорида натрия. Вычислите массовую долю хлорида натрия в полученном растворе.
Билет № 25
1. Классификация химических элементов. Понятие о группах сходных химических элементов. 2. Задача. Какая масса оксид
Дополнен 6 лет назад
Билет № 25
1. Классификация химических элементов. Понятие о группах сходных химических элементов. 2. Задача. Какая масса оксида ртути (II) потребуется для получения 12, 8 грамм кислорода?
Дополнен 6 лет назад
КТО ПОМОЖЕТ ЗАЧИСЛЮ НА ТЕЛЕФОН ДЕНЬГИ!!!!
Голосование за лучший ответ
Виолетта Валеева
Ученик
(111)
5 лет назад
Билет № 1
1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона. Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются. * Сравните: периодичность смены времен года с течением времени. Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе – это не просто очередность, он имеет физический смысл – равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период – это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор – неметалл, и т. д. В конце фтор – галоген и неон – инертный газ.
(Третий период снова начинается щелочным металлом – это и есть периодичность)
1-3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4-7 – большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы – I А, галогены – VII A, инертные газы – VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б – под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
* точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»
2. Опыт. Проведение реакций, подтверждающих химические свойства хлороводородной кислоты.
Хлороводородная кислота:
1.Окрашивает растворы индикаторов лакмуса и метилового оранжевого в красный цвет, вследствие диссоциации в водном растворе: HCl → H+ + Cl-
2.Взаимодействует с металлами, находящимися в ряду напряжений левее водорода, например, с цинком, с образованием соли и газообразного водорода: Zn + 2HCl = ZnCl2 + H2↑
3.Взаимодействует с оснóвными оксидами с образованием соли и воды: CuO + 2HCl = CuCl2 + H2O (при проведении реакции с оксидом меди (II), пробирку желательно слегка подогреть)
4.
Узнай стоимость на индивидуальную работу!
Цены в 2-3 раза ниже
Мы работаем
7 дней в неделю
Только проверенные эксперты
Ответы на билеты по химии
Нет нужной работы в каталоге?
Сделайте индивидуальный заказ на нашем сервисе. Там эксперты помогают с учебой без посредников Разместите задание – сайт бесплатно отправит его исполнителя, и они предложат цены.
Цены ниже, чем в агентствах и у конкурентов
Вы работаете с экспертами напрямую. Поэтому стоимость работ приятно вас удивит
Бесплатные доработки и консультации
Исполнитель внесет нужные правки в работу по вашему требованию без доплат. Корректировки в максимально короткие сроки
Гарантируем возврат
Если работа вас не устроит – мы вернем 100% суммы заказа
Техподдержка 7 дней в неделю
Наши менеджеры всегда на связи и оперативно решат любую проблему
Строгий отбор экспертов
К работе допускаются только проверенные специалисты с высшим образованием. Проверяем диплом на оценки «хорошо» и «отлично»
1 000 +
Новых работ ежедневно

Требуются доработки?
Они включены в стоимость работы 
Работы выполняют эксперты в своём деле. Они ценят свою репутацию, поэтому результат выполненной работы гарантирован
Ludmila
Математика
Физика
История
124492
рейтинг
5601
работ сдано
2529
отзывов
Иванна
Экономика
Маркетинг
Информатика
120299
рейтинг
2842
работ сдано
1273
отзывов
81390
рейтинг
1909
работ сдано
1206
отзывов
Константин Николаевич
Высшая математика
Информатика
Геодезия
62710
рейтинг
1046
работ сдано
598
отзывов
Отзывы студентов о нашей работе
Алина
Скиптб филиал МГУТУ им. К.Г. Разумовского
Надежда выполнила работу максимально быстро, оценка отлично. Исполнителя рекомендую.
Алена
ОГИС
Спасибо огромное,Евгения! Отличная работа! Выполнена максимально быстро,очень качественно!…
Кристина
ГБПОУ КК КПК, ИМСИТ
Исполнитель выполнил свою работу досрочно и без какой лишней информации

Надежда выполнила работу максимально быстро, оценка отлично. Исполнителя рекомендую.
Алина
Скиптб филиал МГУТУ им. К.Г. Разумовского


Спасибо огромное,Евгения! Отличная работа! Выполнена максимально быстро,очень качественно!
Рекомендую данного исполнителя!!! Очень отзывчивая,грамотная и компитентная!


Исполнитель выполнил свою работу досрочно и без какой лишней информации
Кристина
ГБПОУ КК КПК, ИМСИТ

Последние размещённые задания
Ежедневно эксперты готовы работать над 1000 заданиями. Контролируйте процесс написания работы в режиме онлайн
Решить задачи
Решение задач, Бухгалтерский учет
Срок сдачи к 20 мая
итоговая
Контрольная, Физика
Срок сдачи к 19 мая
Контрольная
Контрольная, Патологическая физиология животных
Срок сдачи к 20 мая
Решение
Решение задач, Химия
Срок сдачи к 17 мая
Закажи индивидуальную работу за 1 минуту!
Размещенные на сайт контрольные, курсовые и иные категории работ (далее — Работы) и их содержимое предназначены исключительно для ознакомления, без целей коммерческого использования. Все права в отношении Работ и их содержимого принадлежат их законным правообладателям. Любое их использование возможно лишь с согласия законных правообладателей. Администрация сайта не несет ответственности за возможный вред и/или убытки, возникшие в связи с использованием Работ и их содержимого.
Ставлю 10/10
Все нравится, очень удобный сайт, помогает в учебе. Кроме этого, можно заработать самому, выставляя готовые учебные материалы на продажу здесь. Рейтинги и отзывы на преподавателей очень помогают сориентироваться в начале нового семестра. Спасибо за такую функцию. Ставлю максимальную оценку.
Отлично
Лучшая платформа для успешной сдачи сессии
Познакомился со СтудИзбой благодаря своему другу, очень нравится интерфейс, количество доступных файлов, цена, в общем, все прекрасно. Даже сам продаю какие-то свои работы.
Отлично
Студизба ван лав ❤
Очень офигенный сайт для студентов. Много полезных учебных материалов. Пользуюсь студизбой с октября 2021 года. Серьёзных нареканий нет. Хотелось бы, что бы ввели подписочную модель и сделали материалы дешевле 300 рублей в рамках подписки бесплатными.
Отлично
Отличный сайт
Лично меня всё устраивает – и покупка, и продажа; и цены, и возможность предпросмотра куска файла, и обилие бесплатных файлов (в подборках по авторам, читай, ВУЗам и факультетам). Есть определённые баги, но всё решаемо, да и администраторы реагируют в течение суток.
Отлично
Маленький отзыв о большом помощнике!
Студизба спасает в те моменты, когда сроки горят, а работ накопилось достаточно. Довольно удобный сайт с простой навигацией и огромным количеством материалов.
Хорошо
Студ. Изба как крупнейший сборник работ для студентов
Тут дофига бывает всего полезного. Печально, что бывают предметы по которым даже одного бесплатного решения нет, но это скорее вопрос к студентам. В остальном всё здорово.
Отлично
Спасательный островок
Если уже не успеваешь разобраться или застрял на каком-то задание поможет тебе быстро и недорого решить твою проблему.
Отлично
Всё и так отлично
Всё очень удобно. Особенно круто, что есть система бонусов и можно выводить остатки денег. Очень много качественных бесплатных файлов.
Отлично
Отзыв о системе “Студизба”
Отличная платформа для распространения работ, востребованных студентами. Хорошо налаженная и качественная работа сайта, огромная база заданий и аудитория.
Хорошо
Отличный помощник
Отличный сайт с кучей полезных файлов, позволяющий найти много методичек / учебников / отзывов о вузах и преподователях.
Отлично
Отлично помогает студентам в любой момент для решения трудных и незамедлительных задач
Хотелось бы больше конкретной информации о преподавателях. А так в принципе хороший сайт, всегда им пользуюсь и ни разу не было желания прекратить. Хороший сайт для помощи студентам, удобный и приятный интерфейс. Из недостатков можно выделить только отсутствия небольшого количества файлов.
Отлично
Спасибо за шикарный сайт
Великолепный сайт на котором студент за не большие деньги может найти помощь с дз, проектами курсовыми, лабораторными, а также узнать отзывы на преподавателей и бесплатно скачать пособия.
Отлично











