Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 марта 2023 года; проверки требует 1 правка.

Схема образования пептидной связи.
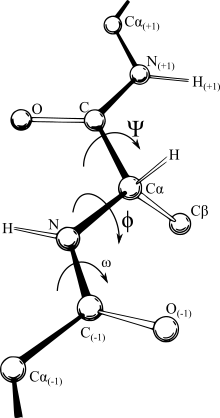
Основные двугранные углы φ и ψ (и ω). Все три угла находятся под углом 180° в показанной конфигурации.
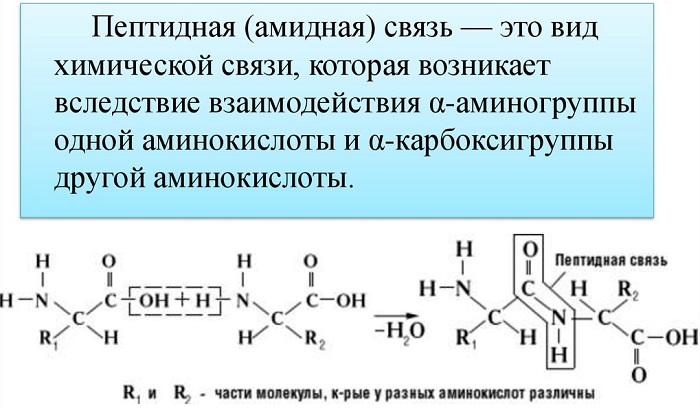
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
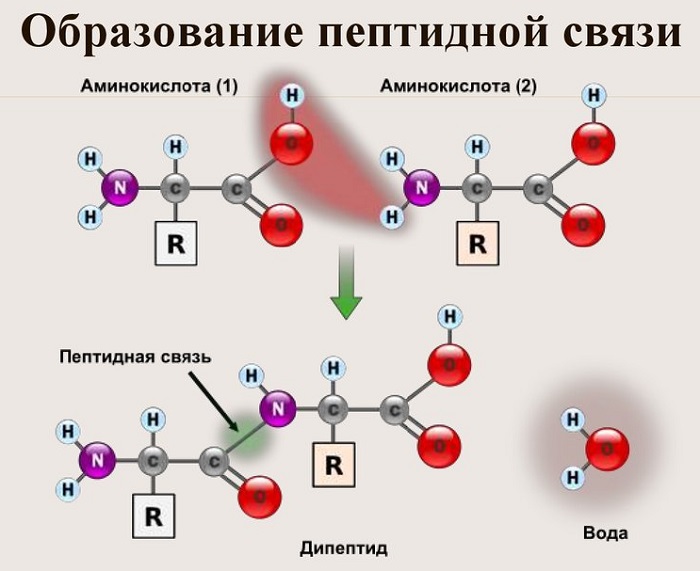
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи[править | править код]
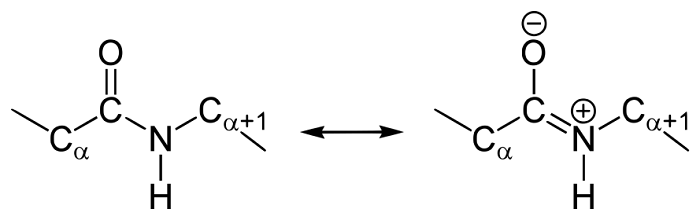
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
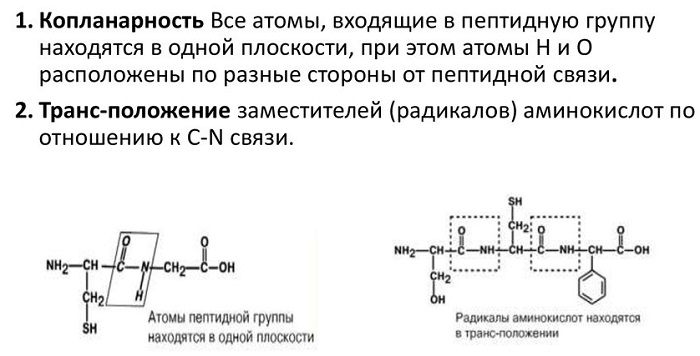
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
- В случае полипептида вращение возможно вокруг связи около азота (N-C, угол вращения обозначен как φ) или между углеродами каждого пептидного звена (C-C, угол вращения обозначен как ψ), но невозможно в месте соединения звеньев из-за их частично двойного характера связи.
Конформация полипептидов[править | править код]
Углы φ и ψ могут принимать различные значения, и число возможных пространственных конфигураций для полипептидной цепи может быть бесконечно большим. Однако в реальных условиях ряд конфигураций не реализуется из-за пространственных затруднений.
В пределах стерически дозволенных углов φ и ψ наиболее вероятна такая конфигурация пептидной цепи, при которой потенциальная энергия системы минимальна. Выигрыш потенциальной энергии происходит в результате целого ряда взаимодействий между атомами и атомными группами внутри полипептидной цепи (нековалентные взаимодействия, дипольные взаимодействия, торсионный потенциал).
Существует некоторое минимальное расстояние между центрами атомов, при котором их дальнейшее сближение невозможно. Эти расстояния, оценены в основном по данным кристаллографии[1].
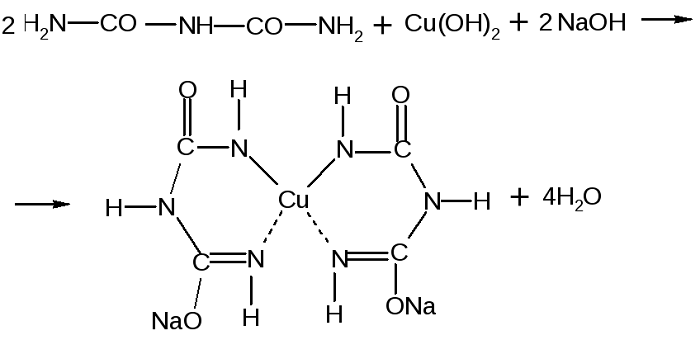
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Примечания[править | править код]
- ↑ Stereochemistry of polypeptide chain configurations (англ.) // Journal of Molecular Biology. — 1963-07-01. — Vol. 7, iss. 1. — P. 95–99. — ISSN 0022-2836. — doi:10.1016/S0022-2836(63)80023-6. Архивировано 13 августа 2021 года.
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами – строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Свойства:
-
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
-
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
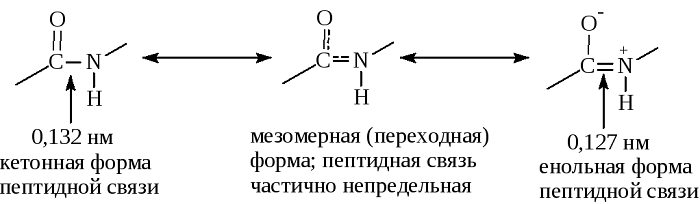
В результате этот вид существует в трех формах:
-
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
-
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
-
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В амидной группе -СО-NH- углеродный атом существует в форме sp2-гибридизации. Неподеленная пара электронов атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом.
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
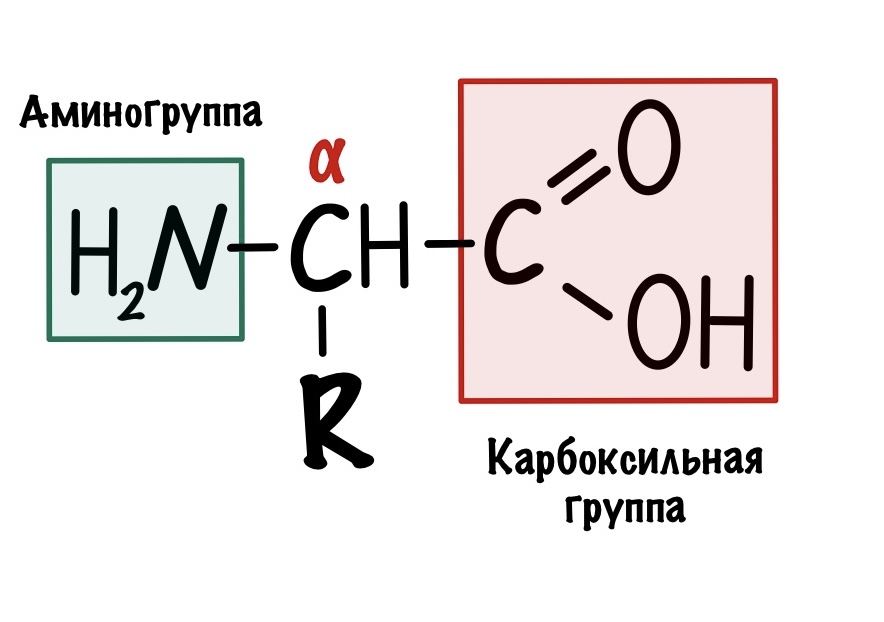
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
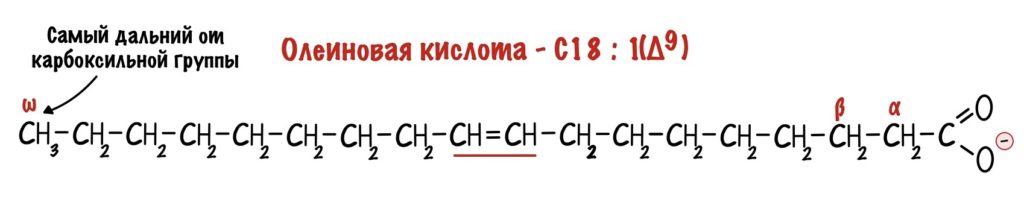
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
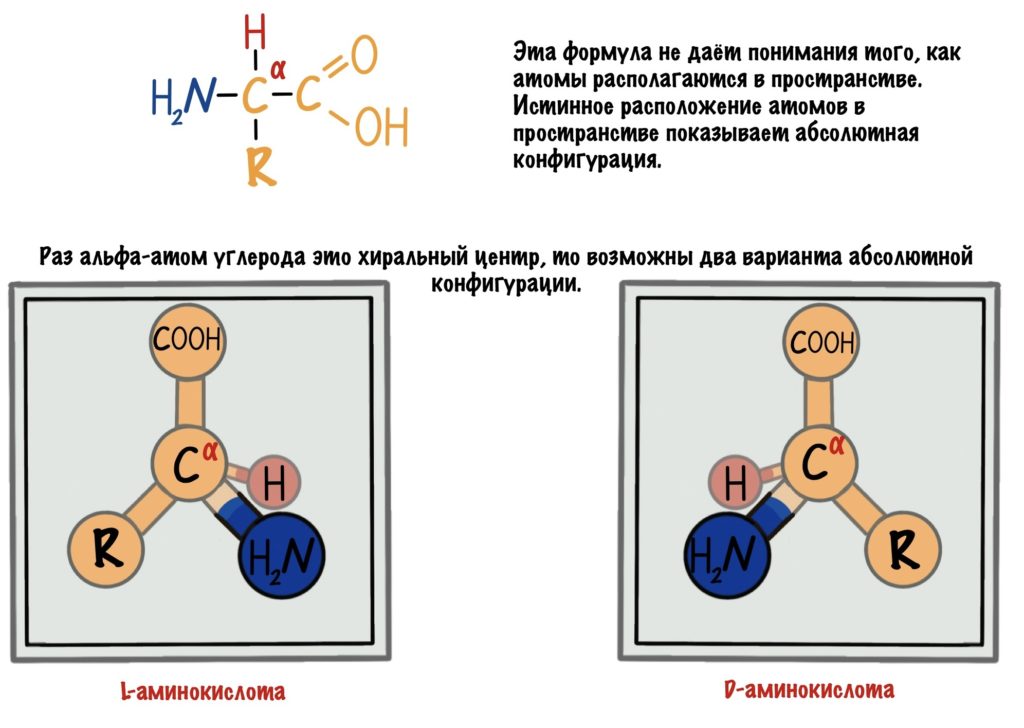
Живые организмы используют и синтезируют только L-аминокислоты.
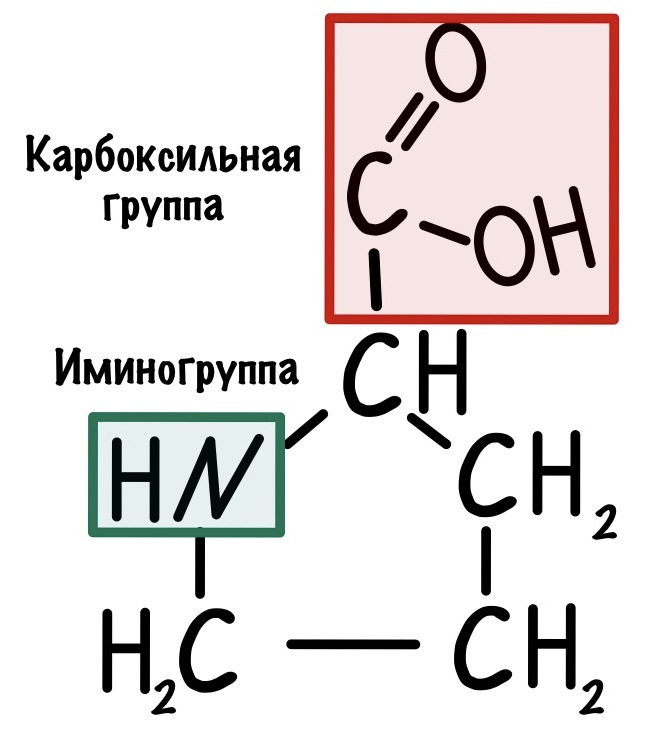
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
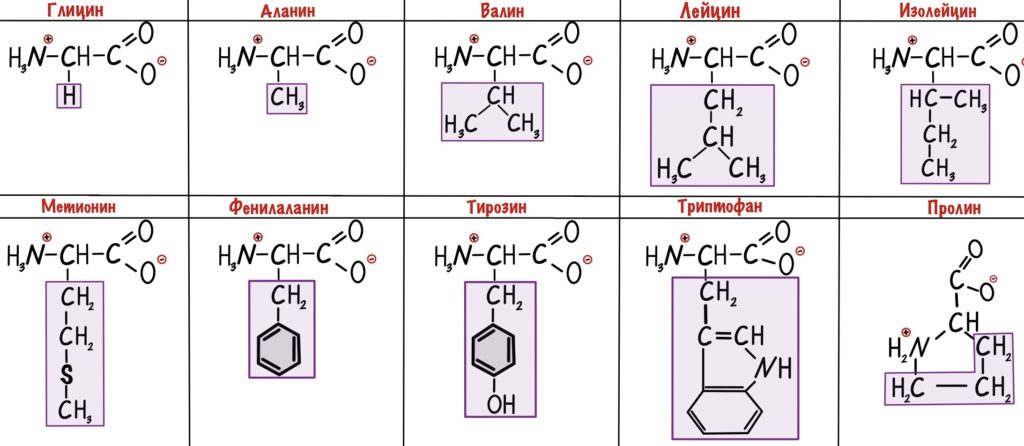
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
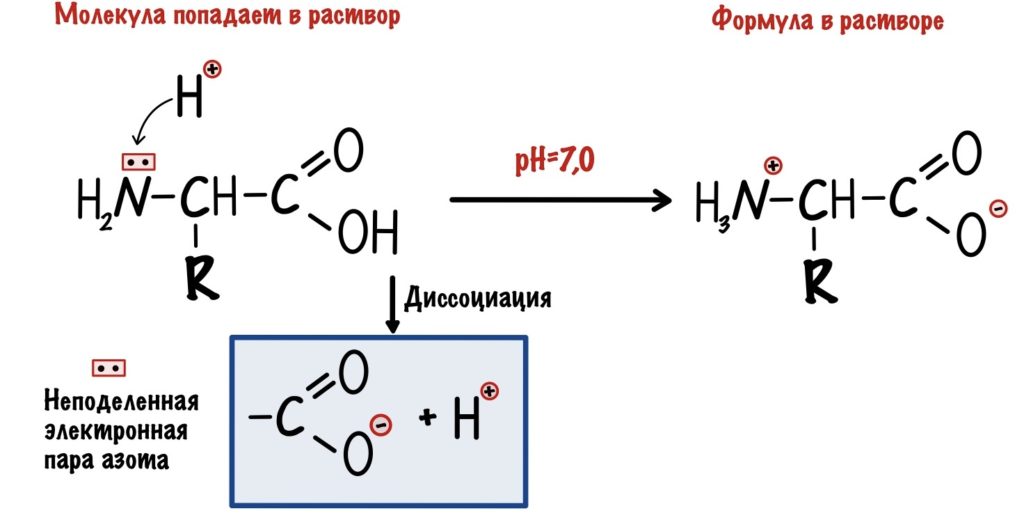
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
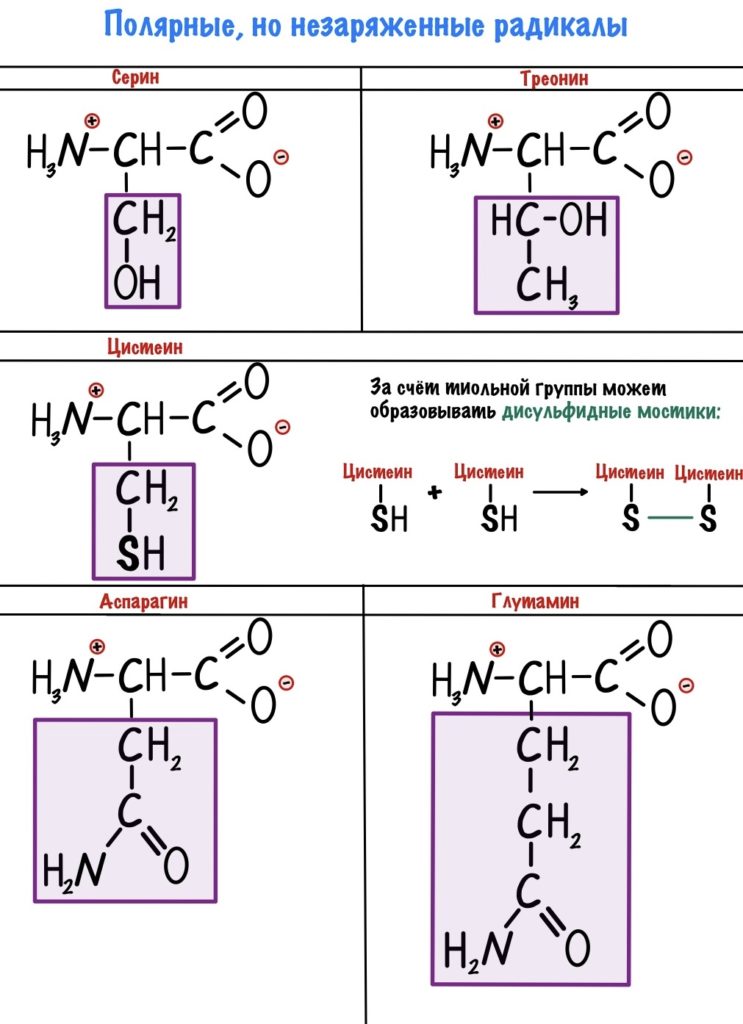
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
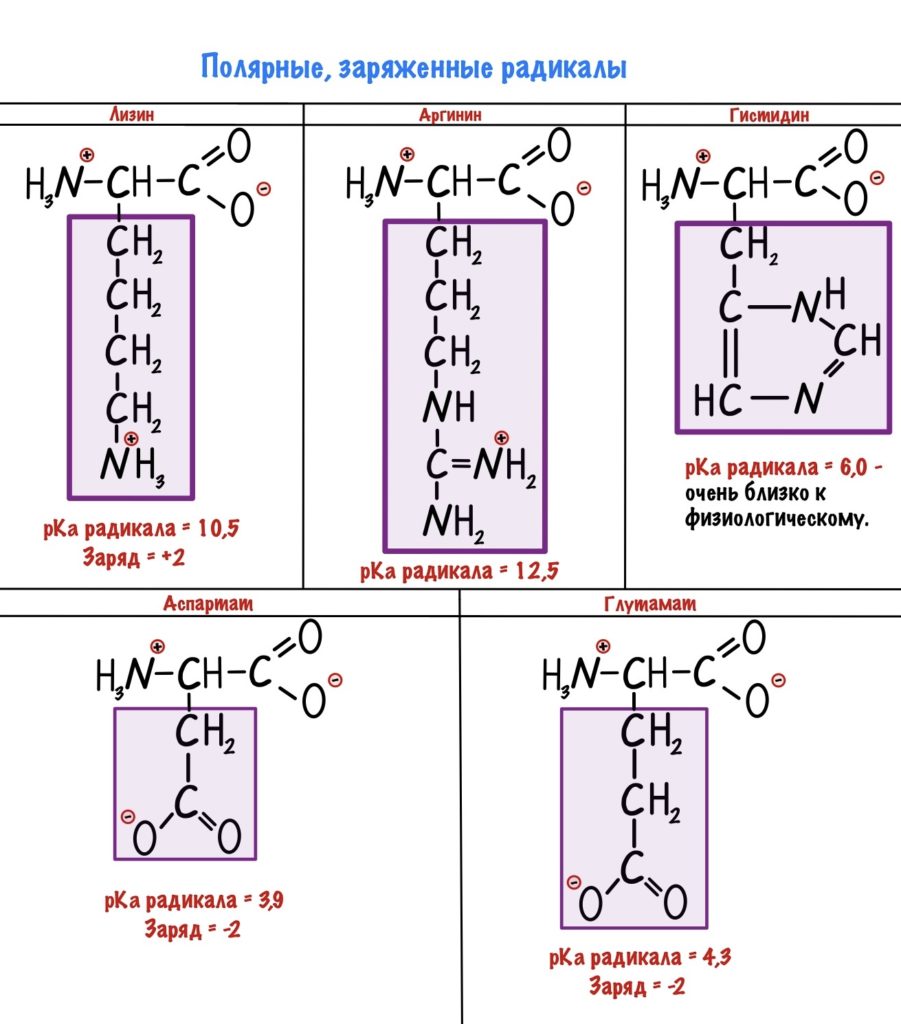
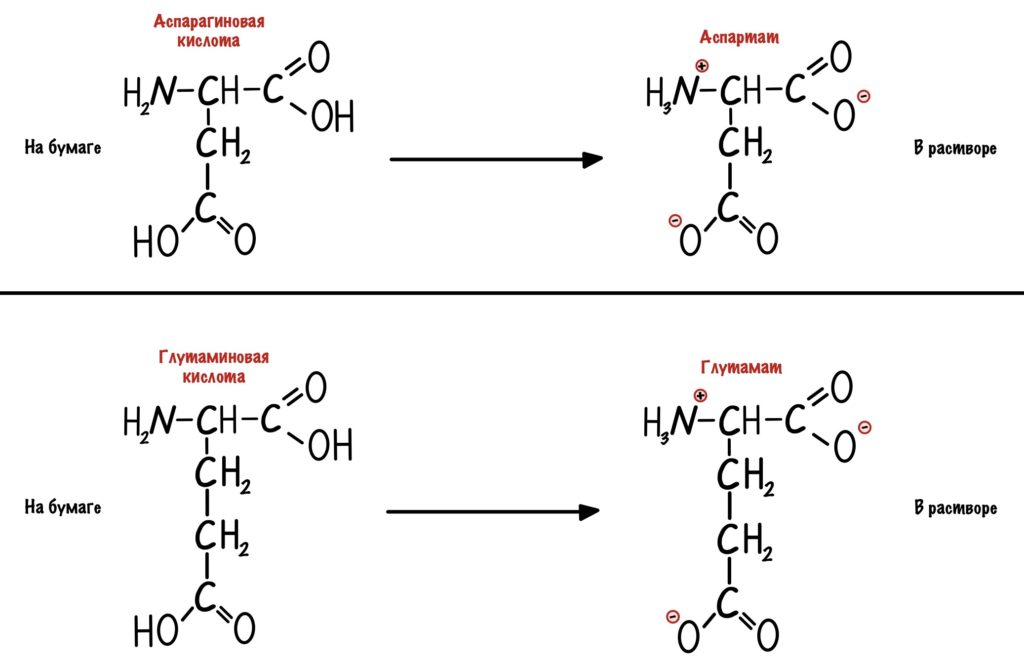
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
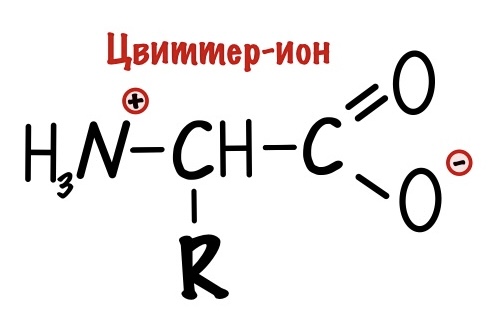
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
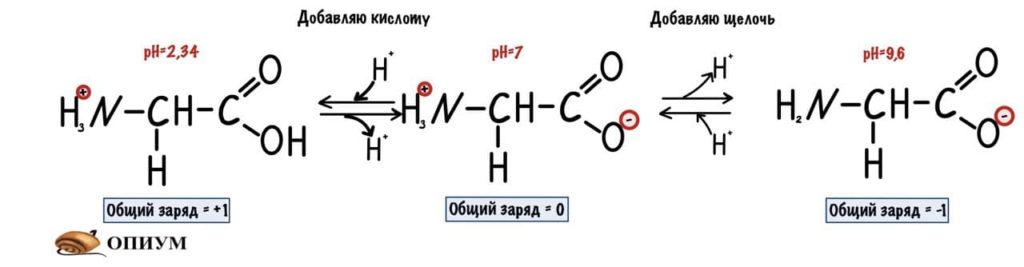
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
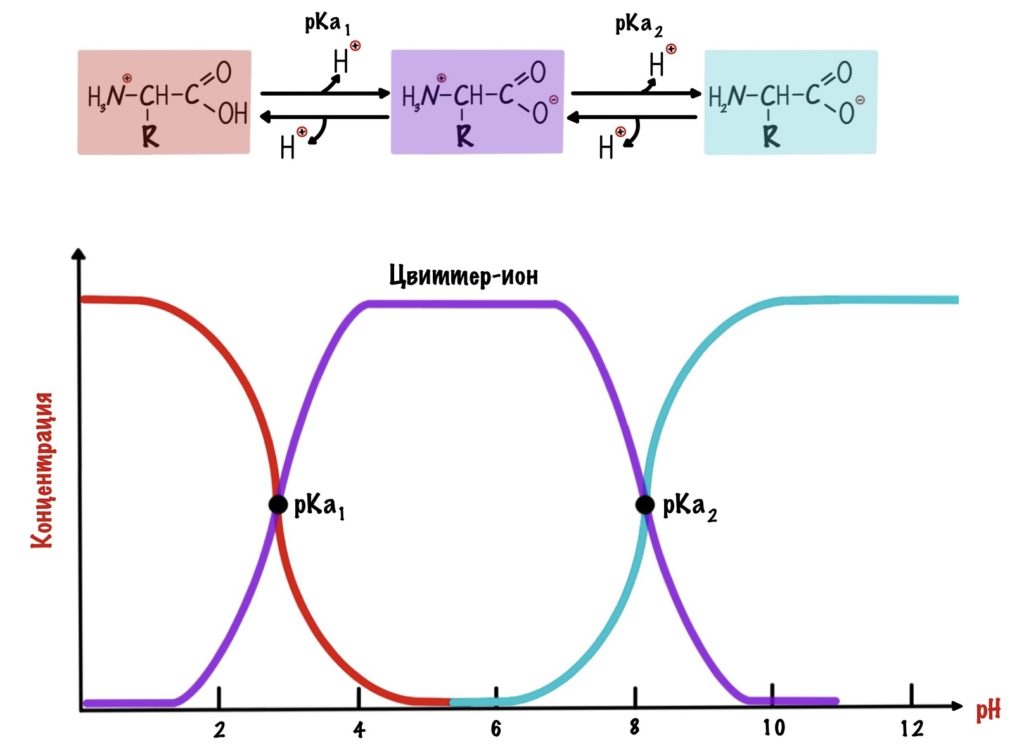
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
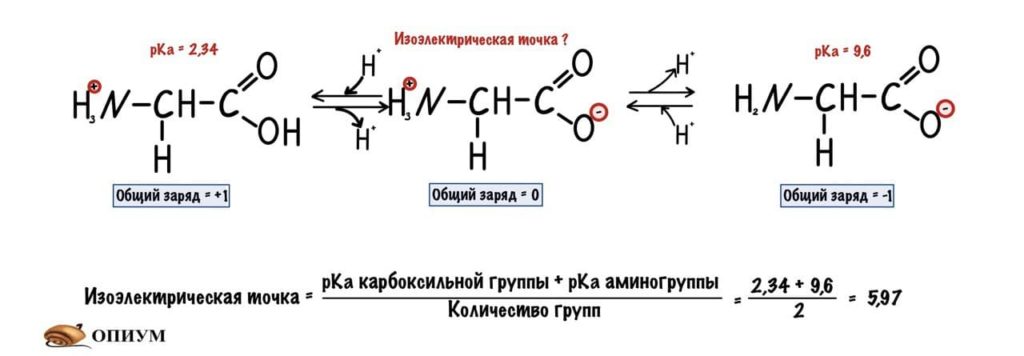
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
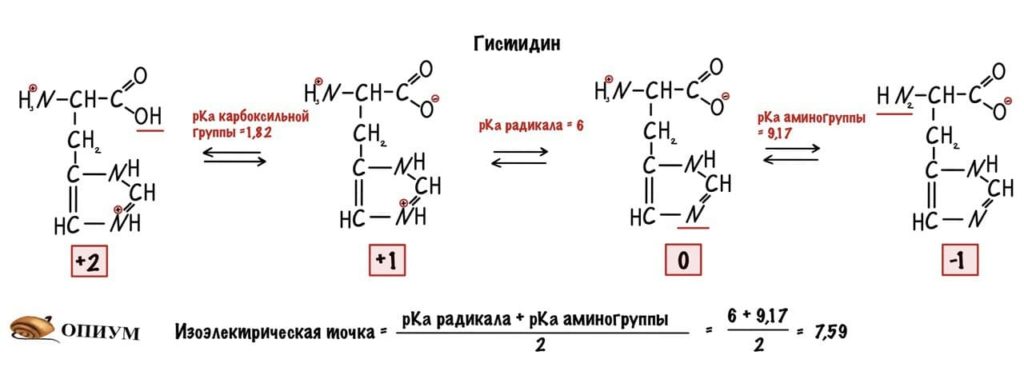
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
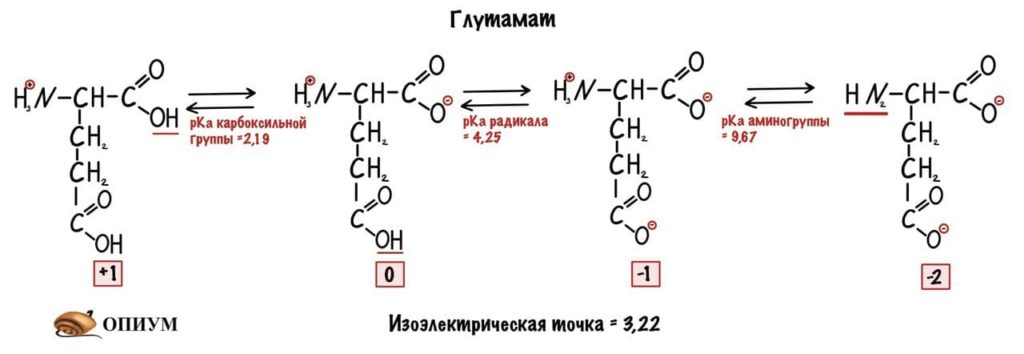
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
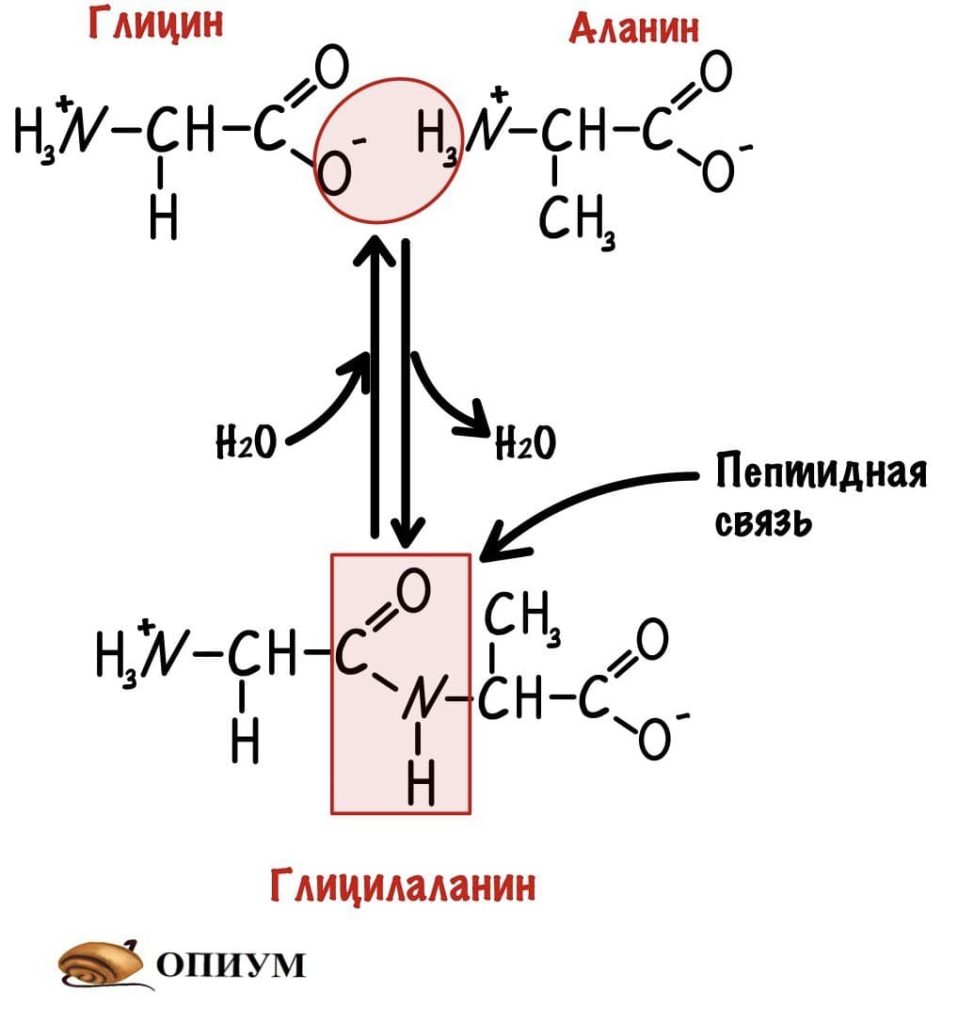
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
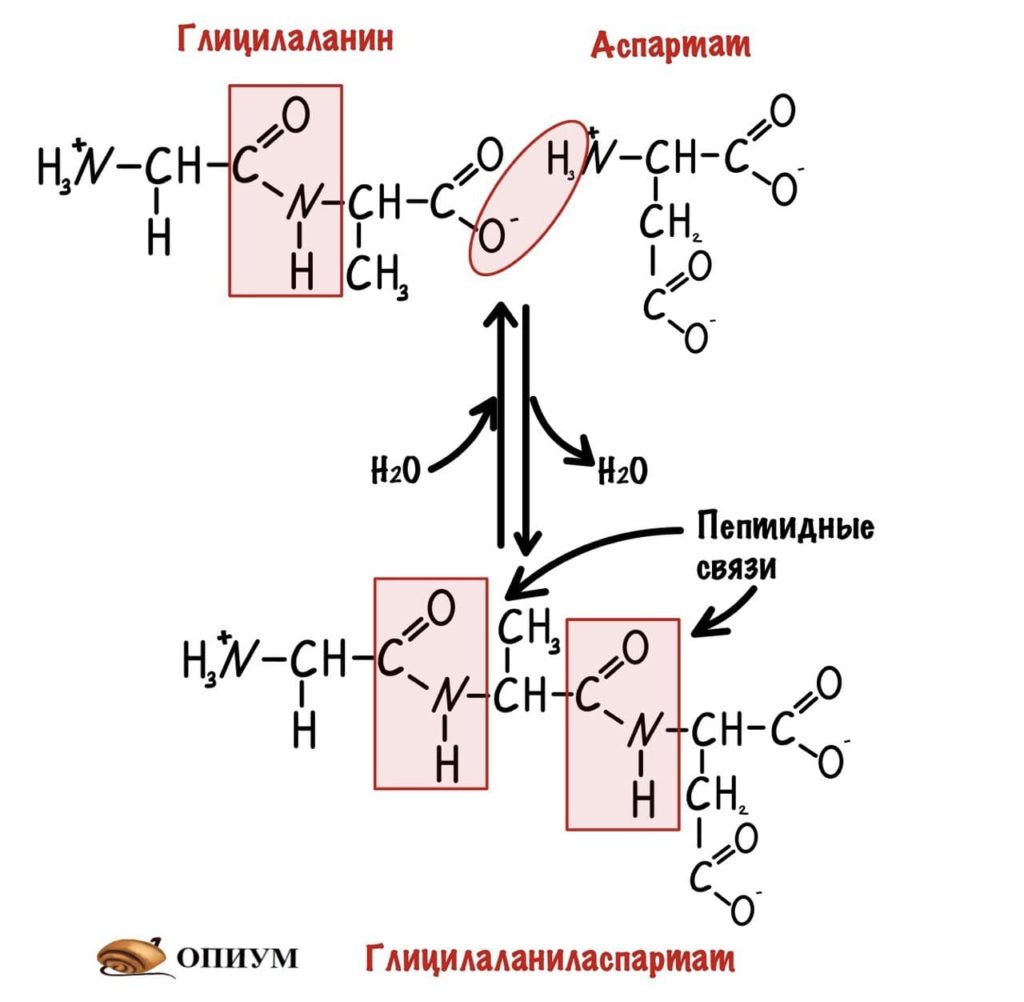
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
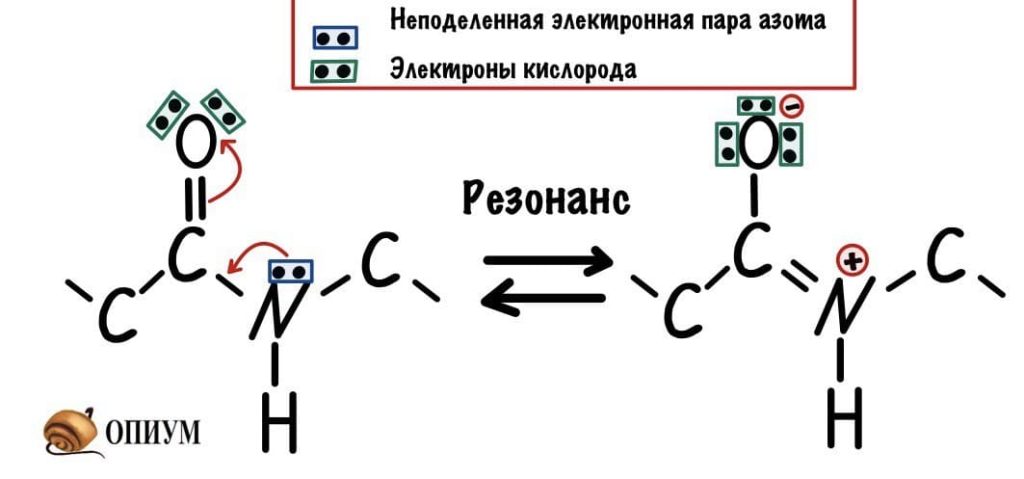
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
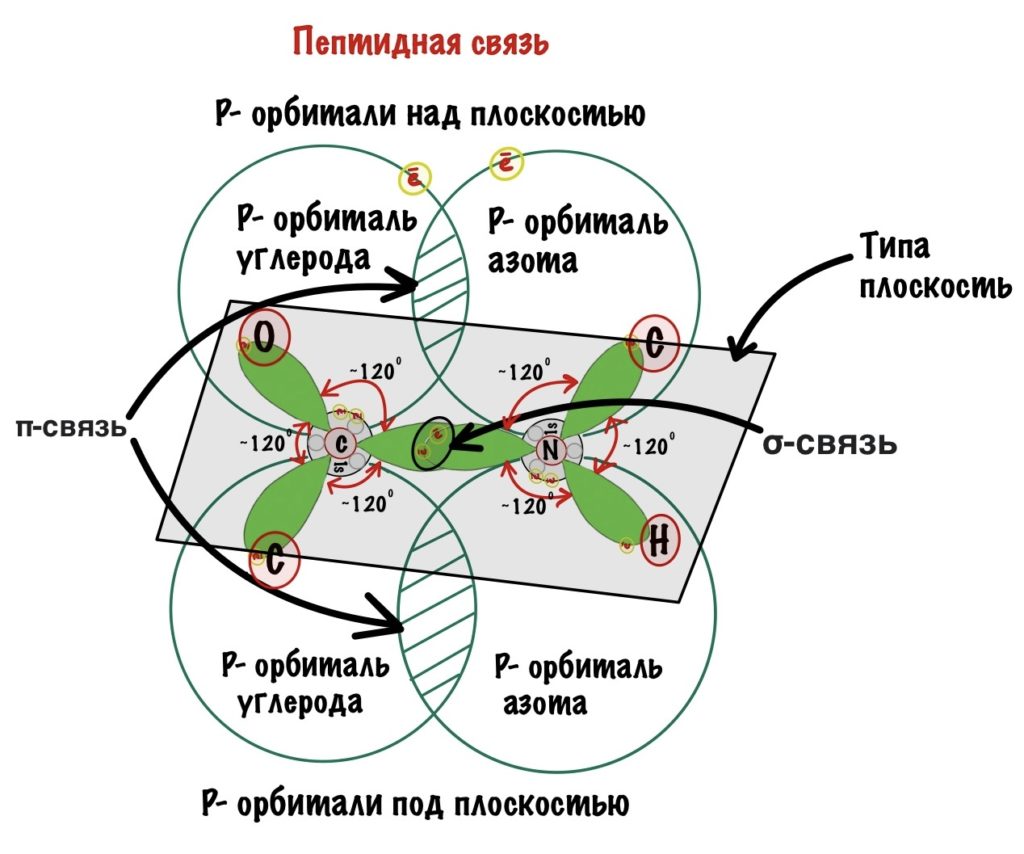
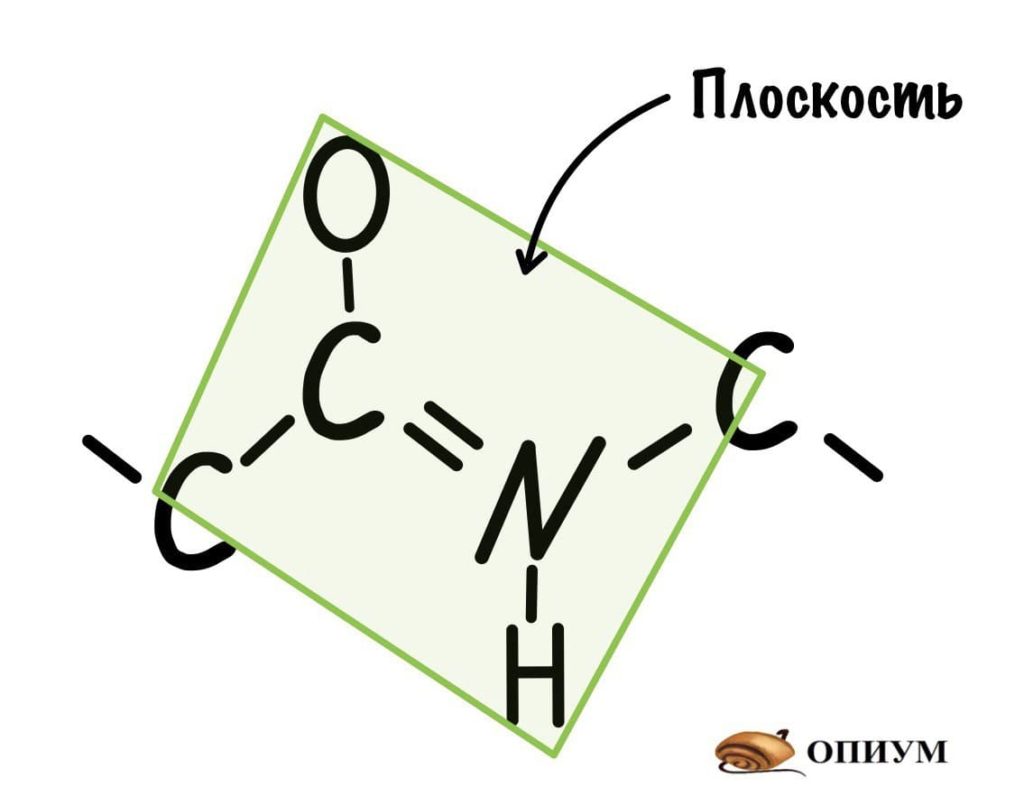
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
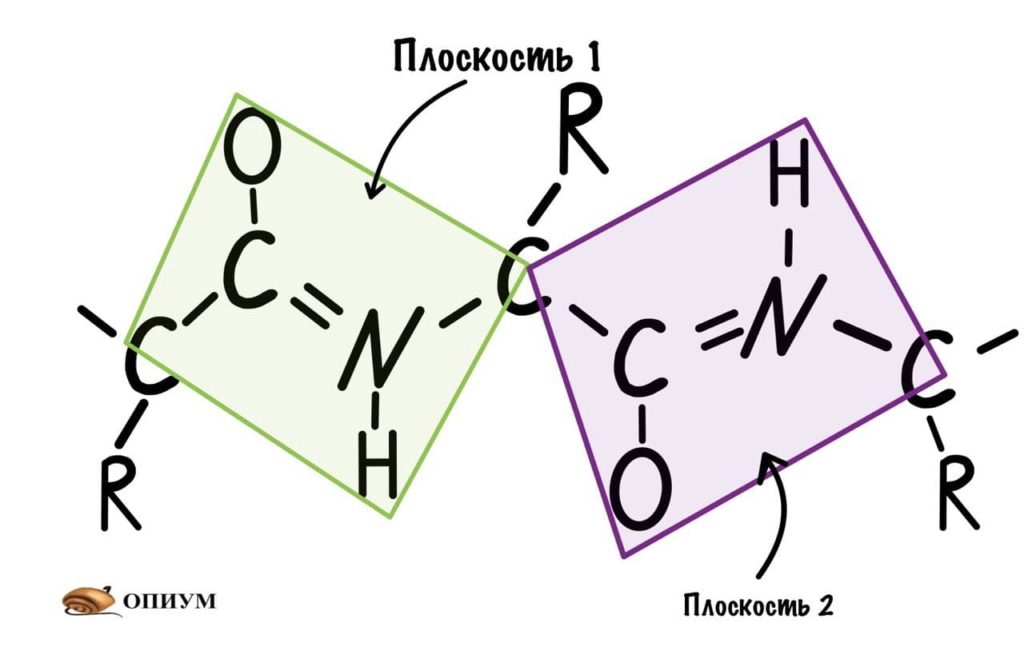
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
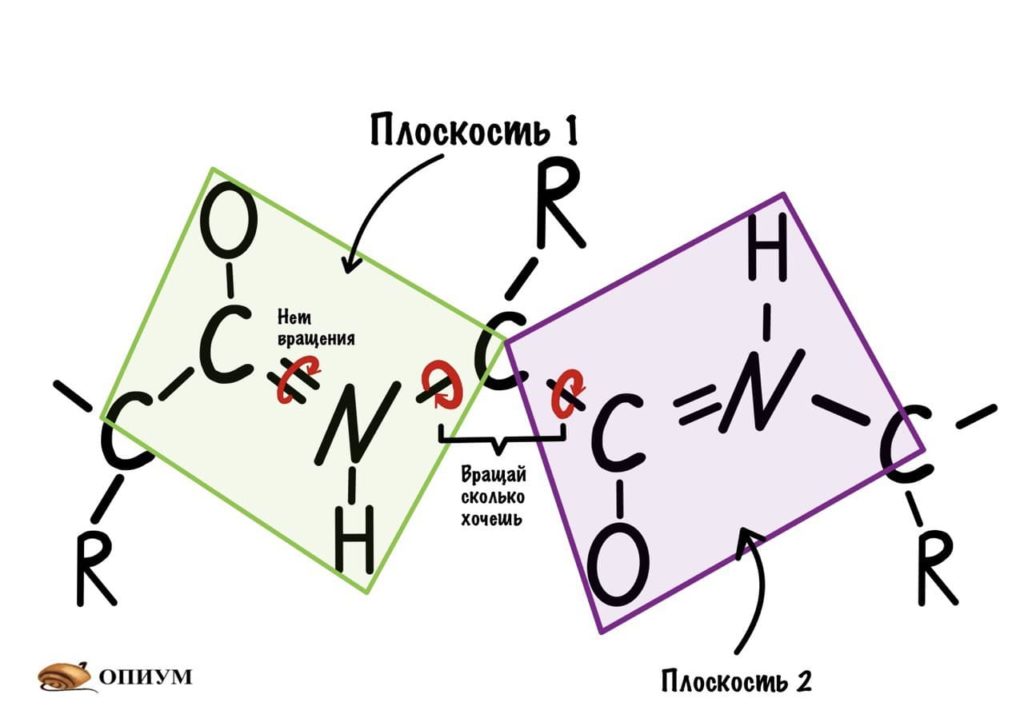
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.



Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
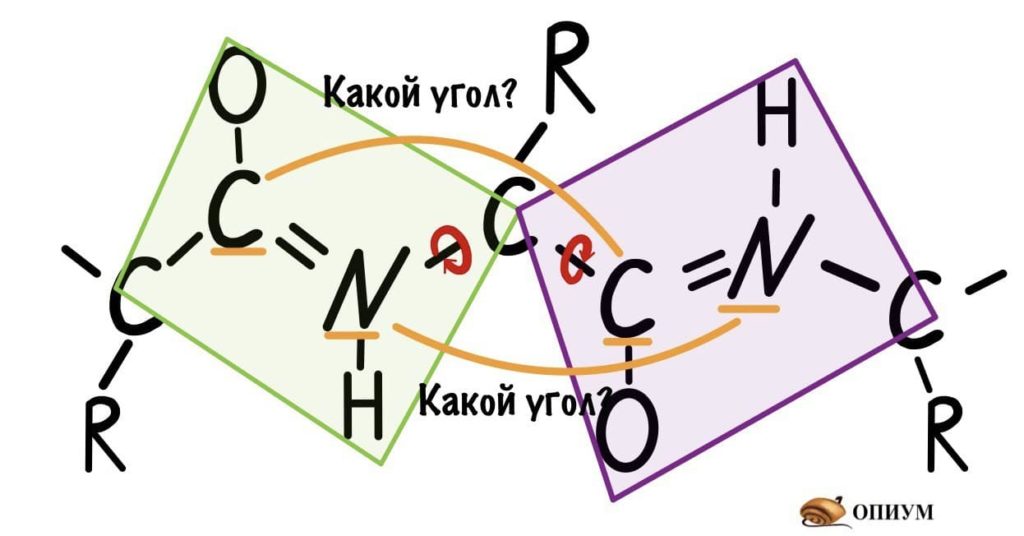
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
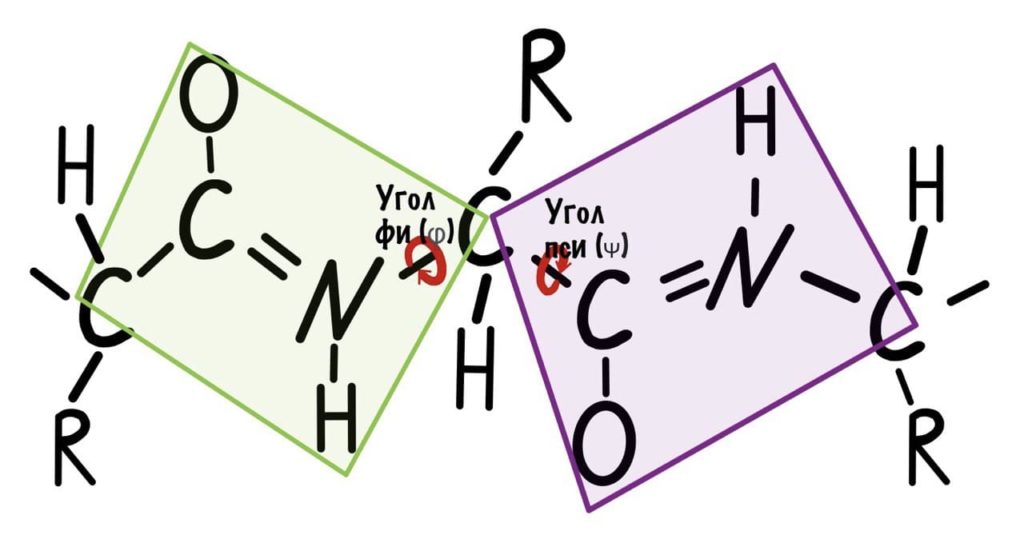
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
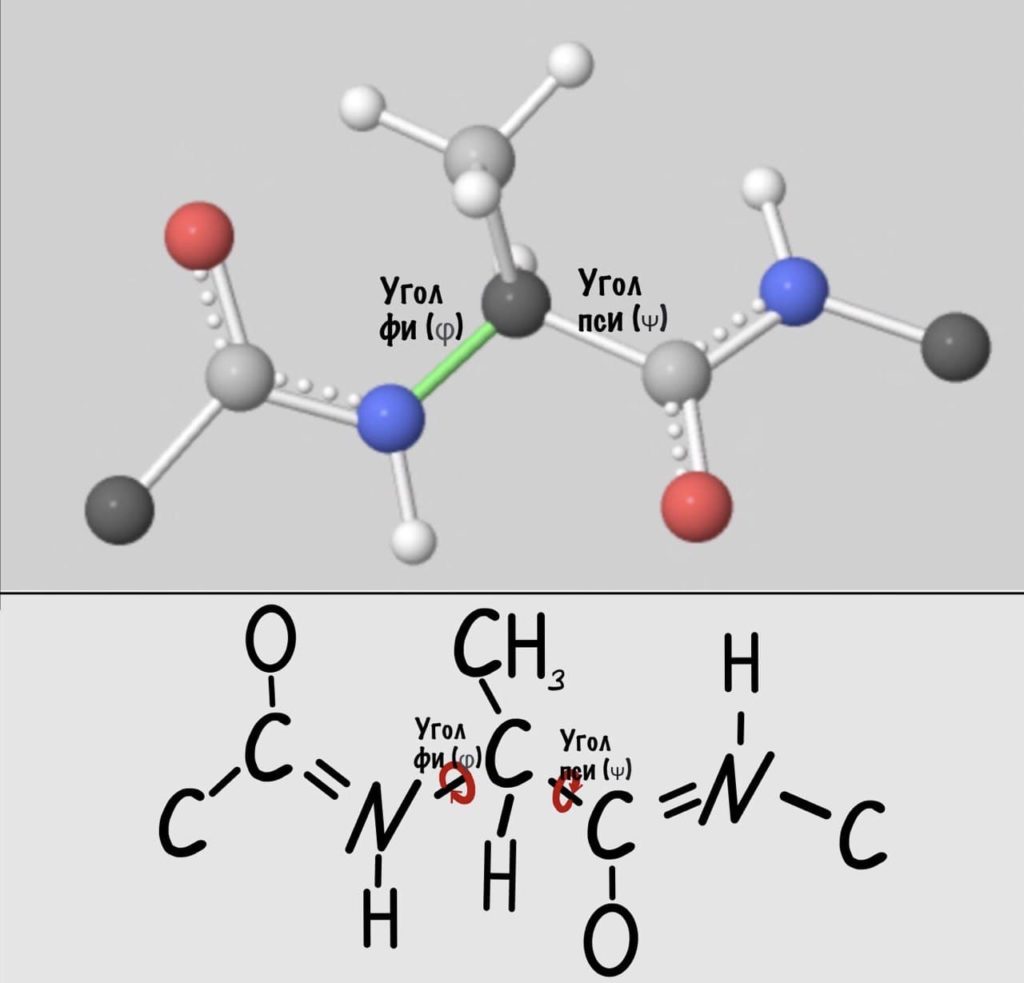
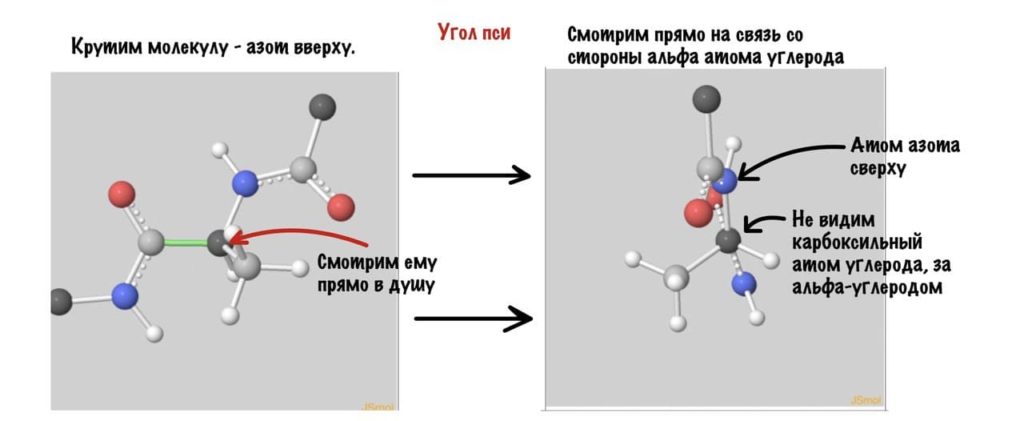
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
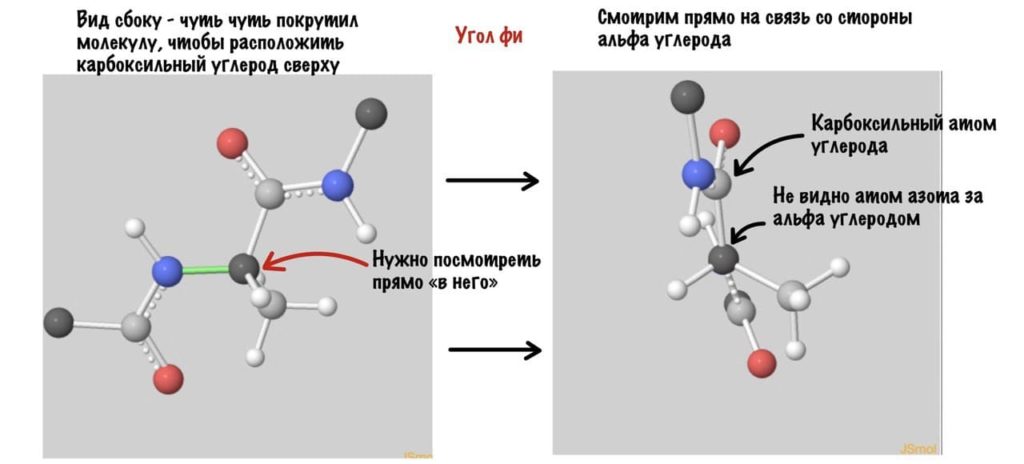
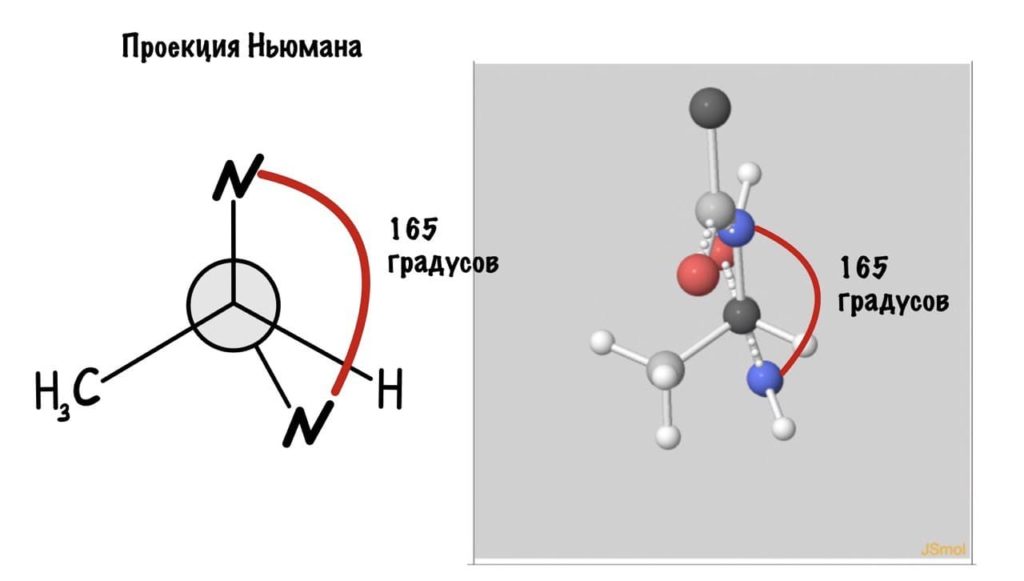
Еще это можно посмотреть графически с помощью проекций Ньюмана.
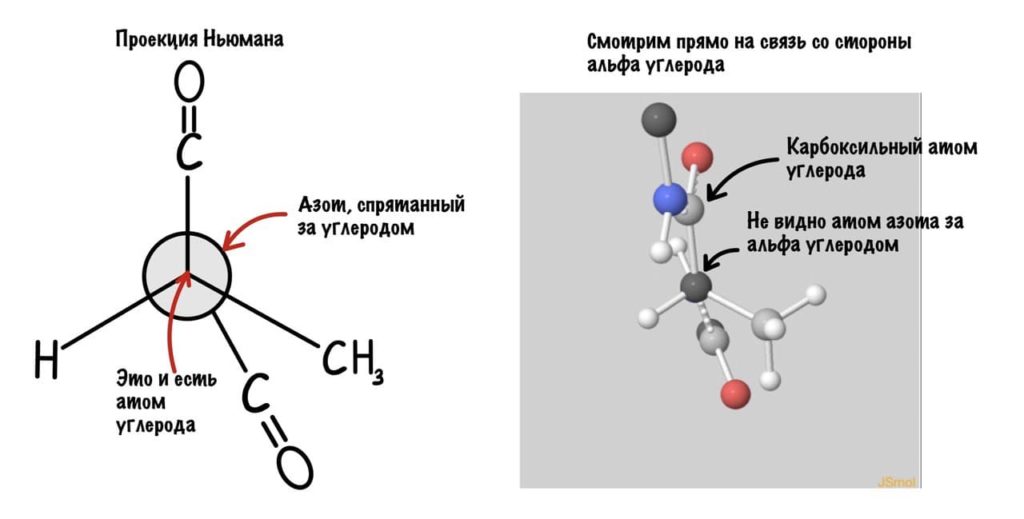
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
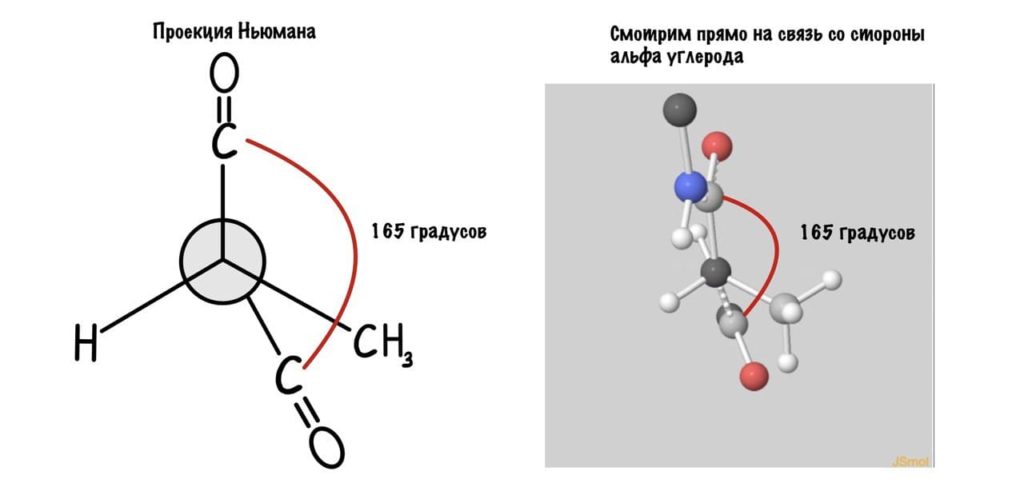
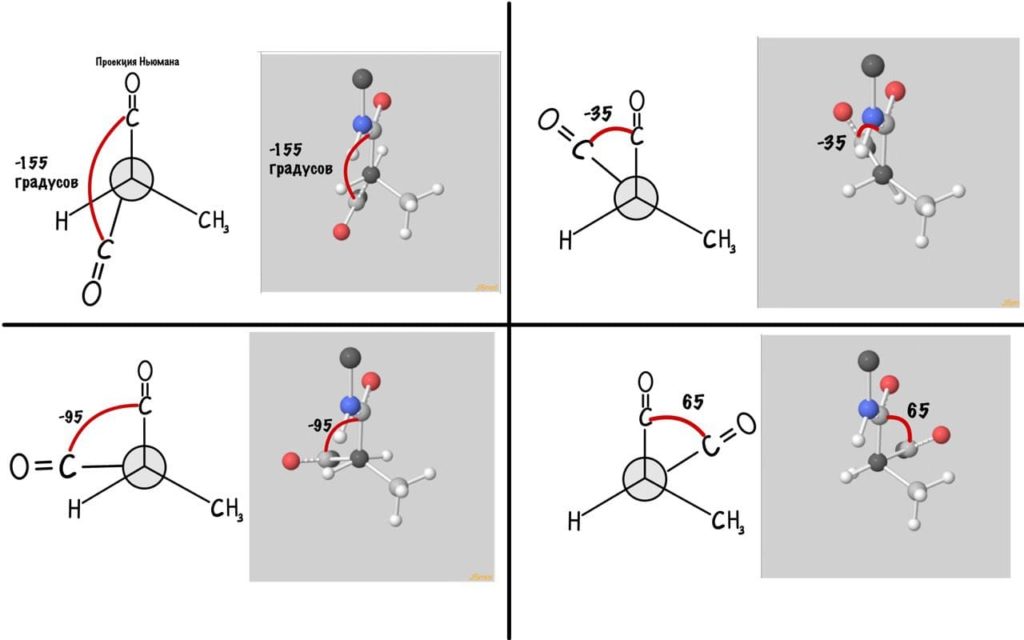
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Аминокислоты соединяются пептидной связью
Аминокислоты способны соединяться между собой связями, которые называются пептидными , при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
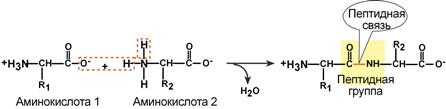
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс “-ил”, только последняя аминокислота сохраняет свое название неизменным. Например,
- аланил-серил-триптофан,
- γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион).
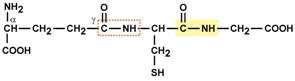
Строение трипептида глутатиона
Особенностью глутатиона является связывание глутамата и цистеина не истинной пептидной связью, а через γ-карбоксильную группу радикала глутаминовой кислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы “Н” и “О” расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по “разные” стороны, в транс-положении.
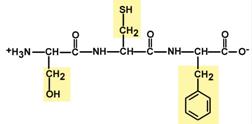
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
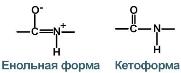
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Строение аминокислот. Изоэлектрическая точка. Характеристика пептидной связи
Даже и не знаю с чего начать, давайте попробуем вот так. Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Поэтому, если нам хочется построить дом, то сначала нужно разобраться с кирпичами, правильно? Вот в этой статье и будем разбираться с аминокислотами: какие они бывают, сколько их и какие у них свойства. Дальше синтезируем пептид и определим — почему некоторые молекулы называются пептидами, а другие белками. Поймем почему про пептидную связь пишут, что она частично-двойная. А в конце небольшой подарок — торсионные углы. Вроде неплохо получилось? Тогда поехали.
Строение аминокислот
По названию все понятно, аминокислота — это молекула, которая содержит аминогруппу и карбоксильную группу. Но посмотрите на центральный углерод, что за бабник? У него целых четыре разных заместителя — водород, аминогруппа, карбоксильная группа и радикал. Он называется…. Альфа-углерод, такой альфа-самец прямо.
Такое общее строение у всех аминокислот, которые входят в состав белков, но они кое-чем отличаются. Да-да, радикалом. Основных аминокислот — 20 штук, хотя если честно, то 19. А если еще честнее, то их больше, но не будем путаться. У одной аминокислоты особенное строение, она даже не аминокислота вовсе, а иминокислота. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. И тут все очень логично — радикалы делятся на неполярные и полярные. Первые нерастворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует только эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
Опа, а глицин то получается не альфа-самец, у него два одинаковых заместителя — водороды.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H + и OH — . Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона водорода. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Начинаем добавлять по капельке кислоту, и сначала ничего не меняется. Но при значении pH=2,34 карбоксильная группа глицина присоединит протон водорода. Что же получается? Заряд молекулы изменился — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от аминогруппы глицина отлетит водород. Заряд молекулы будет -1.
Думаю, что нужно кое-что уточнить. Вы понимаете, что эти реакции обратимы. Когда я добавляю кислоту или щелочь, неважно, то я смещаю реакцию в какую-то сторону. Пусть я добавляю кислоту. С каждой каплей реакция смещается в сторону образования глицина +1, но только при pH равном 2,34 в растворе будет большая часть глицина +1. Хотя на pH +3 большая часть будет глицина с зарядом 0. Надеюсь, что понятно объяснил.
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Химики не корите, не слишком точно конечно, но запомнить легче. Получается, что в молекуле глицина pKa карбоксильной группы=2,34, а pKa аминогруппы=9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp 2 . А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp 2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
- И вращаем!
- Вращаем
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
Торсионные углы в пептидах. Первая картинка с https://proteopedia.org/wiki/index.php/Tutorial:Ramachandran_principle_and_phi_psi_angles
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Угол фи, источник: https://proteopedia.org/wiki/index.php/Tutorial:Ramachandran_principle_and_phi_psi_angles
Еще это можно посмотреть графически с помощью проекций Ньюмана.
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Угол пси, источник: https://proteopedia.org/wiki/index.php/Tutorial:Ramachandran_principle_and_phi_psi_angles
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Пептидная связь — это основа первичной структуры белка. Характеристика и образование пептидной связи
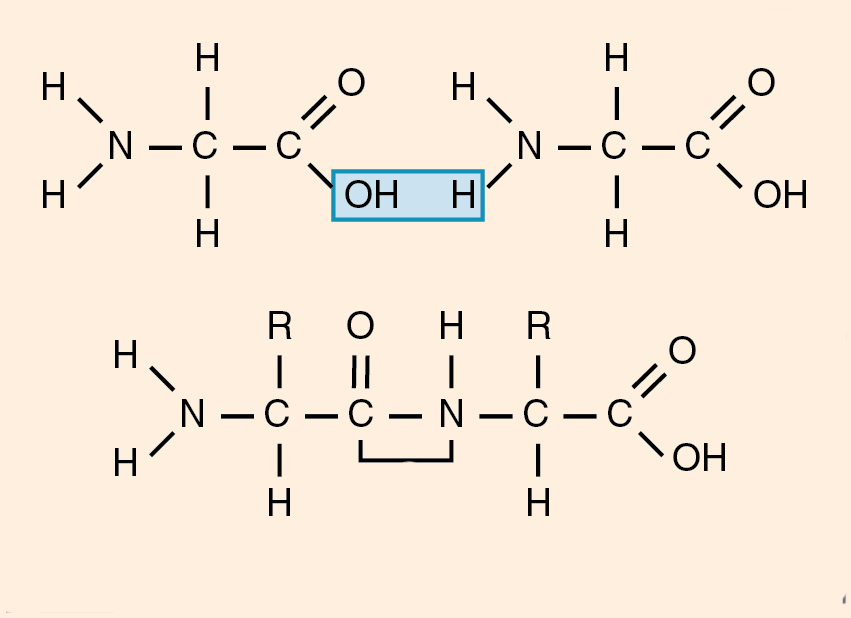
Пептидная связь — это прочное соединение между фрагментами двух аминокислот, которое лежит в основе образования линейных структур белков и пептидов. В таких молекулах каждая аминокислота (за исключением концевых) соединяется с предыдущей и последующей.
В зависимости от количества звеньев пептидные связи могут создавать дипептиды (состоят из двух аминокислот), трипептиды (из трех), тетрапептиды, пентапептиды и т. д. Короткие цепочки (от 10 до 50 мономеров) называют олигопептидами, а длинные — полипептидами и белками (мол. масса более 10 тыс. Да).
Характеристика пептидной связи
Пептидная связь — это ковалентное химическое соединение между первым атомом углерода одной аминокислоты и атомом азота другой, возникающее в результате взаимодействия альфа-карбоксильной группы (COOH) с альфа-аминогруппой (NH2). При этом происходит нуклеофильное замещение OH-гидроксила на аминогруппу, от которой отделяется водород. В итоге образуется одинарная C-N связь и молекула воды.

Так как во время реакции происходит потеря некоторых компонентов (ОН-группы и атома водорода), звенья пептида называют уже не аминокислотами, а аминокислотными остатками. Из-за того, что последние содержат по 2 атома углерода, в пептидной цепи происходит чередование С-С и C-N-связей, которые формируют пептидный остов. По бокам от него располагаются аминокислотные радикалы. Расстояние между атомами углерода и азота варьирует от 0,132 до 0,127 нм, что свидетельствует о неопределенной связи.
Пептидная связь — это очень прочный вид химического взаимодействия. При стандартных биохимических условиях, соответствующих клеточной среде, она не подвергается самостоятельному разрушению.
Для пептидной связи белков и пептидов характерно свойство копланарности, поскольку все атомы, участвующие в ее образовании (C, N, O и H), располагаются в одной плоскости. Это явление объясняется жесткостью (т. е. невозможностью вращения элементов вокруг связи), возникающей в результате резонансной стабилизации. В пределах аминокислотной цепи между плоскостями пептидных групп находятся α-углеродные атомы, связанные с радикалами.
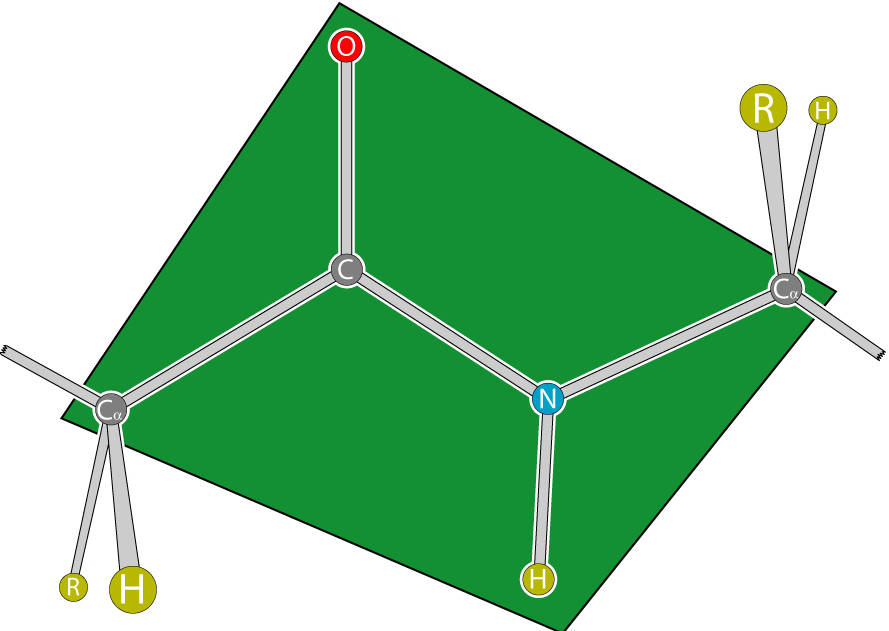
Типы конфигурации
В зависимости от положения альфа-углеродных атомов относительно пептидной связи последняя может иметь 2 конфигурации:
- “цис” (расположены с одной стороны);
- “транс” (находятся с разных сторон).
Транс-форма характеризуется большей устойчивостью. Иногда конфигурации характеризуют по расположению радикалов, что не меняет сути, поскольку они связаны с альфа-углеродными атомами.
Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
- Кетольной (0,132 нм) — C-N-связь стабилизирована и полностью одинарна.
- Переходной или мезомерной – промежуточная форма, имеет частично неопределенный характер.
- Енольной (0,127 нм) — пептидная связь становится полностью двойной, а соединение С-О — полностью одинарным. При этом кислород приобретает частично отрицательный заряд, а атом водорода — частично положительный.
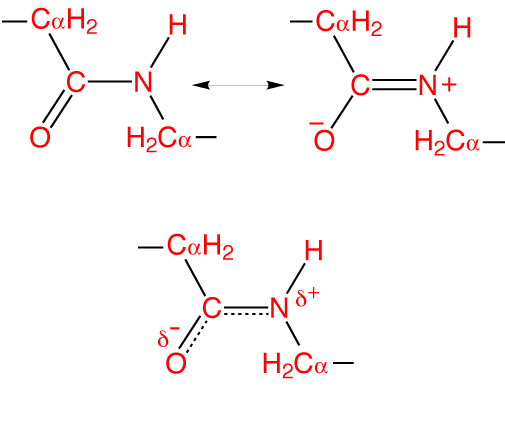
Такая особенность называется эффектом резонанса и объясняется делокализованностью ковалентной связи между атомом углерода и азота. При этом гибридные sp 2 -орбитали формируют электронное облако, распространяющееся на атом кислорода.
Формирование пептидной связи
Формирование пептидной связи — это типичная реакция поликонденсации, которая термодинамически невыгодна. В естественных условиях равновесие смещается в сторону свободных аминокислот, поэтому для осуществления синтеза требуется катализатор, активирующий или модифицирующий карбоксильную группу для более легкого ухода гидроксильной.
В живой клетке образование пептидной связи происходит в белоксинтезирующем центре, где в роли катализатора выступают специфические ферменты, работающие с затратой энергии макроэргических связей.
[spoiler title=”источники:”]
http://www.syl.ru/article/404657/peptidnaya-svyaz-eto-osnova-pervichnoy-strukturyi-belka-harakteristika-i-obrazovanie-peptidnoy-svyazi
[/spoiler]
From Wikipedia, the free encyclopedia

In organic chemistry, a peptide bond is an amide type of covalent chemical bond linking two consecutive alpha-amino acids from C1 (carbon number one) of one alpha-amino acid and N2 (nitrogen number two) of another, along a peptide or protein chain.[1]
It can also be called a eupeptide bond[1] to distinguish it from an isopeptide bond, which is another type of amide bond between two amino acids.
Synthesis[edit]

When two amino acids form a dipeptide through a peptide bond,[1] it is a type of condensation reaction.[2] In this kind of condensation, two amino acids approach each other, with the non-side chain (C1) carboxylic acid moiety of one coming near the non-side chain (N2) amino moiety of the other. One loses a hydrogen and oxygen from its carboxyl group (COOH) and the other loses a hydrogen from its amino group (NH2). This reaction produces a molecule of water (H2O) and two amino acids joined by a peptide bond (−CO−NH−). The two joined amino acids are called a dipeptide.
The amide bond is synthesized when the carboxyl group of one amino acid molecule reacts with the amino group of the other amino acid molecule, causing the release of a molecule of water (H2O), hence the process is a dehydration synthesis reaction.

The dehydration condensation of two amino acids to form a peptide bond (red) with expulsion of water (blue)
The formation of the peptide bond consumes energy, which, in organisms, is derived from ATP.[3] Peptides and proteins are chains of amino acids held together by peptide bonds (and sometimes by a few isopeptide bonds). Organisms use enzymes to produce nonribosomal peptides,[4] and ribosomes to produce proteins via reactions that differ in details from dehydration synthesis.[5]
Some peptides, like alpha-amanitin, are called ribosomal peptides as they are made by ribosomes,[6] but many are nonribosomal peptides as they are synthesized by specialized enzymes rather than ribosomes. For example, the tripeptide glutathione is synthesized in two steps from free amino acids, by two enzymes: glutamate–cysteine ligase (forms an isopeptide bond, which is not a peptide bond) and glutathione synthetase (forms a peptide bond).[7][8]
Degradation[edit]
A peptide bond can be broken by hydrolysis (the addition of water). The hydrolysis of peptide bonds in water releases 8–16 kJ/mol (2–4 kcal/mol) of Gibbs energy.[9] This process is extremely slow, with the half life at 25 °C of between 350 and 600 years per bond.[10]
In living organisms, the process is normally catalyzed by enzymes known as peptidases or proteases, although there are reports of peptide bond hydrolysis caused by conformational strain as the peptide/protein folds into the native structure.[11] This non-enzymatic process is thus not accelerated by transition state stabilization, but rather by ground-state destabilization.
Spectra[edit]
The wavelength of absorption for a peptide bond is 190–230 nm,[12] which makes it particularly susceptible to UV radiation.
Cis/trans isomers of the peptide group[edit]
Significant delocalisation of the lone pair of electrons on the nitrogen atom gives the group a partial double-bond character. The partial double bond renders the amide group planar, occurring in either the cis or trans isomers. In the unfolded state of proteins, the peptide groups are free to isomerize and adopt both isomers; however, in the folded state, only a single isomer is adopted at each position (with rare exceptions). The trans form is preferred overwhelmingly in most peptide bonds (roughly 1000:1 ratio in trans:cis populations). However, X-Pro peptide groups tend to have a roughly 30:1 ratio, presumably because the symmetry between the Cα and Cδ atoms of proline makes the cis and trans isomers nearly equal in energy, see the figure.

Isomerization of an X-Pro peptide bond. Cis and trans isomers are at far left and far right, respectively, separated by the transition states.
The dihedral angle associated with the peptide group (defined by the four atoms Cα–C’–N–Cα) is denoted 




Conformational protein folding is usually much faster (typically 10–100 ms) than cis-trans isomerization (10–100 s). A nonnative isomer of some peptide groups can disrupt the conformational folding significantly, either slowing it or preventing it from even occurring until the native isomer is reached. However, not all peptide groups have the same effect on folding; nonnative isomers of other peptide groups may not affect folding at all.
Chemical reactions[edit]
Due to its resonance stabilization, the peptide bond is relatively unreactive under physiological conditions, even less than similar compounds such as esters. Nevertheless, peptide bonds can undergo chemical reactions, usually through an attack of an electronegative atom on the carbonyl carbon, breaking the carbonyl double bond and forming a tetrahedral intermediate. This is the pathway followed in proteolysis and, more generally, in N–O acyl exchange reactions such as those of inteins. When the functional group attacking the peptide bond is a thiol, hydroxyl or amine, the resulting molecule may be called a cyclol or, more specifically, a thiacyclol, an oxacyclol or an azacyclol, respectively.
See also[edit]
- The Proteolysis Map
References[edit]
- ^ a b c “Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983”. European Journal of Biochemistry. 138 (1): 9–37. 1984. doi:10.1111/j.1432-1033.1984.tb07877.x. ISSN 0014-2956. PMID 6692818.
- ^ Muller, P. (1994-01-01). “Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. ISSN 1365-3075. S2CID 195819485.
- ^ Watson, James; Hopkins, Nancy; Roberts, Jeffrey; Agetsinger Steitz, Joan; Weiner, Alan (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- ^ Miller B. R., Gulick A. M. (2016). “Structural Biology of Nonribosomal Peptide Synthetases”. Nonribosomal Peptide and Polyketide Biosynthesis. Methods in Molecular Biology. Vol. 1401. pp. 3–29. doi:10.1007/978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Griffiths A. J., Miller J. H., Suzuki D. T., Lewontin R. C., Gelbart W. M. (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Walton J. D., Hallen-Adams H. E., Luo H. (2010). “Ribosomal biosynthesis of the cyclic peptide toxins of Amanita mushrooms”. Biopolymers. 94 (5): 659–664. doi:10.1002/bip.21416. PMC 4001729. PMID 20564017.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Wu G., Fang Y. Z., Yang S., Lupton J. R., Turner N. D. (March 2004). “Glutathione metabolism and its implications for health”. The Journal of Nutrition. 134 (3): 489–492. doi:10.1093/jn/134.3.489. PMID 14988435.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Meister A. (November 1988). “Glutathione metabolism and its selective modification”. The Journal of Biological Chemistry. 263 (33): 17205–17208. doi:10.1016/S0021-9258(19)77815-6. PMID 3053703.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Martin R. B. (December 1998). “Free energies and equilibria of peptide bond hydrolysis and formation”. Biopolymers. 45 (5): 351–353. doi:10.1002/(SICI)1097-0282(19980415)45:5<351::AID-BIP3>3.0.CO;2-K.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Radzicka, Anna; Wolfenden, Richard (1996-01-01). “Rates of Uncatalyzed Peptide Bond Hydrolysis in Neutral Solution and the Transition State Affinities of Proteases”. Journal of the American Chemical Society. 118 (26): 6105–6109. doi:10.1021/ja954077c. ISSN 0002-7863.
- ^ Sandberg A., Johansson D. G., Macao B., Härd T. (April 2008). “SEA domain autoproteolysis accelerated by conformational strain: energetic aspects”. Journal of Molecular Biology. 377 (4): 1117–1129. doi:10.1016/j.jmb.2008.01.051. PMID 18308334.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Goldfarb A. R., Saidel L. J., Mosovich E. (November 1951). “The ultraviolet absorption spectra of proteins”. The Journal of Biological Chemistry. 193 (1): 397–404. doi:10.1016/S0021-9258(19)52465-6. PMID 14907727.
{{cite journal}}: CS1 maint: uses authors parameter (link)


