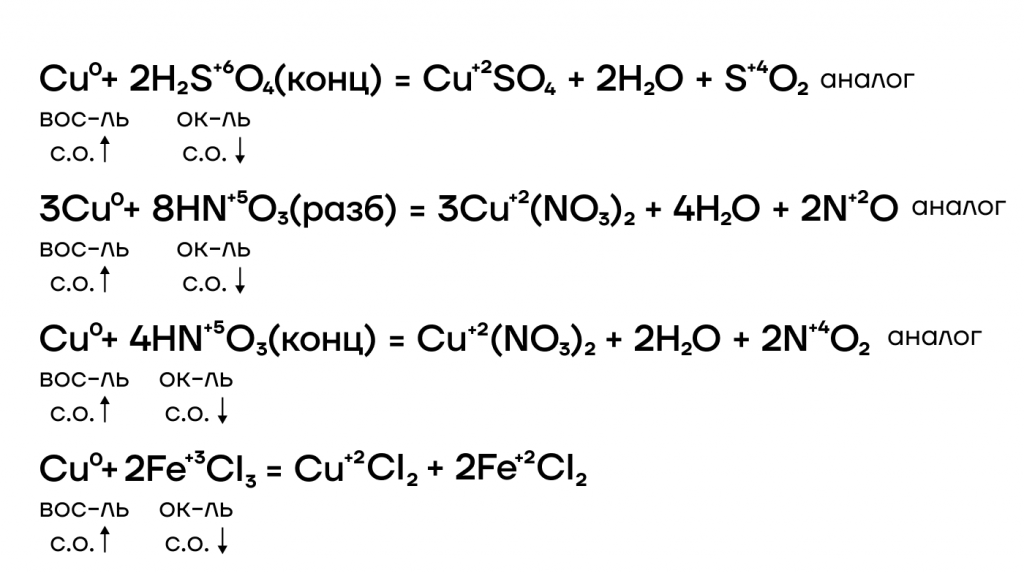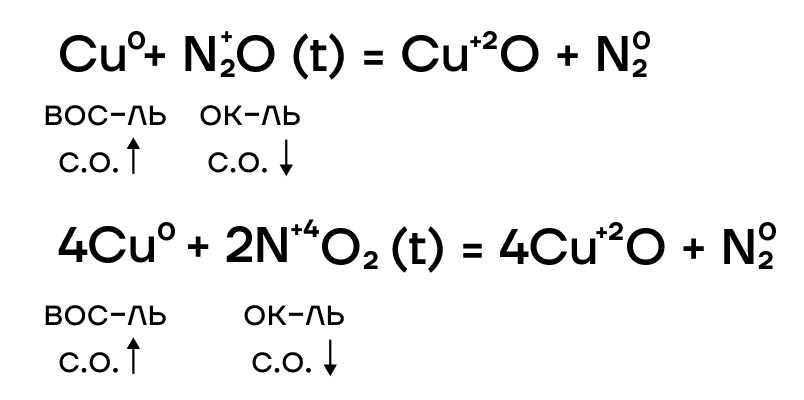| H | He | ||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях[1]. В общем виде электронное строение переходных элементов можно представить следующим образом: 

| Группа → Период ↓ |
III | IV | V | VI | VII | VIII | I | II | ||||||||||||||||||||||
| 4 | 21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
||||||||||||||||||||
| 5 | 39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
||||||||||||||||||||
| 6 | * | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
||||||||||||||||||||
| 7 | ** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
Общая характеристика переходных элементов[править | править код]
Все переходные элементы имеют следующие общие свойства:[2]
- Небольшие значения электроотрицательности.
- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
| Формула соединения | Характер соединения |
|---|---|
| Mn(OH)2 | Основание средней силы |
| Mn(OH)3 | Слабое основание |
| Mn(OH)4 | Амфотерный гидроксид |
| H2MnO4 | Сильная кислота |
| HMnO4 | Очень сильная кислота |
- Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди[править | править код]
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди[3]
| Атомный номер |
Название, символ |
Электронная конфигурация |
Степени окисления |
p, г/см³ |
tпл, °C |
tкип, °C |
|---|---|---|---|---|---|---|
| 29 | Медь Cu | [Ar] 3d104s1 | 0, +1, +2 | 8,96[4][5] | 1083[4][5] | 2543[4][5] |
| 47 | Серебро Ag | [Kr] 4d105s1 | 0, +1, +3 | 10,5[6] | 960,8[6] | 2167[6] |
| 79 | Золото Au | [Xe] 4f145d106s1 | 0, +1, +3, +5 | 19,3[7] | 1063,4[7] | 2880[7] |
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность.[8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего 
Медь[править | править код]
Основная статья: Медь
Медь представляет собой довольно мягкий металл красно-жёлтого цвета[10]. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основный карбонат меди(II).
Для меди наиболее характерна степень окисления +2[11], однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди(II)[править | править код]
Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы ![{displaystyle [Cu(H_{2}O)_{6}]^{2+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6126267ad18d7efafd63227d0300e66a25992ff3)
При действии на растворимые соли меди раствором кальцинированной соды образуется малорастворимый основной карбонат меди (II) — малахит:
Гидроксид меди(II)[править | править код]
Гидроксид меди(II) Cu(OH)2 образуется при действии щелочей на растворимые соли меди(II)[12]:
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
Соединения одновалентной меди[править | править код]
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu2+, либо в Cu0. Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типа ![{displaystyle [Cu(NH_{3})_{2}]^{+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/499990c6c6367f4bafb0e2df205b3d63b310aab3)
Серебро[править | править код]
Серебро более инертно, чем медь[14]
, но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
Серебро растворяется в кислотах-окислителях:
Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl−, Br−, I−:
При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
Золото[править | править код]
Кристаллы чистого золота, выращенные методом химического транспорта.
Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений[15]. В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот («царской водке»):
Платиновые металлы[править | править код]
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Значение переходных металлов[править | править код]
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит.
См. также[править | править код]
- Благородные металлы
- Металлы
- Щелочные металлы
- Щёлочноземельные металлы
Примечания[править | править код]
- ↑ Яндекс.Словари: Переходные элементы // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ [www.xumuk.ru/encyklopedia/2/3252.html XuMuK.Ru – Переходные элементы]. Дата обращения: 27 июня 2009.
- ↑ Свойства элементов подгруппы меди на Alhimikov.Net (недоступная ссылка — история). Архивировано 22 февраля 2012 года.
- ↑ 1 2 3 [www.xumuk.ru/spravochnik/239.html Физические свойства меди на XuMuK.Ru]. Дата обращения: 27 июня 2009.
- ↑ 1 2 3 Физические свойства меди на Яндекс.Словари // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 3 [www.xumuk.ru/spravochnik/257.html Физические свойства серебра на XuMuK.Ru]. Дата обращения: 28 июня 2009.
- ↑ 1 2 3 [www.xumuk.ru/spravochnik/289.html Физические свойства золота на XuMuK.Ru]. Дата обращения: 28 июня 2009.
- ↑ Имеется в виду только подгруппа меди, а не металлы в целом.
- ↑ Химия вокруг нас: благородные металлы. Дата обращения: 27 июня 2009. Архивировано 1 марта 2012 года.
- ↑ Химия. Лекции и электронные учебники на Xenoid.Ru. Дата обращения: 27 июня 2009. Архивировано 10 февраля 2012 года.
- ↑ Химия d-элементов I группы (недоступная ссылка — история). Архивировано 22 февраля 2012 года.
- ↑ Это «классический» способ получения нерастворимых оснований
- ↑ Химия меди. Дата обращения: 28 июня 2009. Архивировано 25 февраля 2012 года.
- ↑ Про серебро – свойства серебра (недоступная ссылка — история). Дата обращения: 28 июня 2009. Архивировано 22 февраля 2012 года.
- ↑ Функции золота, современные представления о золоте, интересные факты о золоте. Дата обращения: 29 июня 2009. Архивировано из оригинала 15 июня 2009 года.
Литература[править | править код]
- Ерёмина Е. А., Рыжова О. Н. Глава 17. Переходные элементы // Справочник школьника по химии. — М.: Экзамен, 2009. — С. 250—275. — 512 с. — 5000 экз. — ISBN 978-5-377-01472-0.
- Кузьменко Н. Е. , Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы. — М.: Экзамен, 1997-2001.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л., 1977. — С. 98.
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
Ссылки[править | править код]
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов
|
Содержание
- Переходный металл: свойства и список
- Что это такое
- Место в периодической таблице
- Переходные металлы: список
- Особенности
- Химические свойства
- Проблемы систематизации
- Сравнительная характеристика
- Переходные металлы
- Переходные металлы — общая характеристика
- Комплексные соединения
- Биологическая роль переходных металлов
Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды. В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой. Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое

Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено. Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью). Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.
Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
- с 21-го (скандий) по 29-й (медь);
- с 39-го (иттрий) по 47-й (серебро);
- с 57-го (лантан) до 79-го (золото);
- с 89-го (актиний) до 112-й (коперник).
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Перечень этих элементов представлен:
- скандием;
- титаном;
- ванадием;
- хромом;
- марганцем;
- железом;
- кобальтом;
- никелем;
- медью;
- цинком;
- иттрием;
- цирконием;
- ниобием;
- молибденом;
- технецием;
- рутением;
- родием;
- палладием;
- серебром;
- кадмием;
- гафнием;
- танталом;
- вольфрамом;
- рением;
- осмием;
- иридием;
- платиной;
- золотом;
- ртутью;
- резерфодием;
- дубнием;
- сиборгием;
- борием;
- хассием;
- мейтнерием;
- дармштадтием;
- рентгением;
- унунбием.
Группа лантаноидов представлена:
- лантаном;
- церием;
- празеодимом;
- неодимом;
- прометием;
- самарием;
- европием;
- гадолинием;
- тербием;
- диспрозием;
- гольмием;
- эрбием;
- тулием;
- иттербием;
- лютецием.
- актинием;
- торием;
- протактинием;
- ураном;
- нептунием;
- плутонием;
- америцием;
- кюрием;
- берклием;
- калифорнием;
- эйнштейнием;
- фермием;
- менделевием;
- нобелием;
- лоуренсием.
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения. При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов. Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).
Химические свойства
Переходные металлы проявляют широкий спектр состояний окисления или положительно заряженных форм. В свою очередь, они позволяют переходным элементам образовывать много различных ионных и частично ионных соединений. Образование комплексов приводит к расщеплению d-орбиталей на два энергетических подуровня, что позволяет многим из них поглощать определенные частоты света. Таким образом, образуются характерные окрашенные растворы и соединения. Эти реакции иногда усиливают относительно низкую растворимость некоторых соединений.
Переходные металлы характеризуются высокой электропроводностью и теплопроводностью. Они податливы. Обычно образуют парамагнитные соединения из-за неспаренных d-электронов. Также им свойственна высокая каталитическая активность.
Следует также отметить, что существует некоторая полемика о классификации элементов на границе между основной группой и элементами переходного металла в правой части таблицы. Этими элементами являются цинк (Zn), кадмий (Cd) и ртуть (Hg).
Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны. Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы. Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.
Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Другое различие между металлами основной группы и переходными металлами можно увидеть в формулах соединений, которые они образуют. Первые имеют тенденцию образовывать соли (такие как NaCl, Mg 3 N 2 и CaS), в которых достаточно только отрицательных ионов, чтобы уравновесить заряд на положительных ионах. Переходные металлы образуют аналогичные соединения, такие как FeCl3, HgI2 или Cd (OH)2. Однако они чаще, чем металлы основной группы, образуют комплексы, такие как FeCl4- , HgI42- и Cd (ОН)42-, имеющие избыточное количество отрицательных ионов.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
Источник
Содержание:
Переходные металлы — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются переходными.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s— и d-элементами, поэтому имеют общее название — переходные металлы.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока) на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах 
В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементов являются не только s-электроны внешнего слоя, но и все или некоторые d-электроны предвнешнего слоя, d-элементы образуют три переходных ряда — в IV, V и VI периодах соответственно. Первый ряд включает 10 элементов: от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей (табл. 29).
| Элемент | Символ | Атомный номер | Электронная конфигурация |
| Скандий | Sc | 21 |  |
| Титан | Ti | 22 |  |
| Ванадий | V | 23 |  |
| Хром | Cr | 24 |  |
| Марганец | Mn | 25 |  |
| Железо | Fe | 26 |  |
| Кобальт | Co | 27 |  |
| Никель | Ni | 28 |  |
| Медь | Cu | 29 |  |
| Цинк | Zn | 30 |  |
Как следует из таблицы, хром и медь имеют всего по одному электрону. Согласно закономерностям заполнения энергетических уровней и подуровней у атомов хрома и меди на четвертом энергетическом уровне должно быть два электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную d-орбиталь («провал электрона»). Медь в соединениях проявляет степени окисления + 1, +2, хром проявляет степени окисления +2, +3, +6. Для d-металлов III—VII групп высшая валентность и высшая степень окисления равны номеру группы, т. е. суммарному числу 
| № группы | III | IV | V | VI | VII |
| Элемент | Sc | Ti | V | Cr | Mn |
| Электрон. конфигурация |  |
 |
 |
 |
 |
| Высшая валентность | III | IV | V | VI | VII |
| Высшая степень окисления | +8 | +4 | +5 | +6 | +7 |
d-металлы II группы, атомы которых имеют завершенную структуру d-подуровня 
В периодах с увеличением заряда ядра металлические свойства изменяются более медленно по сравнению со свойствами s— и p-элементов. В побочных подгруппах сверху вниз восстановительные свойства d-элементов уменьшаются. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d-металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода: (Fe, Cr, Zn, Mil и др.); малоактивные металлы (Сu, Hg и др.) и благородные металлы (Аu, Pt), располагающиеся в ряду напряжений после водорода.
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями, например:


Кислотно-основные свойства оксидов и гидроксидов d-элементов, а также окислительно-восстановительные свойства их соединений зависят от степени окисления металла. Как следует из таблицы при увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается (табл. 31).
Например, СrО и Сг(ОН)2 — это основные оксиды и гидроксиды. Сг2O3 и Сг(ОН)3 — амфотерные, СrO3 и Н2СrО4, Н2Сг2О2 — кислотные.
d-металлы по сравнению с другими металлами характеризуются более большей твердостью, плотностью, высокой температурами плавления и кипения, d-металлы хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон. Так, медь, серебро и золото, обладающие конфигурацией d 10 s 1
Большинство соединений переходных металлов окрашены. Для d-элементов характерно образование комплексных соединений.
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются металлами. В каждом большом периоде d-элементы располагаются между s— и p-элементами. В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Соединения d-элементов могут проявлять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями. При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается.
Комплексные соединения
Мир веществ многообразен, и мы встречались с группой веществ, которые принадлежат к комплексным соединениям. Данными веществами стали заниматься с XIX века, но понять их строение с позиций существовавших представлений о валентности было трудно. В 1893 году швейцарским химиком-неоргаником Альфредом Вернером была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений, которую назвали координационной теорией, поэтому комплексные соединения часто называют координационными соединениями. Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Комплексные соединения образуются в результате взаимодействия между собой солей, кислот и оснований, например:
Строение комплексных соединений. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой.
Во внутреннюю сферу, которую обозначают квадратными скобками, входит центральный атом, или комплексообразователь, и окружающие его ионы, атомы или молекулы, называемые лигандами. Наиболее часто комплексообразователями служат атомы металлов. В качестве лигандов выступают ионы Cl, Br, I , CN, NO2, ОН или нейтральные молекулы NH3, Н2O, СО.
В состав внутренней сферы одного соединения могут входить различные лиганды, например, в 



Железо (+2) является центральным ионом. Ионы CN выполняют роль лигандов. Железо в комплексе с цианогруппами образует внутреннюю координационную сферу. Ионы калия образуют внешнюю координационную сферу. Положительный заряд внешней сферы компенсирует отрицательный заряд внутренней сферы. Координационное число комплексообразователя (Fe), определяемое числом координационных связей, равно 6.
2. Структура комплекса 
3. Структура комплекса 
Классификация комплексных соединений Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1. По составу: например, соли 

2. По типу координируемых лигандов: а) аквакомплексы — это комплексные катионы, в которых лигандами являются молекулы Н2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Например: 
в) аммиакаты — это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы. Например:
г) ацидокомплексы — это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например:
3. По заряду внутренней сферы а) комплексный катион, например,
б) комплексный анион, например,
Химические свойства
1. В растворе комплексные соединения ведут себя как сильные электролиты, т. е. полностью диссоциируют на катионы и анионы:
а)
б)
2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты:
б) при избытке кислоты:
3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
Значение и применение комплексных соединений
Комплексные соединения имеют большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови является комплексным соединением железа, а хлорофилл — комплексным соединением магния, витамин В12 — комплексным соединением кобальта. Образование комплексных соединений используют в химической технологии для извлечения золота, металлов платиновой группы и др. Эти соединения широко применяют в аналитической химии в качестве индикаторов.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой. Комплексообразователями являются металлы. Окружающие комплексообразователя ионы, атомы или молекулы, называются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 и 6.
Биологическая роль переходных металлов
Хром — постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется главным образом способностью ионов Сr 3- образовывать комплексные соединения. Например, ионы Сr 3- участвуют в стабилизации структуры нуклеиновых кислот. Недостаток хрома замедляет рост живых организмов, нарушает углеводный обмен вызывает болезнь глаз, симптомы диабета. Соединения хрома ядовиты и в медицине не применяются.
Марганец. Марганец — микроэлемент. Биогенная функция ионов Мn 2+ состоит в регуляции активности ферментов. Поэтому ионы Мn 2+ обладают широким спектром биологических эффектов: оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т. д. Кроме того, ионы Мn 2+ стабилизируют структуру нуклеиновых кислот. В медицине используется перманганат калия КМnO4. Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т. д.
Железо. Железо входит в состав ферментов, которые катализируют окислительно-восстановительные процессы в организме человека. Играет важную роль в синтезе белков, процессах фотосинтеза и дыхания растений. Недостаток железа в организме человека приводит к болезни крови (анемии) и нарушению иммунной системы. В организме взрослого человека содержится около 3,5 г железа. Основная его масса сконцентрирована в гемоглобине. По форме гемоглобин похож на шарик диаметром около 5,5 нм. Гемоглобин — сложный белок,который переносит кислород по всем тканям и органам. В нашей жизни становится все больше продуктов, которые могут вызвать недомогание у любого человека. Одним из таких продуктов является оксид углерода (II) — угарный газ. Оксид углерода (II) образуется при неполном сгорании любого топлива (газ, уголь, дрова, бензин и др.) Кроме того увеличивается количество транспорта, а с ним и угарного газа в атмосфере. При этом распространяется газ быстро, смешиваясь с воздухом без потери своих отравляющих свойств. Для человека угарный газ — сильнейший яд. Поступая в организм при дыхании, он проникает из легких в кровеносную систему, где и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:

Такое состояние опасно для жизни и при тяжелом отравлении может быть смертельным. Основная проблема состоит в том, что угарный газ не имеет ни цвета, ни вкуса, ни запаха, не вызывает вообще никаких ощущений.
К первым симптомам отравления угарным газом относятся: тошнота, рвота, головокружение, частый пульс, дезориентация. Возможно развитие обморока, эйфории, спутанности сознания.
• Если начинается озноб, падает температура — укутайте потеплее, напоите сладким чаем (если человек в сознании, разумеется).
• Устройте поудобнее (и желательно — на свежем воздухе или, хотя бы, у открытого окна), чтобы облегчить дыхание.
• Потерявшего сознание уложите на бок и следите, чтобы его голова не запрокидывалась, особенно если вдруг возникнет рвота, дайте понюхать ватку, смоченную нашатырным спиртом, для того, чтобы привести человека в сознание; При необходимости сделать пострадавшему непрямой массаж сердца и провести искусственное дыхание.
• Чем раньше пострадавшему будет оказана медицинская помощь, тем больше шансов на его выздоровление.
Учтите: от отравления угарным газом существует противоядие. Этот препарат называется ацизол, выпускается в виде капсул и в виде раствора в ампулах (для внутримышечных инъекций).
Для того, чтобы предотвратить отравление угарным газом нужно соблюдать несложные правила:
• не ночевать в гараже;
• не использовать газовую горелку или керосиновую лампу для отопления закрытого помещения;
• не оставлять в гараже машину с включенным двигателем;
• не спать в машине с включенным двигателем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Источник
Содержание:
- Переходные металлы – общая характеристика
- Комплексные соединения
- Биологическая роль переходных металлов
Переходные металлы — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Переходные металлы – общая характеристика
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются переходными.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют “вставные декады” (по 10 элементов) между s– и d-элементами, поэтому имеют общее название — переходные металлы.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока) на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах 
В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементов являются не только s-электроны внешнего слоя, но и все или некоторые d-электроны предвнешнего слоя, d-элементы образуют три переходных ряда — в IV, V и VI периодах соответственно. Первый ряд включает 10 элементов: от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей (табл. 29).
Таблица 29
| Элемент | Символ | Атомный номер | Электронная конфигурация |
| Скандий | Sc | 21 |  |
| Титан | Ti | 22 |  |
| Ванадий | V | 23 |  |
| Хром | Cr | 24 |  |
| Марганец | Mn | 25 |  |
| Железо | Fe | 26 |  |
| Кобальт | Co | 27 |  |
| Никель | Ni | 28 |  |
| Медь | Cu | 29 |  |
| Цинк | Zn | 30 |  |
Как следует из таблицы, хром и медь имеют всего по одному электрону. Согласно закономерностям заполнения энергетических уровней и подуровней у атомов хрома и меди на четвертом энергетическом уровне должно быть два электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную d-орбиталь (“провал электрона”). Медь в соединениях проявляет степени окисления + 1, +2, хром проявляет степени окисления +2, +3, +6. Для d-металлов III—VII групп высшая валентность и высшая степень окисления равны номеру группы, т. е. суммарному числу 
Таблица 30
| № группы | III | IV | V | VI | VII |
| Элемент | Sc | Ti | V | Cr | Mn |
| Электрон. конфигурация |  |
 |
 |
 |
 |
| Высшая валентность | III | IV | V | VI | VII |
| Высшая степень окисления | +8 | +4 | +5 | +6 | +7 |
d-металлы II группы, атомы которых имеют завершенную структуру d-подуровня 
В периодах с увеличением заряда ядра металлические свойства изменяются более медленно по сравнению со свойствами s– и p-элементов. В побочных подгруппах сверху вниз восстановительные свойства d-элементов уменьшаются. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d-металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода: (Fe, Cr, Zn, Mil и др.); малоактивные металлы (Сu, Hg и др.) и благородные металлы (Аu, Pt), располагающиеся в ряду напряжений после водорода.
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями, например:


Кислотно-основные свойства оксидов и гидроксидов d-элементов, а также окислительно-восстановительные свойства их соединений зависят от степени окисления металла. Как следует из таблицы при увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается (табл. 31).
Таблица 31
Например, СrО и Сг(ОН)2 — это основные оксиды и гидроксиды. Сг2O3 и Сг(ОН)3 — амфотерные, СrO3 и Н2СrО4, Н2Сг2О2 — кислотные.
d-металлы по сравнению с другими металлами характеризуются более большей твердостью, плотностью, высокой температурами плавления и кипения, d-металлы хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон. Так, медь, серебро и золото, обладающие конфигурацией d10s1
Большинство соединений переходных металлов окрашены. Для d-элементов характерно образование комплексных соединений.
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются металлами. В каждом большом периоде d-элементы располагаются между s– и p-элементами. В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Соединения d-элементов могут проявлять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями. При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается.
Комплексные соединения
Мир веществ многообразен, и мы встречались с группой веществ, которые принадлежат к комплексным соединениям. Данными веществами стали заниматься с XIX века, но понять их строение с позиций существовавших представлений о валентности было трудно. В 1893 году швейцарским химиком-неоргаником Альфредом Вернером была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений, которую назвали координационной теорией, поэтому комплексные соединения часто называют координационными соединениями. Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Комплексные соединения образуются в результате взаимодействия между собой солей, кислот и оснований, например:
Строение комплексных соединений. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой.
Во внутреннюю сферу, которую обозначают квадратными скобками, входит центральный атом, или комплексообразователь, и окружающие его ионы, атомы или молекулы, называемые лигандами. Наиболее часто комплексообразователями служат атомы металлов. В качестве лигандов выступают ионы Cl, Br, I , CN, NO2, ОН или нейтральные молекулы NH3, Н2O, СО.
В состав внутренней сферы одного соединения могут входить различные лиганды, например, в 



Железо (+2) является центральным ионом. Ионы CN выполняют роль лигандов. Железо в комплексе с цианогруппами образует внутреннюю координационную сферу. Ионы калия образуют внешнюю координационную сферу. Положительный заряд внешней сферы компенсирует отрицательный заряд внутренней сферы. Координационное число комплексообразователя (Fe), определяемое числом координационных связей, равно 6.
2. Структура комплекса 
3. Структура комплекса 
Классификация комплексных соединений Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1. По составу: например, соли 

2. По типу координируемых лигандов: а) аквакомплексы — это комплексные катионы, в которых лигандами являются молекулы Н2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Например: 

в) аммиакаты — это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы. Например:
г) ацидокомплексы — это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например:
3. По заряду внутренней сферы а) комплексный катион, например,
б) комплексный анион, например,
Химические свойства
1. В растворе комплексные соединения ведут себя как сильные электролиты, т. е. полностью диссоциируют на катионы и анионы:
а)
б)
2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты:
б) при избытке кислоты:
3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
Значение и применение комплексных соединений
Комплексные соединения имеют большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови является комплексным соединением железа, а хлорофилл — комплексным соединением магния, витамин В12 — комплексным соединением кобальта. Образование комплексных соединений используют в химической технологии для извлечения золота, металлов платиновой группы и др. Эти соединения широко применяют в аналитической химии в качестве индикаторов.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой. Комплексообразователями являются металлы. Окружающие комплексообразователя ионы, атомы или молекулы, называются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 и 6.
Биологическая роль переходных металлов
Хром — постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется главным образом способностью ионов Сr3- образовывать комплексные соединения. Например, ионы Сr3- участвуют в стабилизации структуры нуклеиновых кислот. Недостаток хрома замедляет рост живых организмов, нарушает углеводный обмен вызывает болезнь глаз, симптомы диабета. Соединения хрома ядовиты и в медицине не применяются.
Марганец. Марганец — микроэлемент. Биогенная функция ионов Мn2+ состоит в регуляции активности ферментов. Поэтому ионы Мn2+ обладают широким спектром биологических эффектов: оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т. д. Кроме того, ионы Мn2+ стабилизируют структуру нуклеиновых кислот. В медицине используется перманганат калия КМnO4. Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т. д.
Железо. Железо входит в состав ферментов, которые катализируют окислительно-восстановительные процессы в организме человека. Играет важную роль в синтезе белков, процессах фотосинтеза и дыхания растений. Недостаток железа в организме человека приводит к болезни крови (анемии) и нарушению иммунной системы. В организме взрослого человека содержится около 3,5 г железа. Основная его масса сконцентрирована в гемоглобине. По форме гемоглобин похож на шарик диаметром около 5,5 нм. Гемоглобин — сложный белок,который переносит кислород по всем тканям и органам. В нашей жизни становится все больше продуктов, которые могут вызвать недомогание у любого человека. Одним из таких продуктов является оксид углерода (II) — угарный газ. Оксид углерода (II) образуется при неполном сгорании любого топлива (газ, уголь, дрова, бензин и др.) Кроме того увеличивается количество транспорта, а с ним и угарного газа в атмосфере. При этом распространяется газ быстро, смешиваясь с воздухом без потери своих отравляющих свойств. Для человека угарный газ — сильнейший яд. Поступая в организм при дыхании, он проникает из легких в кровеносную систему, где и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:

Такое состояние опасно для жизни и при тяжелом отравлении может быть смертельным. Основная проблема состоит в том, что угарный газ не имеет ни цвета, ни вкуса, ни запаха, не вызывает вообще никаких ощущений.
К первым симптомам отравления угарным газом относятся: тошнота, рвота, головокружение, частый пульс, дезориентация. Возможно развитие обморока, эйфории, спутанности сознания.
• При отравлении угарным газом первая помощь должна быть оказана до приезда скорой помощи. При легких отравлениях {если дело ограничилось головокружением и тошнотой) обычно бывает достаточно вывести (или вынести) человека на свежий воздух. Но до тех пор, пока его состояние полностью не придет в норму, наблюдайте, фиксируйте любые изменения, чтобы вовремя прийти на помощь, если потребуется. При тяжелых отравлениях и поражениях средней тяжести, как правило, нужна госпитализация. Главная задача в ожидании врача — облегчить состояние пострадавшего, насколько это в ваших силах.
• Если начинается озноб, падает температура — укутайте потеплее, напоите сладким чаем (если человек в сознании, разумеется).
• Устройте поудобнее (и желательно — на свежем воздухе или, хотя бы, у открытого окна), чтобы облегчить дыхание.
• Потерявшего сознание уложите на бок и следите, чтобы его голова не запрокидывалась, особенно если вдруг возникнет рвота, дайте понюхать ватку, смоченную нашатырным спиртом, для того, чтобы привести человека в сознание; При необходимости сделать пострадавшему непрямой массаж сердца и провести искусственное дыхание.
• Чем раньше пострадавшему будет оказана медицинская помощь, тем больше шансов на его выздоровление.
Учтите: от отравления угарным газом существует противоядие. Этот препарат называется ацизол, выпускается в виде капсул и в виде раствора в ампулах (для внутримышечных инъекций).
Для того, чтобы предотвратить отравление угарным газом нужно соблюдать несложные правила:
• не ночевать в гараже;
• не использовать газовую горелку или керосиновую лампу для отопления закрытого помещения;
• не оставлять в гараже машину с включенным двигателем;
• не спать в машине с включенным двигателем.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
переходные и непереходные металлы
Профи
(594),
закрыт
15 лет назад
Елена Казакова
Высший разум
(122284)
15 лет назад
Переходные металлы (переходные элементы) — химические элементы побочных подгрупп I — VIII групп Периодической системы элементов Д. И. Менделеева (3 — 12 групп в длиннопериодном варианте таблицы) .
Переходные металлы выделяют на основании незавершённости внутренних электронных оболочек их атомов или ионов. Термин «переходные» связан с тем, что в периодах эти элементы располагаются между s- и р-элементами. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды) . Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень.
Это хром, молибден, вольфрам, марганец и т. д.
Их разделяют на подгруппы
Переходные металлы:
Подгруппа железа
Подгруппа меди
Подгруппа марганца
Подгруппа хрома
Подгруппа цинка
Адико
Знаток
(283)
15 лет назад
Переходные металлы могут в реакции с водой образовать не только основания, но кислоты. Например: 2Al+6H2O->2Al(OH)3+3H2 (гидроксид алюминия, основание) или 2Al+6H2O->2H3AlO3+3H2 (алюминиевая кислота) . А еще проще как отличать: они в таблице Менделеева подписаны 🙂
Странник***
Просветленный
(23416)
15 лет назад
Соединения переходных металлов
Переходные металлы образуют соединения с обычной s-связью металл-углерод, а также p-комплексы с органическими ненасыщенными молекулами. Разнообразие органических лигандов и способов их связывания с металлами определяет многочисленность этих соединений.
В соответствии с типом органического лиганда различают олефиновые (алкеновые) , ацетиленовые (алкиновые) , аллильные, диеновые (или полиеновые) , циклопентадиенильные (включая металлоцены) и ареновые комплексы переходных металлов. Некоторые карборановые группировки также могут вести себя как p-связанные лиганды. Существуют соединения, содержащие одновременно органические лиганды различных типов. Известны также би- и полиядерные МОС, которые могут содержать связи металл – металл (кластеры) .
Переходные металлы способны стабилизировать при координации неустойчивые органические молекулы, ионы и свободные радикалы (комплексы циклобутадиена, триметиленметана, карбенов, карбинов и т. п.) .
С точки зрения теории молекулярных орбиталей, в МОС p-комплексного типа связи лигандов с металлом осуществляются общей системой электронов. Эти делокализованные многоцентровые связи могут охватывать атом металла и часть или все углеродные атомы органического лиганда. Определяющую роль в связывании с металлом играют граничные p-орбитали лиганда. Сильное перекрывание орбиталей металла и лиганда способствует образованию прочной связи. Это возможно, когда энергии взаимодействующих орбиталей близки и орбитали имеют одинаковый знак, т. е. одинаковые свойства симметрии и фазу (принцип изолобалъной аналогии) .
Распределение электронной плотности между атомом металла и лигандом зависит от природы металла, степени его окисления и от строения органического лиганда. При этом изменения результирующих зарядов на атоме металла и лиганде при образовании p-связи невелики, что обусловлено особенностями связей металл – лиганд. Эти связи состоят из двух компонент: донорно-акцепторной и дативной. Первая обусловлена подачей p-электронов лиганда на молекулярные орбитали комплекса, образованные с участием d-орбиталей металла. Вторая – включает обратную подачу d-электронов металла на молекулярные орбитали, образованные за счет перекрывания разрыхляющих (несвязывающих) p*-орбиталей лиганда и d-орбиталей металла.
Стехиометрия многих, хотя и не всех, p-комплексов подчиняется правилу эффективного атомного номера (ЭАН, правило 18 электронов, правило инертного газа, правило Сиджвика) . В соответствии с этим правилом число валентных электронов у металла в комплексе должно равняться числу электронов в оболочке ближайшего к данному металлу инертного газа.
Правило определяет способность атома металла наиболее полно использовать при образовании связи с лигандом свои валентные орбитали nd, (n+1)s и (n+1)р, которые суммарно могут заполнены 18 электронами. Для подсчета ЭАН к числу электронов на внешней оболочке атома (или иона) металла прибавляют число электронов, формально передаваемых атому металла лигандами. Обычно принимают, что s-алкильные, s-арильные лиганды и т. п. отдают атому металла один электрон, олефины – два, h3-аллил – три, диены – четыре, p-циклопентадиенил – пять и т. д. По этому принципу органические лиганды классифицируют на одно-, двух-, трехэлектронные и т. д. Атомы галогена и водорода, а также группы CN, OR, SR формально передают один электрон, СО, R3N, R3P – два, NО – три; связь металл-металл – по одному электрону каждому атому металла. Если энергии орбиталей nd, (n + 1)s и (n + 1)р близки, а орбитали доступны для связывания лигандов, то выполняется правило ЭАН (например, для комплексов V, Cr, Mn, Fe и Со в низших степенях окисления) . Отклонения от правила наблюдаются для комплексов металлов, завершающих d-ряды, напр. Сu, Аg, Аu, или при повышении степени окисления металла, т. е. в тех случаях, когда у
[ссылка заблокирована по решению администрации проекта]
Сергей Божко
Профи
(512)
2 года назад
Как все сложна!
Руби фишку, крче!
У непереходных полный комплект электронов вокруг ядра вращается, а у переходных не совсем. Из-за этого они по-разному ведут себя в соединениях и под воздействием внешних факторов, т. е. все что выше написали остальные. Классификаций и разных нюансов в химии до фи ги ща. Именно поэтому я ненавижу Химию, но если потратишь время и подробно изучишь вопрос, то все четко, здесь нужно отдать должное. Однако, если учебник написан зазнайкой от мира науки, то рискуешь сломать себе мозг.
На этой странице вы узнаете
- Что такое переходные металлы;
- Основные характеристики меди, хрома и железа;
- Их физические и химические свойства.
Общая характеристика переходных элементов-металлов
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы. Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
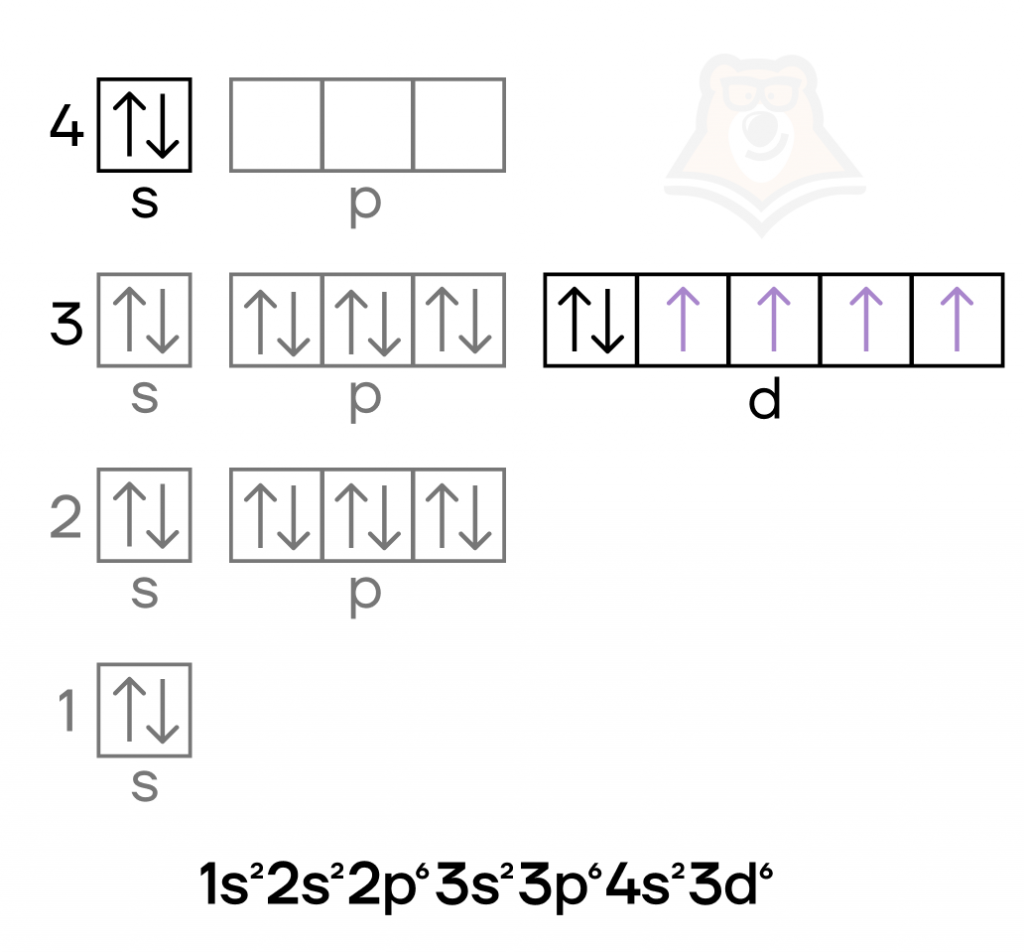
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
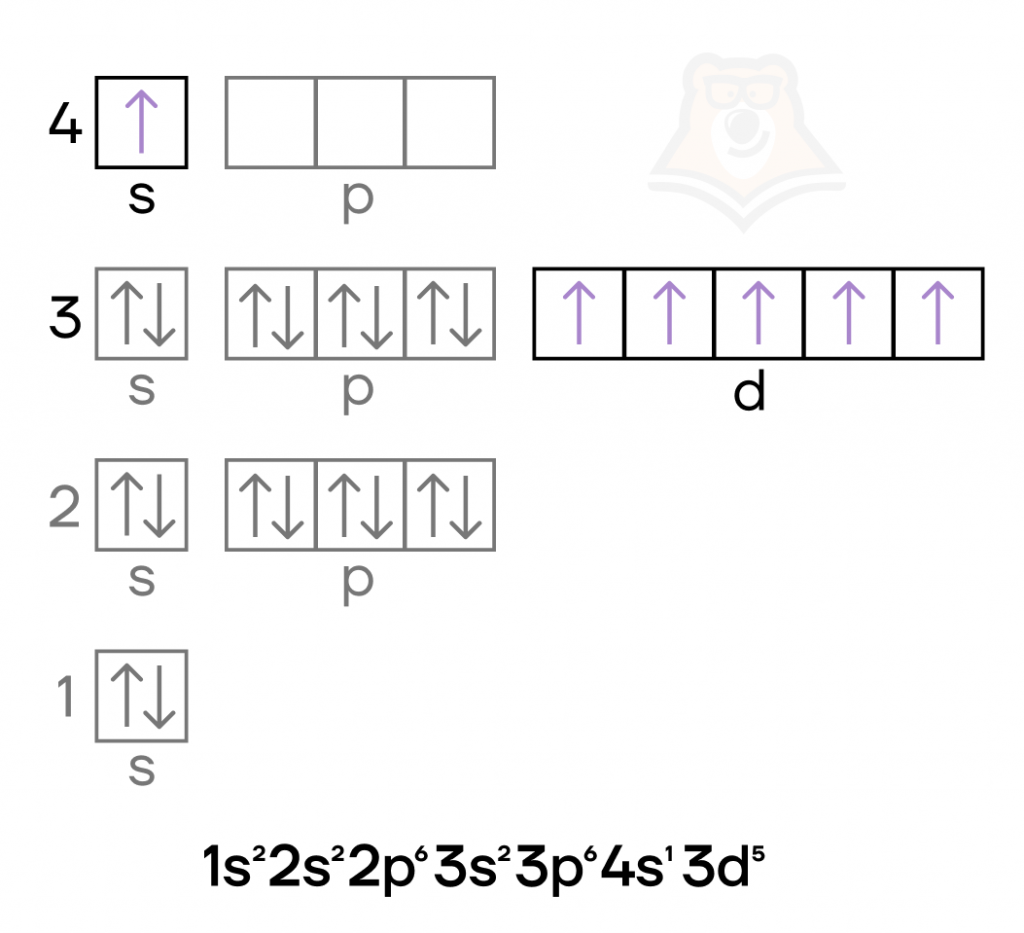
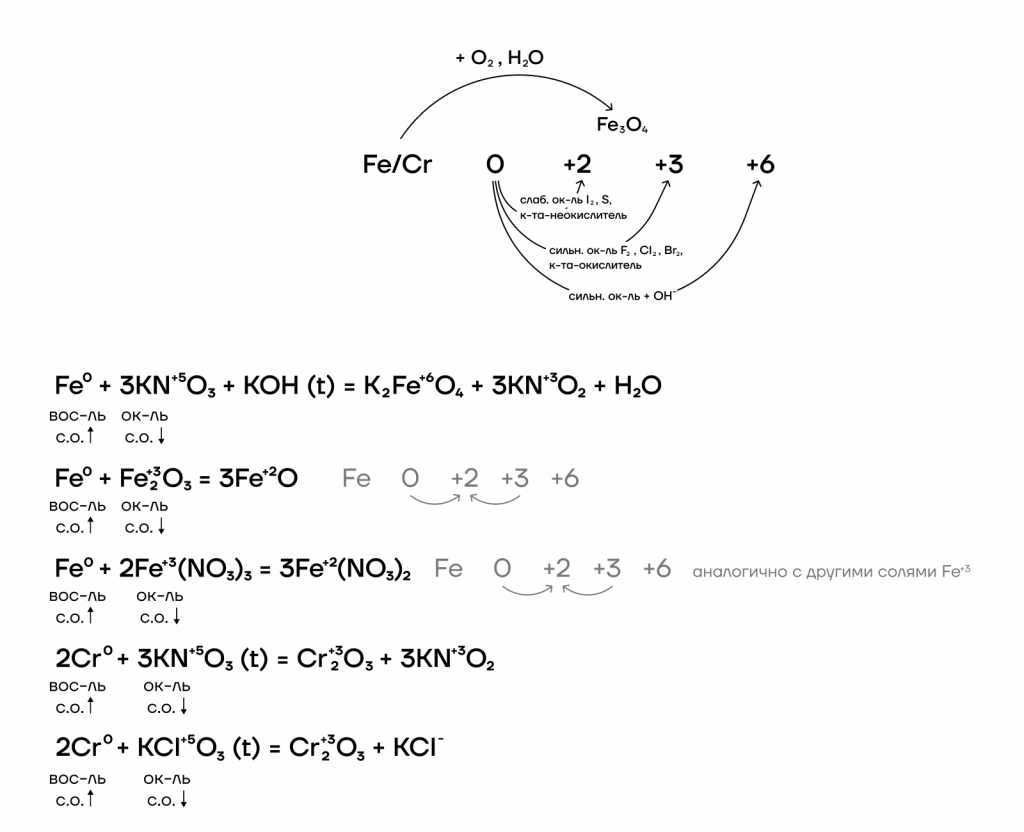
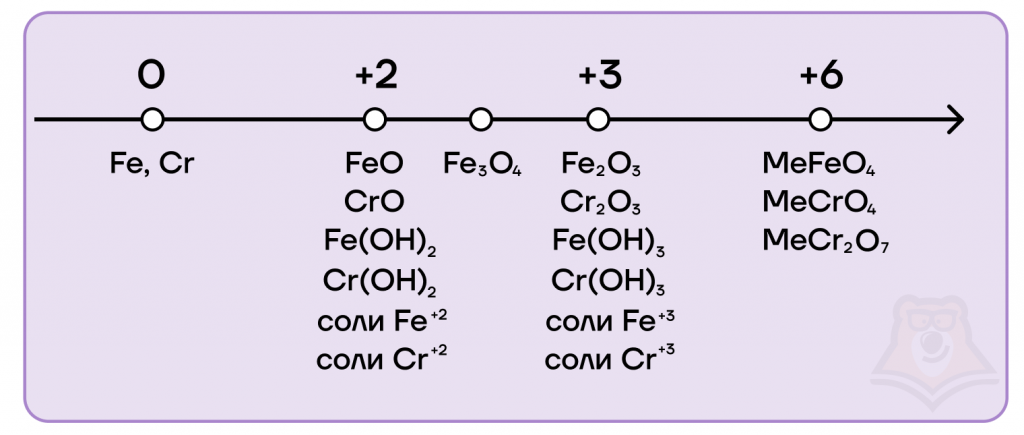
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
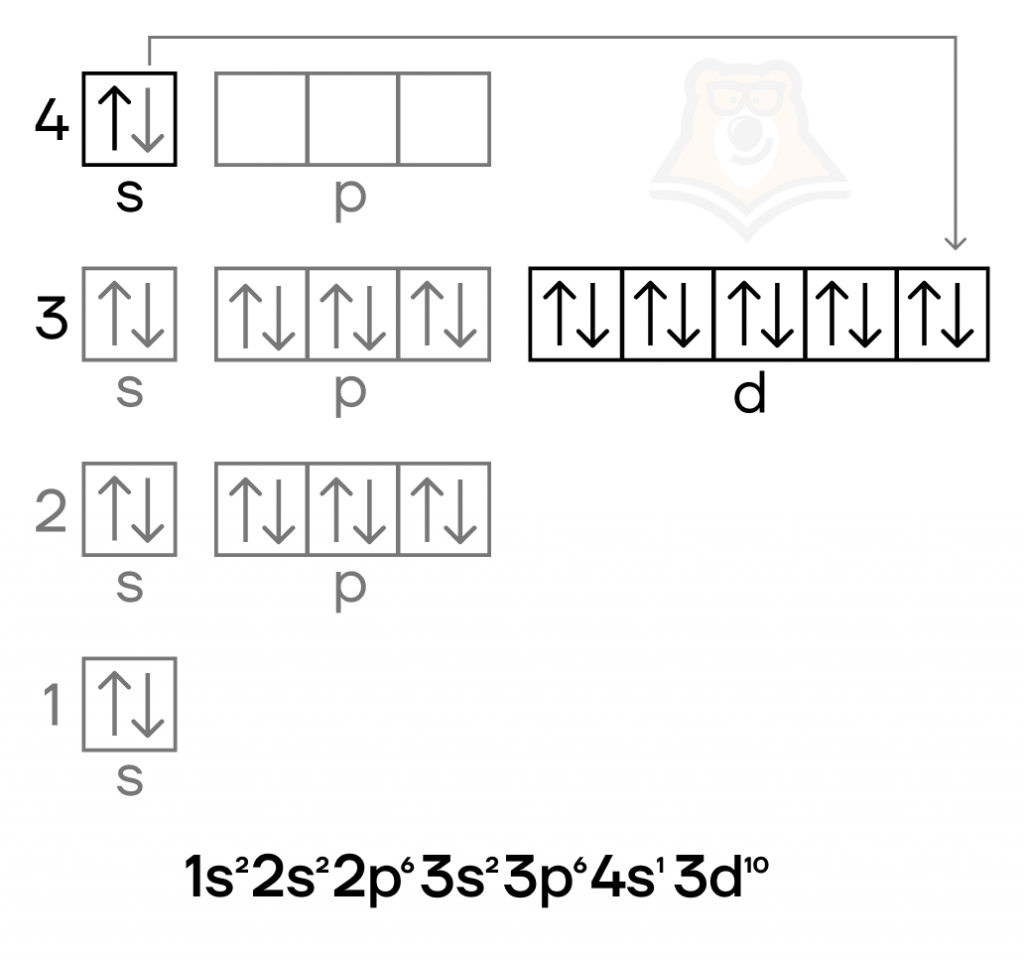
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
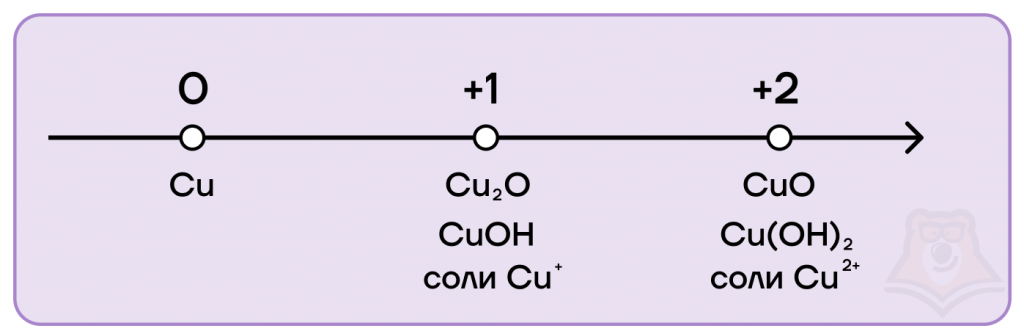
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Способы получения
Основным способом получения меди, хрома и железа является пирометаллургия, то есть различные реакции, происходящие при высоких температурах.

Химические свойства
- Взаимодействие с простыми веществами
Как и другие металлы, железо и хром способны взаимодействовать со своими противоположностями, неметаллами, с образованием различных бинарных соединений.
При этом неметаллы, являющиеся сильными окислителями, окисляют железо и хром до +3, а неметаллы, являющиеся слабыми окислителями, — только до +2.
Железо и хром не реагируют с водородом и азотом ввиду неактивности последних. При взаимодействии с кислородом железо ржавеет: образуется смесь оксидов железа, то есть железная окалина Fe3O4.

Медь способна также окисляться до разных степеней окисления в зависимости от силы окислителя или его избытка/недостатка.
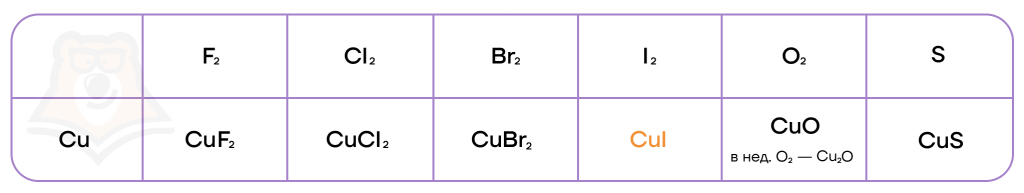
- Реакция с водой
Железо и хром являются металлами, стоящими в ряду активности до водорода, поэтому они могут вытеснять его из воды с образованием оксидов и вытесненного водорода.
Так как это металлы средней активности (стоящие в промежутке от алюминия до водорода) они реагируют с водой не при нормальных условиях, а при очень высокой температуре.
При взаимодействии с водой железо ржавеет: образуется железная окалина Fe3O4, как и в случае с кислородом.

Медь же находится в ряду активности после водорода, следовательно, она “слабее” водорода и не способна вытеснить такого сильного соперника.
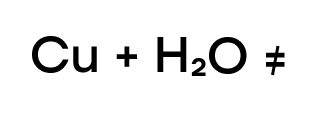
- Реакция с кислотами-неокислителями
Благодаря нахождению железа и хрома до водорода в ряду активности металлов они также способны вытеснять водород из растворов кислот-неокислителей.
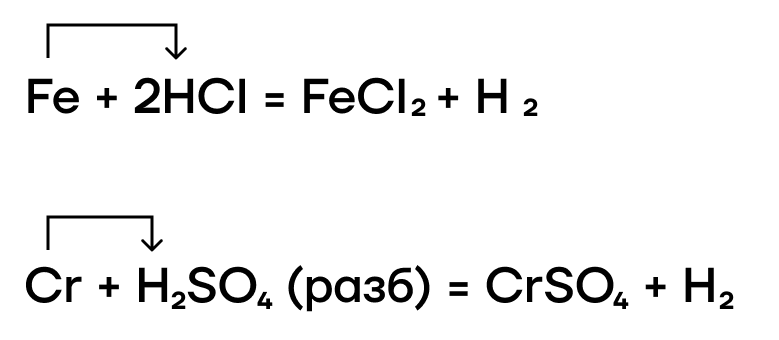
Так же, как и в случае с водой, медь не может вытеснить “качка”-водорода из таких кислот.
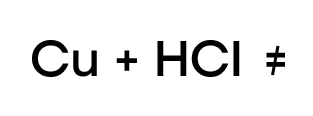
- Реакция с солями
Как и прочие металлы, железо, хром и медь могут вытеснять менее активные металлы из растворов их солей.
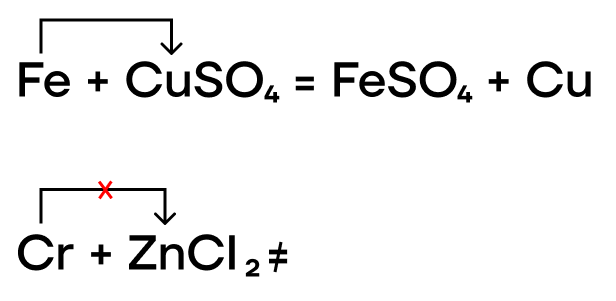
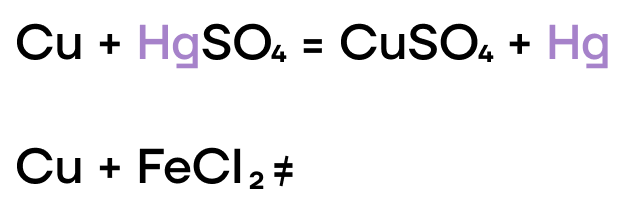
- Реакции с окислителями
Из-за низких значений электроотрицательности, железо, хром и медь являются типичными восстановителями, а следовательно, способны реагировать с окислителями.
Ниже представлены различные способы повышения степеней окисления железа и хрома и основные реагенты, которые используются.
Фактчек
- Медь, железо и хром относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов;
- Возможные степени окисления железа и хрома: 0, +2, +3, +6. Возможные степени окисления меди: 0, +1, +2.
Проверь себя
Задание 1.
У атома какого химического элемента не наблюдается «проскок» электрона?
- Серебро;
- Медь;
- Железо;
- Хром.
Задание 2.
С какой солью будет реагировать медь?
- Хлорид натрия;
- Сульфат ртути(II);
- Хлорид железа(III);
- Фосфат кальция.
Задание 3.
Для какого металла характерна степень окисления +1?
- Хром;
- Кобальт;
- Железо;
- Медь.
Ответы: 1. — 3; 2. — 2; 3. — 4











_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75603835c9b4c3f5f38b8e8f4a5e944a987c67fc)







![{mathrm {AgCl+2NH_{3}longrightarrow [Ag(NH_{3})_{2}]Cl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cac786af7b949d81bb9c758530808687cacceb1d)
![{mathrm {Ag_{2}O+4NH_{3}+H_{2}Olongrightarrow 2[Ag(NH_{3})_{2}]OH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14b374212c0f4ca011ac320e602dabdcec8799ac)
![{mathrm {AgBr+2Na_{2}S_{2}O_{3}longrightarrow Na_{3}[Ag(S_{2}O_{3})_{2}]+NaBr}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d293fa3c92d39b178570c4f9fe828f91607ab653)


![{mathrm {Au+HNO_{3}+4HCllongrightarrow H[AuCl_{4}]+NOuparrow +2H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6d1be728ecb0fa000a3edeae53556e8bb2e201d)