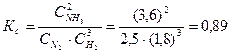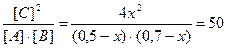Как определять исходную концентрацию вещества
Вещества, вступающие в химическую реакцию, претерпевают изменения состава и строения, превращаясь в продукты реакции. Концентрация исходных веществ уменьшается вплоть до нуля, если реакция идет до конца. Но может протекать обратная реакция, когда продукты распадаются на исходные вещества. В таком случае устанавливается равновесие, когда скорость прямой и обратной реакции становится одинаковой. Разумеется, равновесные концентрации веществ будут меньше исходных.

Инструкция
Произошла химическая реакция по схеме: А + 2Б = В. Исходные вещества и продукт реакции – газы. В какой-то момент установилось равновесие, то есть, скорость прямой реакции (А + 2Б = В) сравнялась со скоростью обратной (В = А + 2Б). Известно, что равновесная концентрация вещества А равна 0,12 моль/литр, элемента Б – 0,24 моль/литр, а вещества В – 0,432 моль/литр. Требуется определить исходные концентрации А и Б.
Изучите схему химического взаимодействия. Из нее следует, что один моль продукта (элемента В) образовывался из одного моля вещества А и двух молей вещества Б. Если в одном литре реакционного объема образовывалось 0,432 моля элемента В (по условиям задачи), то, соответственно, одновременно расходовалось 0,432 моля вещества А и 0,864 моля элемента Б.
Вам известны равновесные концентрации исходных веществ: [A] = 0,12 моль/литр, [Б] = 0,24 моль/литр. Прибавив к этим величинам те, которые были израсходованы в ходе реакции, вы получите величины исходных концентраций: [A]0 = 0,12 + 0,432 = 0,552 моль/литр; [Б]0 = 0,24 + 0,864 = 1,104 моль/литр.
Также вы можете определить исходные концентрации веществ с помощью константы равновесия (Кр) – отношения произведений равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа равновесия рассчитывается по формуле: Кр = [C]n [D]m /([A]0x[B]0y), где [C] и [D] – равновесные концентрации продуктов реакции С и D; n, m – их коэффициенты. Соответственно, [A]0, [В]0 – равновесные концентрации элементов, вступающих в реакцию; x,y – их коэффициенты.
Зная точную схему протекающей реакции, равновесную концентрацию хотя бы одного продукта и исходного вещества, а также величину константы равновесия, можно записать условия этой задачи в виде системы двух уравнений с двумя неизвестными.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
На чтение 4 мин Просмотров 4.6к. Опубликовано 04.07.2019
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): 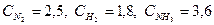
Определяем константу равновесия Кс этой реакции:
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс =
Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8447 — 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «исходные концентрации» — это концентрации веществ до начала протекания химической реакции, то есть превращения их в другие вещества. Разумеется, такое преобразование сопровождается уменьшением их количества. Соответственно, снижаются и концентрации исходных веществ, вплоть до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в эквивалентных количествах.
Предположим, перед вами поставлена следующая задача. Протекала некая химическая реакция, в ходе которой исходные вещества, принятые как А и Б, превращались в продукты, например, условно В и Г. То есть реакция проходила по следующей схеме: А + Б = В + Г.При концентрациях вещества Б равным 0,05 моль/л, а вещества Г — 0,02 моль/л, установилось некое химическое равновесие. Необходимо определить, какова начальная концентрация веществ А0 и Б0, если константа равновесия Кр равна показателю 0,04?
Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также вспомните, что константа равновесия Кр исчисляется по следующей формуле: [В][Г]/[А][Б].
В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
Теперь еще раз внимательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, начальную молярную концентрацию вещества А можно представить следующим образом:А0 = x + 0,02А0 = x + y
Вспомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в дальнейшем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда начальная концентрация [A0] равна 0,2 + 0,02 = 0,22 моль/л.
А как быть с веществом Б? Его начальная концентрация Б0 находится гораздо проще. Для определения к равновесной концентрации этого вещества надо прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Ответ будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.
Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «исходные концентрации» – это концентрации веществ до начала протекания химической реакции, то есть превращения их в другие вещества. Разумеется, такое преобразование сопровождается уменьшением их количества. Соответственно, снижаются и концентрации исходных веществ, вплоть до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в эквивалентных количествах.
Предположим, перед вами поставлена следующая задача. Протекала некая химическая реакция, в ходе которой исходные вещества, принятые как А и Б, превращались в продукты, например, условно В и Г. То есть реакция проходила по следующей схеме: А + Б = В + Г.При концентрациях вещества Б равным 0,05 моль/л, а вещества Г – 0,02 моль/л, установилось некое химическое равновесие. Необходимо определить, какова начальная концентрация веществ А0 и Б0, если константа равновесия Кр равна показателю 0,04?
Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также вспомните, что константа равновесия Кр исчисляется по следующей формуле: [В][Г]/[А][Б].
В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
Теперь еще раз внимательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, начальную молярную концентрацию вещества А можно представить следующим образом:А0 = x + 0,02А0 = x + y
Вспомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в дальнейшем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда начальная концентрация [A0] равна 0,2 + 0,02 = 0,22 моль/л.
А как быть с веществом Б? Его начальная концентрация Б0 находится гораздо проще. Для определения к равновесной концентрации этого вещества надо прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Ответ будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
Очень часто можно встретить задачу, в которой из одного раствора отбирают определенный объем и перемещают в другой объем растворителя, доводя его «до метки». Отобранный объем раствора называют аликвотой, а уровень, до которого доводят раствор – верхний или нижний мениск. Эти термины активно применяются в аналитической химии, при, так называемом, титриметрическом методе анализа. В данном случае мы говорим, что произошел процесс “разбавления“, то есть уменьшение концентрации вещества за счет добавления растворителя.
Как правило, в задачах, где имеются подобные формулировки, требуется найти либо количество вещества в исходном растворе, либо концентрацию исходного раствора, либо концентрацию вещества в разбавленном растворе.
Рассмотрим следующий пример разбавления:
40 г гидроксида натрия растворили в 500 мл колбе. Затем отобрали аликвоту пипеткой 50 мл и перенесли в колбу объемом 250 мл, добавив до уровня воду. Какая концентрация гидроксида натрия будет в разбавленном растворе?
Попробуем понять логику данной задачи. Вначале приготовили раствор с определенной концентрацией. Какой? Легко рассчитать, зная количество вещества гидроксида натрия (а его легко рассчитать, поделив массу гидроксида натрия на его молярную массу), и поделив это количество на объем раствора, выраженное в литрах.
Чему же равен объем полученного раствора? Объему сосуда, в котором он помещен, то есть 500 мл или 0,5 л. (Тогда концентрация гидроксида натрия составляет 2 моль/л. Проверь сам расчетами).
Что сделали дальше? Взяли часть вещества. Все вещество (1 моль) находится в объеме 500 мл, а взяли только 50 мл (аликвота показывает, сколько вещества взяли для дальнейшей работы). Тогда очевидно, количество вещества, которое окажется в аликвоте будет в 10 раз меньше того, что было в колбе (ведь взяли объем в 10 раз меньше – 50 мл от 500 мл).
И это количество составит всего 1/10, то есть 0,1 моль.
Что же дальше? А дальше это вещество поместили в 250 мл колбу и добавили воду до отметки, то есть довели объем раствора до данного значения (250 мл).
Опять не трудно рассчитать концентрацию полученного раствора: 0,1/0,250=0,4 моль/л.
Если мы теперь внимательно посмотрим на наши логические действия, то заметим, что все время умножали и делили одни объемы на другие.
При делении объема аликвоты на объем сосуда, в который помещается данная аликвота мы получаем “степень разбавления”. Умножая степень разбавления на исходную концентрацию раствора, мы получаем концентрацию разбавленного раствора. Вот и вся премудрость!
При нахождении концентрации исходного раствора поступаем с точностью до наоборот.
Загрузить PDF
Загрузить PDF
В химии разбавлением называют процесс, в результате которого уменьшается концентрация вещества в растворе. Последовательное разбавление состоит из повторных разведений, что позволяет очень быстро уменьшить первоначальную концентрацию.[1]
Этот метод используется в экспериментах, в которых требуются сильно разбавленные растворы с точной концентрацией, часто определяемой по логарифмической шкале, либо когда необходимо найти плотность бактерий. Последовательное разведение широко применяется в экспериментальных науках, таких как биохимия, микробиология, фармакология, физика.
-
1
Выберите подходящий растворитель. При разведении очень важно выбрать правильный растворитель, или буфер. Многие растворы можно разводить дистиллированной водой, однако это не всегда так. Если вы разбавляете бактерии или другие клетки, вам понадобится соответствующая культурная среда.[2]
Выбранный буфер следует использовать при всех последовательных разведениях.- Если вы не уверены в том, что лучше использовать в качестве буфера, спросите у учителя или поищите нужную информацию в интернете: возможно, кто-то уже готовил подобный раствор.
-
2
Приготовьте несколько пробирок с 9 миллилитрами буфера. Эти пробирки сыграют роль заготовок для разведения.[3]
Вы поместите разбавляемый образец в первую пробирку, а затем последовательно перельете раствор в следующие пробирки.- Перед началом работы полезно пометить все используемые пробирки, чтобы не спутать растворы в процессе разведения.
- Каждая следующая пробирка будет содержать в 10 раз менее концентрированный раствор, чем предыдущая.[4]
В первой пробирке концентрация раствора составит 1:10, во второй — 1:100, в третьей — 1:1000, и так далее. Заранее определите, сколько разведений вам понадобится, и приготовьте соответствующее число пробирок.
-
3
Приготовьте пробирку с хотя бы 2 миллилитрами неразбавленного раствора. Для последовательного разведения данным методом требуется не менее 1 миллилитра неразбавленного раствора. Если имеется всего лишь 1 миллилитр, то у вас не останется неразбавленного раствора. Напишите на этой пробирке НР (неразбавленный раствор).
- Перед каждым разведением тщательно перемешивайте раствор.[5]
- Перед каждым разведением тщательно перемешивайте раствор.[5]
-
4
Проведите первое разведение. Наберите в пипетку 1 миллилитр неразбавленного раствора из пробирки НР и перелейте его в пробирку с пометкой 1:10, в которой содержится 9 миллилитров буфера, после чего тщательно перемешайте. В результате у вас получится раствор, разбавленный 9 миллилитрами буфера. Таким образом, концентрация раствора уменьшится в 10 раз.
-
5
Приготовьте следующий раствор. Для второго последовательного разведения возьмите 1 миллилитр раствора из пробирки 1:10 и добавьте к 9 миллилитрам буфера в пробирке 1:100. Предварительно как следует перемешайте раствор в пробирке 1:10. После того как вы добавите раствор в пробирку 1:100, тщательно перемешайте ее содержимое. В результате вы разведете раствор из пробирки 1:10, и у вас получится новый раствор с концентрацией 1:100.
-
6
При необходимости продолжайте разводить раствор. Данный процесс можно повторять сколько угодно до тех пор, пока вы не достигнете нужной концентрации. Если в эксперименте следует определить зависимость от концентрации, можно последовательно приготовить растворы 1, 1:10, 1:100, 1:1000.
Реклама
-
1
Определите коэффициент разбавления конечного раствора. Для этого следует перемножить все последовательные коэффициенты разведения. Соответствующая формула имеет следующий вид: Dt = D1 x D2 x D3 x … x Dn, где Dt — общий коэффициент разведения, Dn — коэффициент n-го разведения.[6]
- Предположим, вы 4 раза провели разведение с соотношением 1:10. Подставим этот коэффициент в формулу и получим Dt = 10 x 10 x 10 x 10 = 10.000.
- Таким образом, после последнего разведения в четвертой пробирке получится раствор 1:10.000, то есть конечный раствор будет в 10.000 менее концентрированным, чем исходный (неразбавленный).
-
2
Определите концентрацию раствора после разведения. Чтобы определить концентрацию раствора после последовательного разведения, необходимо знать исходную концентрацию. Используйте формулу Cконечная = Cисходная/D, где Cконечная — концентрация разведенного раствора, Cисходная — исходная концентрация, D — определенный выше коэффициент разведения.[7]
- Пример: если концентрация исходного раствора составляла 1.000.000 клеток на миллилитр, а коэффициент разведения равен 1.000, чему равна концентрация конечного раствора?
- Используем формулу:
- Cконечная = Cисходная/D
- Cконечная = 1.000.000/1.000
- Cконечная = 1.000 клеток на миллилитр.
-
3
Проверьте размерность. При проведении любых расчетов следует удостовериться, что вы получили правильные единицы измерения.[8]
Если вы начали с количества клеток на миллилитр, проследите, чтобы результат также был получен в этих единицах. Если вы проводите расчеты в промилле (ppm), полученная концентрация также должна быть выражена в промилле.Реклама
Об этой статье
Эту страницу просматривали 49 565 раз.