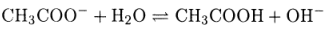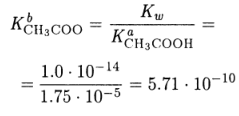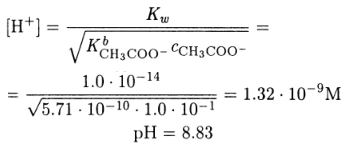Рассчитайте рН 0.10 М раствора ацетата натрия.
Решение. Константы основности ацетат-иона
в справочных таблицах нет, рассчитаем ее
Величина константы диссоциации указывает на то, что ацетат-ион очень слабое основание. В таких случаях, строго говоря, следует учитывать диссоциацию воды. Но поскольку по условию задачи концентрация раствора достаточно велика, диссоциацией воды можно пренебречь и для расчета использовать формулу
Примеры задач с решениями:
Рассчитайте рН 0.10 М раствора ацетата натрия
Теория
Расчет рН растворов слабых оснований
Вычислите рН раствора, константу и степень гидролиза ацетата натрия
Polina Bondarenko
Ученик
(90),
закрыт
1 год назад
если концентрация CH3COONa равна 0,001 моль/л, КCH3COOН = 1,74·10-5
jane
Высший разум
(406805)
2 года назад
CH3COONa – соль, образованная слабой кислотой и сильным основанием, подвергается гидролизу по аниону. (pH>7)
CH3COONa + НОН = CH3COOH + NaOH
Кг = Kw/Ka=10^-14 / 1.74*10^-5 = 5.75*10^-10 – константа гидролиза
h=√Кг/С=√(5.75*10^-10 / 0,001)=7.58 *10^-4 – степень гидролиза
[OH-] = h*C=7.58 *10^-4*0.001=7.58*10^-7 моль/л
или [OH-]=√(Kг*C)
pOH=-lg[OH-]=6.12
pH=14-pOH=7.88
для таких солей
pH=7+0.5(lgCs + pKa)
pKa=-lgKa =4.76
Евгений902
2 года назад
7
Знания
Химия
1 ответ:
valentina tursunova [7]2 года назад
0
0
Пишем уравнения гидролиза
Считаем константу гидролиза (константа диссоциации уксусной кислоты = 1.74·10⁻⁵)
Считаем степень гидролиза
Считаем рОН
Считаем рН
Читайте также
Выпишите, какая масса железа входит в состав оксида железа (III) массой 60 грамм.
n1ze [3]
Кажется так………………………………………………………………юю…
0
0
2 года назад
Прочитать ещё 2 ответа
Помогите ПОЖАЛУЙСТА !! 1.Рассчитайте массу , по известному количеству вещества !!! Вариант 25 Формула вещества : СН4 n,моль : 12
Каакринолаас [1]
M(CH4)=16г/моль
1 моль – 16г/моль
12моль – x
x=192г/моль
0
0
2 года назад
Реакции, идущее без катализатора, называются …?
Rum
Некаталитические реакции- это химические реакции,идущие без присутствия катализатора.
0
0
2 года назад
Помогите н2so4 степень окисления
Viaris
Степень окисления H +1 , S +6 , O -2
0
0
1 год назад
Барий находится вВыберите один ответ:a. 2 группе 7 периодаb. 2 группе 5 периодаc. 2 группе 6 периодаd. 1 группе 6 периода
Shaxzodd
Ответ:
С. 2 группа 6 период…………………
0
0
2 года назад
Прочитать ещё 2 ответа
АС
Алеся Смирнова
V(p-pa) = 500 мл = 0,5 л
m(CH3COONa) = 4,1 г
Ацетат натрия – соль образованная слабой кислотой CH3COOН и сильным основанием NaOH. В водном растворе ацетат натрия подвергнется гидролизу по аниону.
CH3COONa + НОН ↔ CH3COOH + NaOH
CH3COO(-) + HOH ↔ CH3COOH + OH(-) (pH > 7 – среда щелочная)
Количество вещества ацетата натрия в растворе
n(CH3COONa) = m(CH3COONa)/M(CH3COONa) = 4,1/82 = 0,05 моль
Молярная концентрация раствора ацетата натрия
См (CH3COONa) = n(CH3COONa)/V(p-pa) = 0,05/0,5 = 0,1 моль/л = 0,1М
Константа гидролиза соли, образованной слабой кислотой и сильным основанием.
Kh = Kw/Kd(кислоты)
Kw = 10^(-14) – ионное произведение воды
Kd(CH3COOH) = 1,8*10^(-5) – константа диссоциации уксусной кислоты
Константа гидролиза ацетата натрия
Kh(CH3COONa) = Kw/Kd(CH3COOH) = 10^(-14)/1,8*10^(-5) = 5,56*10^(-10)
Степень гидролиза ацетата натрия
α = √( Kh(CH3COONa)/См (CH3COONa)) = √(5,56*10^(-10)/0,1) = 7,46*10^(-5)
Молярная концентрация ионов OH(-) в растворе
[OH(-)] = α*См (CH3COONa) = 7,46*10^(-5)*0,1 = 7,46*10^(-6) моль/л
Показатель ионов OH(-) в растворе
рОН = – lg[OH(-)] = – lg7,46*10^(-6) = 5,13
Водородный показатель
рН = 14 – рОН = 14 – 5,13 = 8,87 > 7 – среда щелочная
Рассчитайте ph буферного раствора, содержащего в 1 литре 0,1 моль уксусной кислоты (CH3COOH) и 0,01 моль ацетата натрия (CH3COONa). Константа диссоциации уксусной кислоты (CH3COOH) равна 1,75 ⋅ 10-5.
Решение задачи
Буферные растворы – растворы, одновременно содержащие слабую кислоту и ее соль (слабое основание и его соль) и обладающие свойством сохранять практически неизменной концентрацию ионов водорода при разбавлении, добавлении небольших количеств кислот или щелочей.
ph буферного раствора Для любой слабой кислоты HA:
При добавлении к раствору слабой кислоты MeA раствора сильного электролита (соли этой кислоты) концентрация аниона А— значительно возрастает за счет диссоциации соли. Так как сильные электролиты диссоциируют практически полностью, то концетрацию аниона А— можно считать равной концентрации соли:
С А+= С соли.
Концентрацию недиссоциированной части слабой кислоты можно приравнять к общей концентрации кислоты, пренебрегая очень малой долей распавшихся иолекул:
С HA = C кисл.
Отсюда:
В данном случае получаем:
С H+ = 1,75 ⋅ 10-5 ⋅ 0,1 /0,01 = 1,75 ⋅ 10-4 (моль/л).
Вычислим водородный показатель ph буферного раствора по формуле:
Водородный показатель (ph) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH буферного раствора = -lg 1,75 ⋅ 10-4 = 3,76.
Ответ:
ph буферного раствора 3,76.