Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH–]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН–]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН–]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1–
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH–
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH–]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН–]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH–]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH–]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
Определите pH кислоты (0,17 нормальной уксусной кислоты (CH3COOH)), константа диссоциации которой равна 1,75 ⋅ 10-5.
Решение задачи
Константа и степень диссоциации слабого электролита связаны между собой соотношением:
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Определить pH кислоты
Получаем:
Определяем концентрацию ионов водорода [H+]:
[H+] = 0,17 ⋅ 1 ⋅ 10-2 = 0,17 ⋅ 10-2 (моль/л).
Определим pH кислоты (CH3COOH) по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH (CH3COOH) = -lg 0,17 ⋅ 10-2 = 2,77.
Ответ:
водородный показатель раствора 2,77.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3/2004
§ 7.2. Слабые кислоты и основания
Если вы будете заниматься исследовательской
работой, вам понадобится знание среды раствора и
его рН. Сейчас вы познакомитесь с растворами
слабых электролитов, узнаете, как рассчитать рН
раствора, зная концентрацию соли и константу
равновесия диссоциации слабого электролита.
Расчет концентрации ионов водорода и
гидроксид-ионов в растворах слабых кислот и
слабых оснований несколько сложнее, чем расчет
для сильных кислот и оснований (щелочей), и
проводится с использованием констант их
диссоциации.
Уксусная кислота – слабый электролит и в очень
незначительной степени диссоциирует по
уравнению:
СН3СООН = СН3СОО– + Н+.
Константа диссоциации (равновесия) К
уксусной кислоты:
Ккисл = [СН3СОО–]
[Н+]/[СН3СООН].
Учитывая, что в растворе уксусной кислоты
концентрации ионов водорода и ацетат-ионов
равны, т.е. [СН3СОО–] = [Н+], а сама
она – слабый электролит и поэтому в состоянии
диссоциации находится лишь малая часть ее
молекул, концентрацию непродиссоциировавших
молекул СН3СООН можно считать равной
концентрации кислоты скисл. Тогда
получаем:
Ккисл = [Н+]2/скисл,
откуда
Пример. Константа диссоциации
уксусной кислоты (данные справочника) равна:
Ккисл = 1,86•10–5. Требуется
рассчитать концентрацию ионов водорода и рН в 0,1М
и 0,01М растворах уксусной кислоты.
Для 0,1М раствора имеем:
рН = –lg (1,36•10–3) = 2,87.
Посмотрим, как скажется на концентрации ионов
водорода и рН раствора разбавление в 10 раз.
Для 0,01М раствора имеем:
рН = –lg (4,31•10–4) = 3,37.
Разбавление уксусной кислоты в 10 раз привело к
понижению концентрации ионов водорода в 1,36•10–3/4,31•10–4
= 3,1 раза, при этом рН повысился на 3,37 – 2,87 = 0,5
единицы рН.
Вспомните, как изменится концентрация ионов
водорода и рН при разбавлении в 10 раз 0,1М
раствора соляной кислоты.
Аналогично определяют
концентрацию ионов водорода и рН раствора
гидроксида аммония:
NH4OH = + OH–,
константа диссоциации которого равна Косн
= 1,79•10–5. Сначала рассчитывают
концентрацию гидроксид-ионов:
и рОН. затем – концентрацию ионов водорода:
[Н+] = Кв/[ОН–] = 10–14/[ОН–]
и определяют рН = 14 – рОН. В 0,01М растворе
гидроксида аммония рН = 10,6. Проверьте.
Если в растворе сильной кислоты или сильного
основания увеличить концентрацию одноименного
иона введением соответствующей соли, например в
раствор НСl или NаОН добавить хлорид натрия NаCl, то
концентрации ионов водорода или гидроксид-ионов
практически не изменяются. Если же такую
операцию, т. е. увеличение концентрации
одноименного иона, провести с раствором слабой
кислоты или слабого основания, то наблюдается
резкое изменение рН раствора.
Рассмотрим, как изменится рН раствора уксусной
кислоты при введении в раствор ацетата натрия
NаСН3СОО, т. е. одноименного
ацетат-иона СН3СОО–.
Согласно принципу Ле Шателье равновесие реакции
диссоциации
сместится влево в результате увеличения
концентрации ацетат-ионов СН3СОО–,
образующихся при полной диссоциации ацетата
натрия как сильного электролита. Такое смещение
равновесия диссоциации уксусной кислоты
означает уменьшение концентрации ионов
водорода, т. е. увеличение рН раствора.
Пример. Рассчитать рН 0,01М
раствора уксусной кислоты, содержащей 0,01 моль/л
ацетата натрия NаСН3СОО.
В выражении константы равновесия
Ккисл = [СН3СОО–][Н+]/[СН3СООН]
= 1,86•10–5
концентрация ацетат-ионов определяется в
основном концентрацией хорошо диссоциирующей
соли NаСН3СОО. Поэтому можно записать:
Из этого соотношения находим концентрацию
ионов водорода:
Откуда рН = 4,73.
Таким образом, в результате введения в 1 л 0,01М
раствора уксусной кислоты 0,01 моль
NаСН3СОО концентрация ионов водорода
уменьшилась в 23 раза (4,31•10–4/1,86•10–5 =
23), а значение рН возросло на 1,36 (4,73 – 3,37 = 1,36)
единицы (значение рН = 3,37 из предыдущего примера).
Аналогично при введении в раствор
слабого основания NН4ОН хлорида аммония NH4Cl
положение равновесия диссоциации гидроксида
аммония смещается в менее основную область и
среда раствора становится более кислотной:
Следовательно, одноименный ион (за исключением
иона водорода и гидроксид-иона), введенный в
раствор слабой кислоты или слабого основания,
изменяет рН таким образом, что среда раствора
приближается к нейтральной. Одноименные ионы в
такого типа системах ведут себя как
нейтрализующие агенты: анион нейтрализует
слабую кислоту, выполняя роль основания, а катион
нейтрализует слабое основание, выполняя роль
кислоты. Такое необычное, с нашей точки зрения,
поведение веществ характерно для многих явлений
природы, показывая нам всеобщую связь и
взаимозависимость объектов окружающего нас мира
и нас самих от него.
О.С.ЗАЙЦЕВ
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 августа 2021 года; проверки требует 71 правка.
У этого термина существуют и другие значения, см. Константа.
Константа диссоциации кислоты Ka (также известная как константа кислотности) — константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д. Чем больше значение Ka, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная.
Примеры расчета[править | править код]
Одноосновная кислота[править | править код]
| Реакция | Ka |
|---|---|

|
![{displaystyle K_{{ce {a}}}={frac {[{ce {A^-}}][{ce {H+}}]}{{ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c21fe924187bc7d37588add5f341b1078833e09)
|
где A– — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы HA.
Двухосновная кислота[править | править код]
| Реакция | Ka |
|---|---|

|
![K_{a1} = {left[ H^+ right] left[ HA^- right] over left[ H_2A right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e863392d0d4cee771806c0c9d92a889419809ce)
|

|
![K_{a2} = {left[ H^+ right] left[ A^{2-} right] over left[ HA^- right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a8164a0d8570fb170ab8dc3ec9f1fdea61fdb28)
|
Фигурирующая в выражениях концентрация [H2A] — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величины pKa и pH[править | править код]
Чаще вместо самой константы диссоциации 


.
Величины pKa и pH связаны уравнением Гендерсона — Хассельбаха.
Уравнение Гендерсона — Хассельбаха[править | править код]
Преобразование уравнения[править | править код]
Пусть



|

|

|

|

|

|

|

|
Преобразуем уравнение
![{displaystyle {ce {pH}}=mathrm {p} K_{mathrm {a} }+lg left(mathrm {frac {[A^{-}]}{[HA]}} right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9629f69c46b4bc19ae8dc5247fdebd352c49a47e)


Можно заметить, что при 




|

|
В более кислой среде диссоциация кислоты уменьшается | ![{displaystyle [A^{-}]<[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/201d1def47ab475d61324c303a92a7ebc3250a44)
|

|

|
Равновесие концентраций кислоты и её соли | ![{displaystyle [A^{-}]=[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/031203f1a841069368f93efd675de837ca6ce1b6)
|

|

|
В более щелочной среде диссоциация кислоты увеличивается | ![{displaystyle [A^{-}]>[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ea7c1e23781e8480fab99ad497f97693b3ed434)
|
Другая связь pKa и pH[править | править код]

|

|

|

|

|

|

|

|
![{displaystyle K={[A^{-}][H^{+}] over [HA]}={[H^{+}]^{2} over [HA]}, [H^{+}]={sqrt {mathrm {K_{a}c} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edbd927f4effa53ebcf3d228cb33b71ea5379589)

пример нахождения pH[править | править код]
Найти pH раствора 0,1 M Na2CO3
pKa1(H2CO3) = 6.3696
pKa2(H2CO3) = 10.3298
Решение:
Na2CO3 + H2O = NaOH + NaHCO3

откуда получаем


Значение pH > 7 означает, что соль Na2CO3 даёт щелочную среду
Константа диссоциации основания Kb[править | править код]


| Реакция | K |
|---|---|

|
![{displaystyle K_{{ce {a}}}={frac {[{ce {A^-}}][{ce {H+}}]}{{ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c21fe924187bc7d37588add5f341b1078833e09)
|

|
![{displaystyle K_{b}={frac {[{mathsf {BH^{+}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {B}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/51e04dfbb17bc371ca2e05d7fe7a1e5be4cd9dae)
|



Константы диссоциации некоторых соединений[править | править код]
Кислотность воды pKa (H2O) = 15,74
Чем больше pKa , тем более основное соединение; чем меньше pKa , тем соединение более кислотное.
Например, по значению pKa можно понять, что спирты проявляют основные свойства (их pKa больше, чем у воды), а фенолы проявляют кислотные свойства.

Также по pKa можно установить ряд сил кислот, приведённый в российских школьных учебниках
| Название | Кислота | pKa1 | pKa2 | pKa3 |  при С = 1 моль/л, % при С = 1 моль/л, %
|
|
|---|---|---|---|---|---|---|
| Сильные
кислоты |
Йодоводородная | HI | -10 | 100 | ||
| Хлорная | HClO4 | -10 | 100 | |||
| Бромоводородная | HBr | -9 | 100 | |||
| Соляная (хлороводородная) | HCl | -7 | 100 | |||
| Серная | H2SO4 | -3 | 1.92 | 99,90 | ||
| Селеновая | H2SeO4 | -3 | 1.9 | 99,90 | ||
| Гидроксоний | H3O+ | -1.74 | 15.74 | 21 | 98,24 | |
| Азотная | HNO3 | -1.4 | 96,31 | |||
| Хлорноватая | HClO3 | -1 | 91,61 | |||
| Иодноватая | HIO3 | 0.8 | 32,67 | |||
| Средние
кислоты |
Сульфаминовая | NH2SO3H | 0.99 | 27,28 | ||
| Щавелевая | H2C2O4 | 1.42 | 4.27 | 17,69 | ||
| Йодная | H5IO6 | 1.6 | 14,64 | |||
| Фосфористая | H3PO3 | 1.8 | 6.5 | 11,82 | ||
| Сернистая | H2SO3 | 1.92 | 7.20 | 10,38 | ||
| Гидросульфат | HSO4– | 1.92 | 10,38 | |||
| Фосфорноватистая | H3PO2 | 2.0 | 9,51 | |||
| Хлористая | HClO2 | 2.0 | 9,51 | |||
| Фосфорная | H3PO4 | 2.1 | 7.12 | 12.4 | 8,52 | |
| Гексаакважелеза (III) катион | [Fe(H2O)6]3+ | 2.22 | 7,47 | |||
| Мышьяковая | H3AsO4 | 2.32 | 6.85 | 11.5 | 6,68 | |
| Селенистая | H2SeO3 | 2.6 | 7.5 | 4,89 | ||
| Теллуристая | H2TeO3 | 2.7 | 7.7 | 4,37 | ||
| Фтороводородная (плавиковая) | HF | 3 | 3,11 | |||
| Теллуроводородная | H2Te | 3 | 12.16 | 3,11 | ||
| Слабые
кислоты |
Азотистая | HNO2 | 3.35 | 2,09 | ||
| Уксусная | CH3COOH | 4.76 | 0,4160 | |||
| Гексаакваалюминия (III) катион | [Al(H2O)6]3+ | 4.85 | 0,3751 | |||
| Угольная | H2CO3 | 6.37 | 10.33 | 0,0653 | ||
| Сероводородная | H2S | 6.92 | 13 | 0,0347 | ||
| Дигидрофосфат | H2PO4– | 7.12 | 12.4 | 0,0275 | ||
| Хлорноватистая | HClO | 7.25 | 0,0237 | |||
| Ортогерманиевая | H4GeO4 | 8.6 | 12.7 | 0,0050 | ||
| Бромноватистая | HBrO | 8.7 | 0,0045 | |||
| Ортотеллуровая | H6TeO6 | 8.8 | 11 | 15 | 0,0040 | |
| Мышьяковистая | H3AsO3 | 9.2 | 0,0025 | |||
| Синильная (циановодородная) | HCN | 9.21 | 0,0025 | |||
| Ортоборная | H3BO3 | 9.24 | 0,0024 | |||
| Аммоний | NH4+ | 9.25 | 0,0024 | |||
| Ортокремниевая | H4SiO4 | 9.5 | 11.7 | 12 | 0,0018 | |
| Гидрокарбонат | HCO3– | 10.4 | 6,31*10^-4 | |||
| Иодноватистая | HIO | 11.0 | 3,16*10^-4 | |||
| Пероксид водорода | H2O2 | 11.7 | 1,41*10^-4 | |||
| Гидрофосфат | HPO42- | 12.4 | 6,31*10^-5 | |||
| Гидросульфат | HS– | 14.0 | 1,00*10^-5 | |||
| Вода | H2O | 15.7 | 21 | 1,41*10^-6 | ||
| Основания | Гидроксид | OH– | 21 | 3,16*10^-9 | ||
| Фосфин | PH3 | 27 | 0 | |||
| Аммиак | NH3 | 33 | 0 | |||
| Метан | CH4 | 34 | 0 | |||
| Водород | H2 | 38.6 | 0 |
См. также[править | править код]
- Буферные растворы
- Титрование
- Степень диссоциации
- Изоэлектрическая точка
- pH
Примечания[править | править код]
- ↑ Primchem 2002. Дата обращения: 14 октября 2021. Архивировано 23 октября 2021 года.
§ 1. Что такое pH и как его считать
Начнём с того, что молекулы в растворах распадаются на заряженные частицы. Этот процесс называется
диссоциацией. Например, если растворить поваренную соль (`NaCl`), произойдёт такой распад:
`NaCl harr Na^+ + Cl^-`
Как ни странно, вода также может диссоциировать:
`H_2O harr OH^(-) + H^+`
Однако вода диссоциирует очень слабо – к этому способна лишь одна молекула из миллионов. Другие молекулы
могут быть более активными. Количество молекул вещества, которые диссоциируют на ионы определяется
константой диссоциации. Константа диссоциации для воды расчитывается так:
`K_д = ([H^+][OH^-])/([H_2O])`
То есть это умноженные концентрации ионов, делённые на концентрацию не распавшихся (недиссоциировавших)
молекул.
Константа диссоциации для воды равна `1.8 * 10^(-16)`
От константы диссоциации воды можно придти к другому термину – ионному произведению воды. Как
видно
из названия, это произведение концентраций ионов, на которое распадается вещество.
`K_(H_2O) = [H^+][OH^-] = 10^(-14)`
Ионное произведение воды является константой. Как видно из уравнения диссоциации чистой воды, число
частиц `H^+` равно числу частиц `OH^-`, а следовательно
`[H^+] = [OH^-] = 10^(-7)`
Теперь перейдём непосредственно к pH, который также называют водородным показателем.
pH это просто отрицательный десятичный логарифм от концентрации ионов `H^+`. То есть
`pH = -lg[H^+]`
Таким образом, зная концентрацию ионов `H^+` и имея под рукой калькулятор, можно вычислить pH
раствора.
Так, pH чистой воды равен 7 (исходя из ионного произведения воды) то есть среда нейтральная.
Если pH меньше 7, то раствор будет иметь кислую среду, если больше – то щелочную.
Но почему кислоты дают именно кислую среду, а щёлочи – щелочную?
Рассмотрим диссоциацию угольной кислоты:
`H_2CO_3 harr H^+ + HCO_3^-`
Как видно из этого уравнения, при диссоциации кислоты образуются ионы `H^+`. Соответственно,
концентрация этих ионов увеличивается, а логарифм (как и pH) уменьшается.
Если в растворе находится щёлочь (например гидроксид натрия), то концентрация ионов `H^+`
уменьшается, так
как образующиеся `OH^-` группы связываются с ними, pH при этом повышается:
`NaOH harr Na^+ + OH^-`
`OH^(-) + H^+ harr H_2O`
Минимальный pH равен 0, в то время как максимальный равен 14 (отрицательный логарифм от ионного
произведения воды).
Иногда нам может быть неизвестна концентрация ионов `H^+`, например когда по условию задачи мы
расстворяем щёлочь. Предположим, у нас есть 1 литр раствора, в котором содержится 0.1 моль гидроксида
натрия
и все молекулы распадаются на ионы. Тогда, согласно уравнению
`NaOH harr Na^+ + OH^-`
концентрация ионов `OH^-` также будет равна 0.1 моль/литр. Исходя из ионного произведения воды,
мы
можем
вычислить концентрацию `H^+`:
`[H^+][OH^-] = 10^(-14)`
`[H^+]*0.1 = 10^(-14)`
`[H^+] = 10^(-14) / 0.1 = 10^(-13)`
`pH = -lg10^(-13) = 13`
Однако, в данном случае лучше пользоваться показателем pOH. pOH – это тот же обратный десятичный
логарифм, но от концентрации ионов `OH^-`:
`pOH = -lg[OH^-]`
pH и pOH связаны отношением
`pOH + pH = 14`
Используя это, задачу можно решить так:
`pOH = -lg0.1 = 1`
`pH = 14 – pOH = 13`
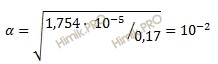
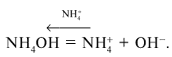
![{displaystyle {ce {pH}}=-lg[{ce {H+}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fb43b7346dc0490df1187e80e7332ce1ecc396f9)
