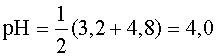Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH–]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН–]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН–]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1–
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH–
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH–]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН–]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH–]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH–]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
1.1.2. рН смеси растворов двух слабых кислот или оснований
Смешаем растворы, в одном из которых содержится слабая кислота А1, а в другом – слабая кислота А2. Таким образом, смесь представляет собой сочетание двух сопряженных кислотно-основных пар А1/В1 и А2/В2, а также воду как растворитель, но собственную диссоциацию воды в дальнейших рассуждениях учитывать не будем.
Пусть кислота А1 сильнее, чем кислота А2, тогда основание В2 сильнее, чем основание В1, то есть в растворах до их сливания рН1 < pH2, pK1 > > pK2.
После смешивания растворов в смеси установится равновесие, характеризующееся тем, что в ходе его установления А1 будет являться донором протонов, а В2 – их акцептором:
А1 D В1 + Н+
В2 + Н+ D А2
А1 + В2 D В1 + А2 (9)
Система в состоянии равновесия описывается уравнением (9). Обратим внимание на то, что в этом состоянии [B1] = [A2], а [A1]= [B2]. В ходе установления равновесия рН1 и рН2 сравняются и установится новое значение рН раствора, которое можно найти путем суммирования выражений рН1 и рН2 отдельных кислотно-основных пар, учитывая, что к моменту достижения равновесия в системе рН1=рН2=рН:
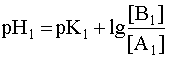
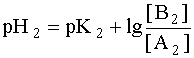
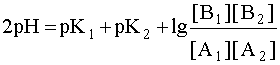
Поскольку дробь под знаком логарифма равна единице, то окончательно имеем:
2рН = рК1 + рК2
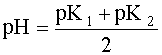
Полученное выражение позволяет сделать весьма важный вывод:
если в водном растворе сосуществуют две сопряженные кислотно-основные пары, то рН такого раствора не зависит от исходных концентраций содержащихся в нем форм, а зависит только от констант кислотности сосуществующих пар.
Данный вывод позволяет рассчитать рН растворов в некоторых особых случаях, что можно пояснить с помощью следующих примеров.
1. рН раствора соли слабого основания и слабой кислоты. Классическим примером такой соли является ацетат аммония NH4CH3COO. В водном растворе эта соль, будучи хорошо растворимой, существует в виде своих ионов:
NH4CH3COO D NH4+ + CH3COO–
С другой стороны, эти ионы в водной среде входят в состав сопряженных кислотно-основных пар, каждая из которых характеризуется своей константой кислотности:
NH4+ + H2O D NH3 + H3O+; ; pK1 = 9,2
CH3COO–– + H2O D CH3COOH + OH–; ; pK2 = 4,8
Катион аммония является кислотой, а ацетат-анион – основанием, поэтому эти ионы могут обмениваться протонами не только с растворителем (водой), но и непосредственно друг с другом:
NH4+ D NH3 + H+
CH3COO– + H+ D CH3COOH
NH4+ + CH3COO– D NH3 + CH3COOH
Таким образом, рассмотренный случай является типичным примером сочетания двух кислотно-основных пар и поэтому рН раствора равен
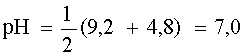
2. Смесь соли с кислотой (основанием). Если имеется эквимолярная смесь соли, образованной сильным основанием и слабой кислотой, с другой слабой кислотой; или соли, образованной слабым основанием и сильной кислотой с другим слабым основанием, то это тоже случай сочетания двух кислотно-основных пар, к которому применимо соотношение (10).
В качестве примера можно взять эквимолярную смесь NaF и CH3COOH. Здесь взаимодействуют между собой кислотно-основные пары (рК1 = 3,2) и
(pK2 = 4,8). рН такого раствора
Калькуляторы ниже предназначены для решения химических задач. Или, если угодно, для проверки ответов. Первый калькулятор рассчитывает pH раствора сильной кислоты или сильного основания по заданным формуле вещества и молярности раствора. Второй калькулятор рассчитывает pH раствора слабой кислоты или слабого основания по заданным константе диссоциации и молярности раствора. Описание расчета с некоторой теорией можно найти под калькуляторами.
Расчет pH в растворах сильных кислот и оснований
Точность вычисления
Знаков после запятой: 3
Расчет pH в растворах слабых кислот и оснований
Точность вычисления
Знаков после запятой: 3
pH раствора
pH означает “pondus Hydrogenii”, “potential of hydrogen” или “power of hydrogen” – вес или потенциал водорода. pH вычисляется как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр.
pH является мерой кислотности водных растворов. Однако, в большинстве задач на растворы для описания раствора обычно используется молярная концентрация раствора или молярность. Как связаны эти две величины?
Активность ионов, конечно, зависит от их концентрации и эта зависимость описывается следующим уравнением:
где,
– активность ионов водорода
– коэффициент активности ионов водорода
– концентрация ионов водорода
Коэффициент активности является функцией от концентрации ионов и стремится к 1 по мере разбавления раствора. При этом для идеальных растворов концентрации ионов равны концентрации растворенного вещества с учетом коэффициентов в формуле соединения. Поэтому для большинства задач, предполагающих идеальные растворы, можно использовать логарифм по основанию 10 от молярной концентрации раствора.
То, как проявляет себя водный раствор, как кислота или как основание, зависит от количества ионов водорода (H+). Вода, сама по себе, содержит некоторое количество ионов водорода1 благодаря явлению автодиссоциации:
Известно, что в состоянии равновесия при стандартных условиях (750 мм.рт.ст. и 25°C), 1 литр чистой воды содержит моль ионов
и
моль ионов
, следовательно, вода при стандартных условиях имеет pH равный 7. Кислоты отдают ионы водорода, так что водные растворы кислот содержат большее количество ионов
чем нейтральная вода, и показатель pH таких растворов меньше 7. Основания принимают ионы водорода, которые возникают при автодиссоциации воды, так что водные растворы оснований содержат меньшее количество ионов водорода чем нейтральная вода и показатель pH таких растворов больше 7. То есть, низкое значение pH указывает на высокую концентрацию ионов водорода и наоборот.
Шкала pH является логарифмической, то есть разница значений в единицу означает разницу концентраций на порядок – в десять раз.
Расчет показателя pH по молярной концентрации раствора отличается в случаях сильных и слабых кислот и оснований.
Сильная кислота / Сильное основание
Сильные кислоты и основания – это вещества, которые, с практической точки зрения, полностью диссоциируют на ионы в воде. Следовательно, концентрацию ионов водорода в таких растворах можно принять равной концентрации вещества. Расчет pH в этом случае становится тривиальным:
Для кислот:
Для растворов оснований известна концентрация основания, то есть, концентрация гидроксид ионов OH-. Следовательно можно рассчитать pOH:
Исходя из равновесных концентраций H+ и OH− в воде, pH и pOH связаны соотношением , выполняющимся для любого водного раствора
Таким образом, для оснований:
Всего семь кислот считаются сильными:
- Соляная кислота HCl
- Азотная кислота HNO3
- Серная кислота H2SO4
- Бромоводород HBr
- Иодоводородная кислота HI
- Хлорная кислота HClO4
- Хлорноватия кислота HClO3
Сильных оснований не намного больше, и не все из них растворимы в воде. К растворимым относятся:
- Гидроксид лития LiOH
- Гидроксид натрия NaOH
- Гидроксид калия KOH
- Гидроксид рубидия RbOH
- Гидроксид цезия CsOH
Раствор сильной кислоты с концентрацией 1 M (1 моль/литр) имеет pH равный 0. Раствор сильного основания с концентрацией 1 M (1 моль/литр) имеет pH равный 14. В большинстве задач значения pH будут лежать в границах от 0 до 14, однако отрицательные значения pH, также как и значения pH больше 14 вполне возможны.
Слабая кислота / слабое основание
Слабые кислоты и основания только частично диссоциируют в воде. Это усложняет вычисление pH. Хотя формула остается такой же: , для вычисления концентрации ионов [H+] понадобится еще константа диссоциации.
Формула константы диссоциации кислоты Ka:
где:
– концентрация ионов H+
– концентрация анионов
– концентрация недиссоциированного соединения
для реакции
Эта формула описывает состояние равновесия. Чтобы найти H+, составим следующую таблицу изменения концентрации. В таблице обозначим искомую концентрацию H+ как x:
| HB | H+ | B- | |
|---|---|---|---|
| Начальная концентрация | C M | 0 M | 0 M |
| Изменение концентрации | -x M | +x M | +x M |
| Концентрация в состоянии равновесия | (C-x) M | x M | x M |
Используем эти величины в формуле для Ka:
Получим квадратное уравнение:
Решаем его, выбрав положительный корень. После чего найденное значение можно подставить в формулу pH.
Тот же самый способ применим и к растворам оснований, только используется константа диссоциации основания и сначала рассчитывается pOH.
Обычно константы диссоциации даны в условии задачи, либо их можно посмотреть в таблице для известных соединений.
Стоит заметить, что в таблицах для некоторых кислот указывается несколько значений Ka. Это многоосновные кислоты, которые могут отдать в раствор более чем один протон. Однако, из-за молекулярных сил, значение Ka для каждого следующего протона уменьшается на несколько порядков.
Например, для фосфорной кислоты:
Поэтому в задачах обычно рассматривается отдача только одного протона, и для всех вычислений можно использовать стохиометрический коэффициент равный 1.
Перейти к содержанию
Автор Владислав Панарин На чтение 2 мин Просмотров 19к. Опубликовано 26.02.2021 Обновлено 18.07.2022
Вам также может понравиться
Таблица электроотрицательности химических элементов
015.7к.
Константы нестойкости комплексных соединений.
019.2к.
Константы устойчивости комплексных соединений.
127.7к.
Электрохимический ряд напряжений (активности) металлов —
016.8к.
Таблица растворимости — это наглядная таблица со списком
018.3к.
Длиннопериодная периодическая таблица (система) химических
010.7к.
Короткопериодная периодическая таблица (система) химических
012.1к.
Стандартные окислительно-восстановительные потенциалы
072.9к.
Знаток
(358),
закрыт
15 лет назад
Василий Сазонов
Профи
(666)
15 лет назад
pH – отрицательный десятичный логарифм равновесной концентрации ионов водорода Н+
Для сильных кислот и оснований:
рН = – lg [H+]
Для слабых кислот:
рН = 1/2 (pKa + pCa)
pKa = – lg Ka, Ka – константа кислотности – константа диссоциации слабой кислоты (значения в справочниках)
pCa = – lg Cа, Са – молярная концентрация кислоты
Для слабых оснований:
рН = 1/2 (pKb + pCb)
pKb = – lg Kb, Kb – константа основности – константа диссоциации слабого основания (значения в справочниках)
pCa = – lg Cb, Сb – молярная концентрация основания
Манька
Профи
(806)
15 лет назад
Всё очень просто: если pH от 0 до 3, то среда сильнокислотная, если от 3 до 6 – то слабокислая, если от 8 до 10 – слабощелочная, 11-14 – сильнощелочная.