12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
Адсорбция (от лат. ad — «на, при» и sorbeo — «поглощаю») — это поглощение вещества из газообразной среды или раствора поверхностным слоем жидкости или твердого тела, следствием которого является самопроизвольное концентрирование веществ вблизи поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество — адсорбатом. После адсорбции внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя, и поверхностное натяжение уменьшается. Слой жидкости, который прилегает к поверхности и равен по толщине радиусу сферы молекулярного взаимодействия, называется поверхностным слоем. Молекулы жидкости в поверхностном слое находятся под действием сил притяжения соседних молекул. Равнодействующая этих сил притяжения направлена в глубь жидкости, передвижение молекул из глубины жидкости в поверхностный слой требует затрат работы на преодоление сил межмолекулярного сцепления (когезии). Работа, выполняемая для увеличения поверхности жидкости на единицу, называется поверхностным натяжением. Поверхностное натяжение можно рассматривать как силу, которая действует на единицу длины контура, который ограничивает поверхность и пытается ее сократить по нормали к касательной к поверхности. Поверхностное натяжение измеряется в Дж/м2 или Н/м. Работа по образованию новой поверхности, которая происходит в условиях изотермического или обратимого процесса (максимальная работа), осуществляется за счет изменения изохорно-изотермического потенциала.
Для единицы поверхности (S):
Поверхностное натяжение представляет собой свободную энергию единицы поверхности. Запас свободной поверхностной энергии гетерогенной системы с межфазной поверхностью раздела S: F = σ х s. Самопроизвольное стремление к уменьшению F системы может быть реализовано или путем уменьшения межфазной поверхности (например, при коагуляции), или за счет уменьшения поверхностного натяжения раствора. Если растворенное вещество способно уменьшать поверхностное натяжение раствора, то оно будет концентрироваться (адсорбироваться) на поверхностном слое. Эти вещества называют поверхностно-активными веществами (ПАВ). Связь между адсорбцией и поверхностным натяжением выражается уравнением Гиббса:
где Г — удельная адсорбция растворенного вещества в моль/м2, т. е. избыточная концентрация растворенного вещества в поверхностном слое раствора в сравнении с его объемной концентрацией с; s — поверхностное натяжение раствора, Дж/м2; R — универсальная газовая постоянная; Т — температура, К.
Производная (изменение поверхностного натяжения с концентрацией) называется поверхностной активностью растворенного вещества. Такие вещества называются поверхностно-инактивными веществами (ПИАВ). Изменение поверхностного натяжения по сравнению с поверхностным натяжением растворителя описывается эмпирическим уравнением Шишковского:
σ0 — σ = B ln(1 + Ac) < 0, где А и В — эмпирические константы. Продифференцировав, имеем:

S = 1 / Г∞N.
Отчет
по практической работе по коллоидной
химии
«Адсорбция»
Студентки
III
курса 4-ой группы
Шевченко
Ольги
Работа 16. Измерение поверхностного
натяжения методом наибольшего давления
пузырьков.
Работа 19. Исследование связи между
поверхностным натяжением и адсорбцией.
Перед
началом лабораторной работы измерительный
капилляр, сосудик, рабочие колбы 6 на
100 мл и 6 на 50 мл и пипетки на 50 и 25 мл
тщательно промыли хромовой смесью,
водопроводной водой и дистиллированной
водой. В сосуд до половины налили хромовой
смеси, опустили туда капилляр так, чтобы
шарик капилляра был полностью погружен
в жидкость, и оставили стоять, а в это
время помыли колбы. В одну из колб налили
небольшое количество хромовой смеси.
Этим объемом ополоснули внутри все
колбы, переливая хромовую смесь из одной
колбы в другую, и в конце слили её в
керамический стакан для слива. Из этого
стакана в пипетку грушей засасали
хромовую смесь и через носик пипетки
вылили хромовую смесь назад в керамический
стакан. После этого вылили из сосуда
хромовую смесь в стакан для слива, а из
капилляра выдули её туда же при помощи
груши.
Затем
всю посуду промыли 20 раз водопроводной
водой. Пипетки, сосудик и колбы ополоснули
дистиллированной водой и одну колбу на
100 мл для задачи поставили в сушильный
шкаф. Капилляр промыли от хромовой смеси
дистиллированной водой с помощью
водоструйного насоса.
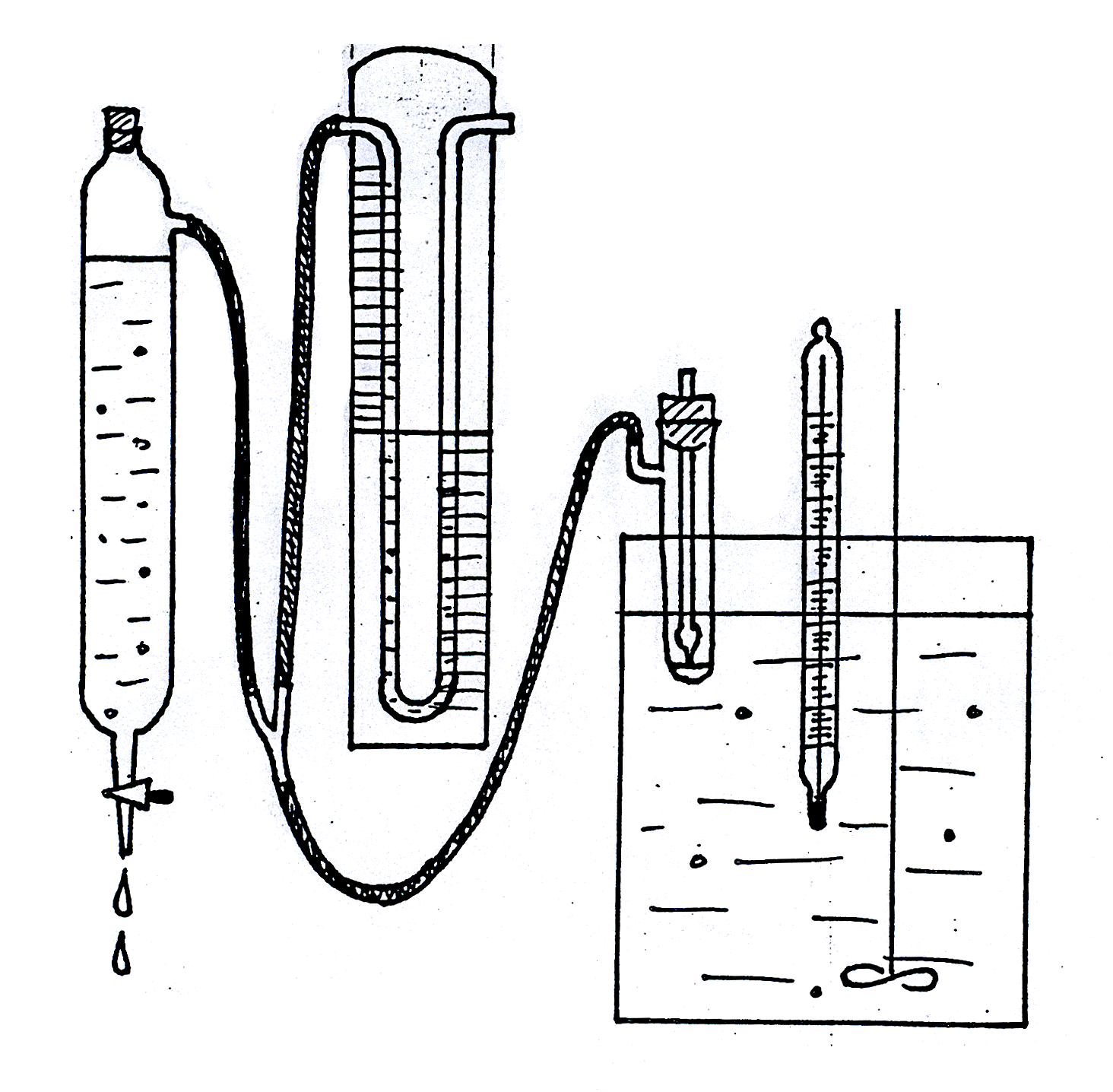
Рис.
1619.1, 1619.1а.
Установка для измерения поверхностного
натяжения методом
наибольшего
давления пузырьков.
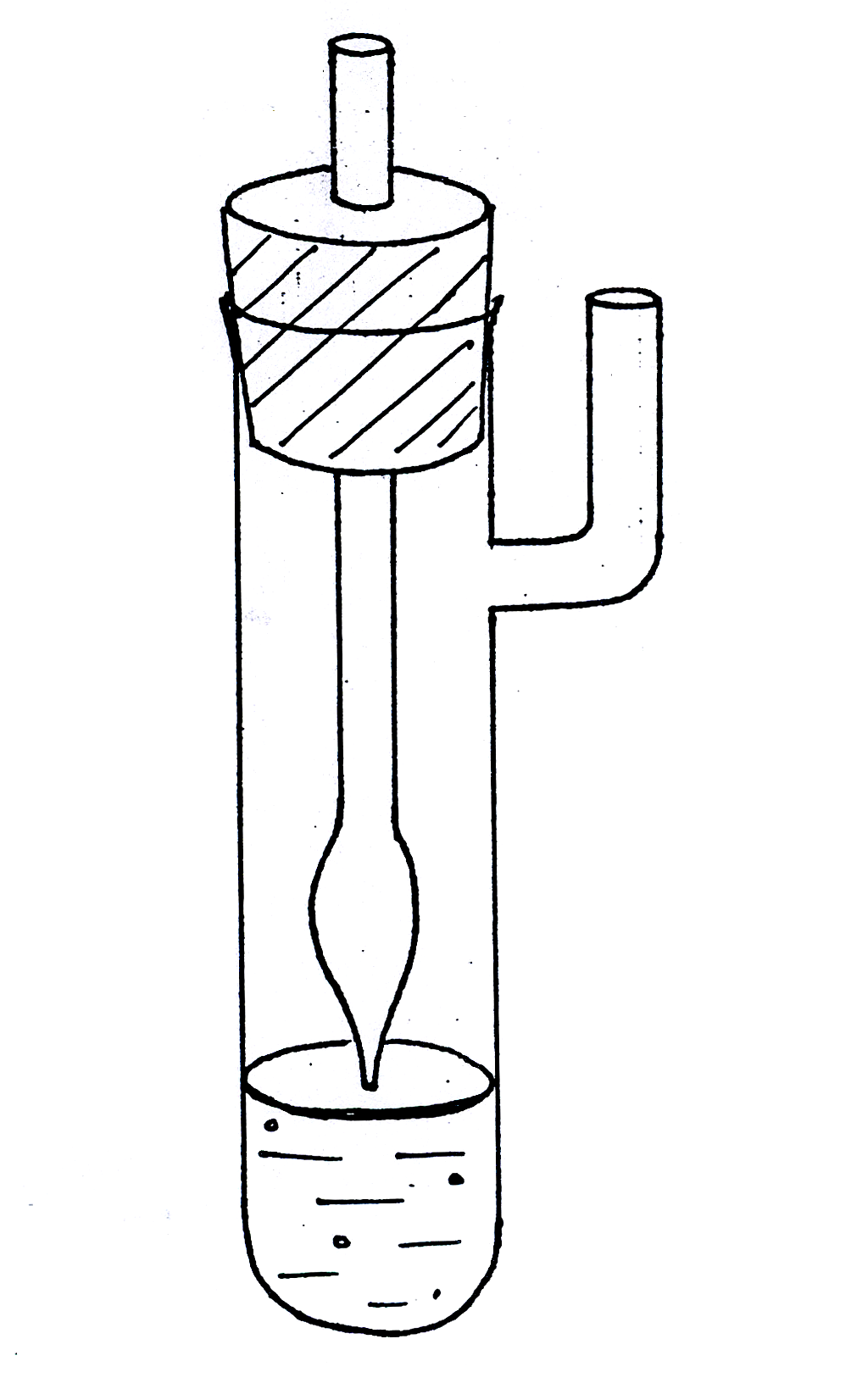
Для
измерения поверхностного натяжения
методом наибольшего давления пузырьков
пользуются прибором, разработанным
академиком П.А. Ребиндером (рис. 1619.1).
Исследуемую жидкость налили в
термостатированный сосудик (1) с боковым
отростком, в который опустили капилляр
(2) таким образом, чтобы он только касался
поверхности жидкости, но не был погружен
в нее. Боковой отросток соединяется с
аспиратором – устройством для создания
разрежения в сосудике – герметичным
стеклянным цилиндром, разрежение воздуха
в котором создается за счет вытекающей
из него воды; при этом происходит
просасывание воздуха через кончик
капилляра в жидкость с образованием
пузырьков. С системой соединен водяной
манометр (4), позволяющий определять
максимальное давление в пузырьке по
разности уровней воды в обоих коленах
манометра (h
= h1
+ h2).
Далее
определяли константу капилляра K
по дистиллированной воде. Для этого
налили в сосуд немного воды и погрузили
туда капилляр так, чтобы он только
касался поверхности жидкости, но не был
погружен в нее (см. рис. 1619.1а).
При этом пробка с капилляра была плотно
вставлена в сосудик.
Далее
сосуд поместили в термостат и соединили
с аспиратором. Во время измерений
аспиратор должен быть плотно закрыт
пробкой; воду в аспиратор доливали
только при помощи воронки. Скорость
вытекания воды из аспиратора отрегулировали
так, чтобы число пузырьков воздуха,
проходящих через капилляр, не превышало
58
в минуту.
Отсчет
наибольшей величины h,
отвечающей максимальному давлению в
пузырьке воздуха, делали при помощи
лупы по зеркальной шкале манометра.
Записали показания обоих колен манометра
и взяли их сумму: h
= h1
+ h2.
Затем вычислили константу капилляра
,
,
причем выполнили эти измерения три
раза, каждый раз заново заполняя сосудик
водой, откуда и получили 3 разных значения
К.
Далее
в 4 пронумерованные колбы на 100 мл (№26)
пипеткой налили по 50 мл дистиллированной
воды. После этого в сухую остывшую колбу
на 100 мл (№ 1) получили задачу, водный
раствор ПАВ. Затем отобрали пипеткой
50 мл исходного раствора из колбы с
задачей и добавили его в колбу с водой
(№ 2), выдувая грушей содержимое из носика
пипетки. Далее отобрали 50 мл полученного
раствора этой же пипеткой и добавили в
следующую колбу с водой (№ 3). Хорошо
перемешали полученный раствор, отобрали
50 мл полученного раствора и так далее
до тех пор, пока не получили 6 растворов,
включая исходный.
Таким
образом, в результате последовательного
разбавления получили колбы с растворами,
разбавленными в 2, 4, 8, 16, 32 раза. Измерения
поверхностного натяжения начали с
самого разбавленного раствора, которому
соответствует колба с наибольшим номером
-№ 6. Перед измерением сосуд с капилляром
тщательно промыли исследуемым
раствором. После чего налили в сосуд
немного исследуемого раствора и погрузили
туда капилляр так, чтобы он только
касался поверхности жидкости, но не был
погружен в нее . Измеряли наибольшую
величину h
для исследуемого раствора аналогично
измерениям при определении константы
капилляра
снимали показания обоих колен манометра
и брали их сумму: h
= h1
+ h2,
только измерения для раствора проводили
один раз. Затем вычисляли значения
поверхностного натяжения исследуемого
раствора 6
со всеми получившимися константами
.
Далее продолжили
работу, изучая адсорбцию на границе
раздела раствор ПАВ – твердый адсорбент
(активированный уголь). Для этого в
каждую из шести колб на 50 мл насыпали
по 1 г адсорбента – активированного
угля; при этом необходимое количество
угля отмерили пробиркой, насыпая уголь
до метки. Затем пипеткой на 25 мл отобрали
самый разбавленный раствор и перенесли
его в одну из колб с углем. Таким образом
заливли все колбы с углем, плотно закрыли
пробками, встряхнули и оставили в шкафу
до следующего занятия. Вместе с колбами
оставили сосудик с капилляром,
предварительно промытый дистиллированной
водой и полностью, до верха, заполненный
ею.
Через неделю
измерили поверхностное натяжение
растворов ПАВ после адсорбции, начиная
с самого разбавленного раствора (колба
№ 6 на 50 мл).
Далее
в лаборантской получили данные об
исследуемом ПАВ – исходную концентрацию
С=0,5 моль/л, молекулярную массу М=74,08,
плотность d=0,804
г/мл.
Полученные
экспериментальные данные и результаты
вычислений занесли в таблицу 1. Величины
адсорбции рассчитали по формуле
,
где
,
= i+1
– i,
C
= Ci+1
– Ci.
Эти данные использовали для построения
зависимости поверхностного натяжения
от концентрации ПАВ в растворе и изотермы
адсорбции, откладывая по оси абсцисс
значения концентрации С (М) и Сср
(М), а по оси ординат – величины
поверхностного натяжения
(эрг/см2)
и Г (моль/см2),
соответственно.
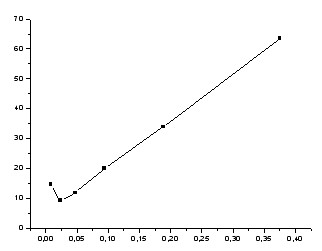
Таблица 1.
|
С, |
h, |
, |
С, |
|
|
Cср, |
|
|
|
0 0 0 |
51 51.5 52 |
72.75 72.75 72.75 |
||||||
|
0.01563 |
49 |
69.90 |
0.01563 |
2.6 |
166.3 |
0.008 |
0.546 |
14.65 |
|
0.03125 |
47 |
65.75 |
0.01562 |
4.15 |
265.7 |
0.023 |
2.51 |
9.16 |
|
0.0625 |
42 |
59.30 |
0.03125 |
6.45 |
206.4 |
0.047 |
3.981 |
11.81 |
|
0.125 |
37 |
52.80 |
0.0625 |
6.5 |
104 |
0.094 |
4.01 |
20 |
|
0.25 |
31 |
43.80 |
0.125 |
9 |
72 |
0.188 |
5.55 |
33.87 |
|
0.5 |
25 |
35.00 |
0.25 |
8.8 |
35.2 |
0.375 |
5.42 |
63.559 |
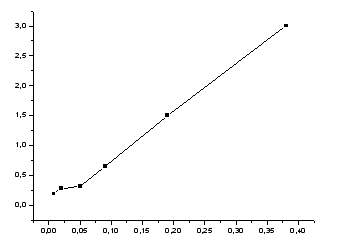
Рисунок
1-зависимость поверхностного натяжения
от концентрации.
Для нахождения
величины предельной адсорбции
и константы k
уравнения адсорбции Лэнгмюра, преобразовали
уравнение
так, чтобы получилось уравнение прямой,
деля С на обе части уравнения. После
сокращения получили уравнение прямой,
не проходящей через начало координат
.
Рисунок
2-зависимость адсорбции от концентрации.
Величину
определили по углу наклона прямой:
.
Построив график
,
находим соответствующие катеты и
вычисляем
.
По отрезку, отсекаемому прямой на оси
ординат, можно найти константу k.
моль/см2
и
,
откуда
.
При этом уравнение адсорбции Лэнгмюра
имеет вид
.
Рисунок
3-Определение константы адсорбции
Лэнгмюра
Далее, зная величину
предельной адсорбции
,
можно вычислить площадь А, занимаемую
одной молекулой в поверхностном слое,
и толщину поверхностного слоя .
=2.4.1015см2;
см.
Во второй части
работы при изучении адсорбции ПАВ на
поверхности твердого адсорбента для
всех приготовленных растворов были
измерены величины поверхностного
натяжения x
после адсорбции. Значения Cx,
концентрацию ПАВ после адсорбции, нашли
графически из зависимости поверхностного
натяжения от концентрации (см.график
изотерма поверхностного натяжения),
опуская перпендикуляр из точки,
соответствующей x,
на ось абсцисс.
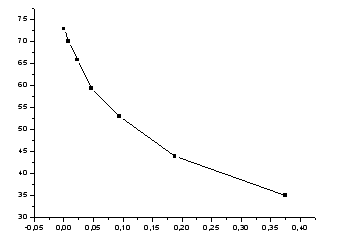
Рисунок
4-зависимость поверхностного натяжения
от концентрации
По формуле
,
где V
– объем раствора (0.025 л) и m
– масса адсорбента (1 г), нашли величину
адсорбции, отнесенную к единице массы
адсорбента. Полученные экспериментальные
данные и результаты вычислений занесли
в таблицу.
-
С,
М,
эрг/см2
(мН/м)x,
эрг/см2
(мН/м)Cx,
МС
– Сx,
М,
ммоль/г0.5
69.90
38.5
0.38
0.12
3
0.25
65.75
48.5
0.19
0.06
1.5
0.125
59.30
58.5
0.09
0.035
0.65
0.0625
52.80
64.3
0.05
0.0125
0.3125
0.03125
43.80
68.5
0.02
0.01125
0.2813
0.01563
35.00
71.3
0.008
0.00763
0.191
Эти
данные используем для построения
изотермы адсорбции на границе раздела
твердое тело – жидкость, откладывая по
оси абсцисс значения концентрации Сx
(М), а по оси ординат – количество
вещества, адсорбированное одним граммом
угля
(ммоль/г).
Рисунок
5-зависимость количества вещества,
адсорбированного одним граммом угля
от концентрации.
Далее
вычисляем величину удельной поверхности
адсорбента S
(см2/г)
– суммарную площадь поверхности,
отнесенную к единице массы адсорбента.
.
Соседние файлы в папке колды
- #
- #
16.04.2015135 б5.~lock.<Набухание>.doc#
- #
- #
- #
16.04.201522.53 Кб7Pov_Nat.xls
- #
- #
- #
- #
- #
Уравнение Фрейндлиха
Теоретические представления, развитые Лэнгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г.Фрейндлих предположил, что число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m) должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенной в некоторую степень, которая всегда меньше единицы:
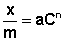
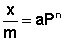
Рис. 4.7. Изотерма адсорбции Фрейндлиха в логарифмических координатах.
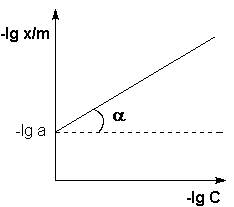
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (IV.15 – IV.16), получаем:
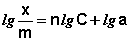
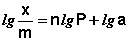
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
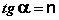
4.1.5 Адсорбция на границе твердое тело – раствор
Лекция №3
План лекции:
1.Поверхностное натяжение – физический смысл.
АДСОРБЦИЯ
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s )
Вследствие этого стремления происходит адсорбция.
Адсорбция – процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Т.е. адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает s .
Адсорбент – фаза определяющая форму поверхности, более плотная, может быть твердой или жидкой.
Адсорбат – вещество которое перераспределяется (газ или жидкость).
Десорбция – переход вещества из поверхностного слоя в объемную фазу.
Количественно адсорбцию описывают величиной Гиббсовской адсорбции (избыток вещества в поверхностном слое по сравнению с его количеством в объемной фазе, отнесенный к единице площади поверхности или единице массы адсорбента)
(3.1)
Г i -Гиббсовская адсорбция,
V -объем системы,
с0 -исходная концентрация адсорбата ,
с i – концентрация адсорбата в объеме,
S – площадь поверхности раздела.
Все величины в (3.1) могут быть установлены экспериментально.
Адсорбцию можно рассматривать как процесс превращения поверхностной энергии в химическую.
Выведем соотношение между поверхностным натяжением и химическими параметрами компонентов.
Если объем поверхностного слоя равен 0, то
т.к. внутр. энергия пропорциональна экстенсивным величинам, то:
полный дифференциал от тех же переменных запишется следующим образом:
dU=T dS + S dT + s dS +S d s + å m i dn i + å n i d m (3.3)
Подставляя dU из 3.2 в 3.3, получим:
3.4 и 3.5 – уравнения Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности зависят от площади поверхности , поэтому удобнее относить эти параметры к единице площади поверхности. Разделив уравнение 3.5 на площадь поверхности, получим:
=> (3.6)
Г i – поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе), то есть величина Гиббсовской адсорбции.
Уравнение 3.6 – фундаментальное адсорбционное уравнение Гиббса. Это строгое термодинамическое соотношение, написанное для многокомпонентной системы. Однако, практиче ское его использование неудобно. Оно, например, не раскрывает зависимость поверхностного натяжения от адсорбции конкретного вещества при постоянных химических потенциалах других веществ.. Единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади.
Адсорбция конкретного вещества при постоянных химических параметрах других веществ:
Принимая во внимание , что m i = m i o + RT ln ai, m i и m i o – равновесное и стандартное значения химического потенциала адсорбата i , а i – термодинамическая активность адсорбата, d m i = RT d ln ai ,получим :
для Гиббсовской адсорбции:
(3.7)
3.7. применяют только тогда, когда можно использовать концентрации вместо активностей и пренебречь изменениями концентраций других веществ при изменении концентрации одного вещества. Этим условиям удовлетворяет разбавленный раствор относительно данного компонента. В таком растворе при изменении концентрации растворенного вещества практически не изменяется концентрация растворителя. Поэтому для растворенного вещества уравнение 3.7 переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов и электролитов
(3.8)
(3.9)
УРАВНЕНИЕ ГЕНРИ, ФРЕЙНДЛИХА, ЛЕНГМЮРА
Для описания процесса адсорбции, помимо фундаментального уравнения адсорбции Гиббса, применяют ряд других аналитических уравнений, которые называются по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентрации вещества в адсорбционном слое и в объеме стремится к постоянному значению, равному кГ:
Это уравнение характеризует изотерму адсорбции при малых концентрациях адсорбата (рис.3.1, участок 1) и является аналитическим выражением закона Генри. Коэффициент кГ не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Уравнение Генри соблюдается приближенно, но это приближение достаточно для практики.
В более общем виде зависимость адсорбции от концентрации адсорбата можно определить с помощью уравнения Фрейндлиха.
Уравнение изотермы адсорбции Фрейндлиха
Уравнение Фрейндлиха для адсорбции газа имеет вид:

K и 1/n –постоянные уравнения Фрейндлиха.
Чаще всего это уравнение применяется в логарифмической форме:

Уравнение в такой форме позволяет построить линейную зависимость lnA от lnp и графически определить оба постоянных параметра.
Логарифмическое уравнение Фрейндлиха для адсорбции из раствора имеет вид:

Графически определяем постоянные параметры по линейной зависимости lnA от lnC.(рис.2)
Отрезок, отсекаемый на оси ординат равен lg k, а тангенс угла наклона прямой
Рис.2. Изотерма адсорбции в координатах логарифмического уравнения.
Уравнение Никольского.
При ионообменной адсорбции происходит стехиометрический обратимый обмен ионов между объемом раствора электролитов и адсорбентом.
Процессы ионного обмена на твердой поверхности характеризуются уравнением Б.П.Никольского:

где 




Графически уравнение Б.П.Никольского изображается прямой, тангенс угла наклона которой и представляют величину константы К.
Примеры решения задач:
1. Рассчитать удельную поверхность адсорбента по изотерме адсорбции бензола на его поверхности. Площадь, занимаемая молекулой бензола, S0=49·10 -20 м 2 .
| p P/PS | 0.024 | 0.08 | 0.14 | 0.20 | 0.27 | 0.35 | 0.46 |
| a·10 3 , моль/кг | 14,9 | 34,8 | 47,2 | 56,8 | 66,3 | 79.3 | 101.0 |
Решение. Проверяют применимость к экспериментальным данным теории БЭТ. С этой целью рассчитывают абсциссу и ординату уравнения изотермы адсорбции БЭТ в линейной форме, т.е.

Результаты вычислений сводят в таблицу 1 и строят график зависимости y=f(x)
| p/ps | y, кг/моль | p/ps | y, кг/моль |
| 0,024 | 1,650 | 0,27 | 5,466 |
| 0,08 | 2,499 | 0,35 | 6,790 |
| 0,14 | 3,449 | 0,46 | 8,343 |
Рис.1 изотерма адсорбции в координатах линейной формы уравнения БЭТ.
Для определения адсорбционной емкости монослоя аm по графику зависимости у=f(x) находят константы уравнения прямой линии: отрезок, отсекаемый на оси ординат при p/ps=0, b0=1.24 кг/моль, и угловой коэффициент прямой b1=15.8 кг/моль. Для сравнения вычисляют b0 и b1
методом наименьших квадратов. Данные для расчёта b0 и b1 приведены в таблице 2.
| n | x | y, кг/моль | xy, кг/моль | x 2 |
| 0,024 | 1,650 | 0,0396 | 5,76·10 -4 | |
| 0,080 | 2,499 | 0,2000 | 6,4·10 -3 | |
| 0,140 | 3,499 | 0,4830 | 1,96·10 -2 | |
| 0,200 | 4,400 | 0,8800 | 4,00·10 -2 | |
| 0,270 | 5,466 | 1,4550 | 7,08·10 -2 | |
| 0,350 | 6,790 | 2,3765 | 0,123 | |
| 0,460 | 8,434 | 3,8778 | 0,212 |
k=13,65 и am=0,0489 моль/кг.
По величине аm рассчитывают удельную поверхность адсорбента:
2. Вычислить предельный адсорбционный объём активированного угля БАУ по изотерме адсорбции бензола (таблица 3). Молярный объём бензола vm=89·10 -6 м 3 /моль.
| p/ps | a, моль/кг | p/ps | a, моль/кг | p/ps | a, моль/кг |
| 1,33·10 -6 | 0,50 | 1,63·10 -2 | 2,25 | 0,327 | 2,86 |
| 2,13·10 -5 | 0,85 | 3,77·10 -2 | 2,39 | 0,460 | 3,00 |
| 1,21·10 -4 | 1,18 | 9,47·10 -2 | 2,56 | 0,657 | 3,19 |
| 5,60·10 -4 | 1,55 | 0,201 | 2,74 | 0,847 | 4,47 |
Решение. Проверяют применимость уравнения (II.15) к экспериментальным данным. С этой целью вычисляют lg a и 

 |
lg a |  |
lg a |  |
lg a |
| 34,52 | -0,3010 | 3,19 | 0,3522 | 0,230 | 0,4564 |
| 21,82 | -0,0706 | 2,03 | 0,3784 | 0,113 | 0,4771 |
| 15,34 | 0,0719 | 1,05 | 0,4082 | 0,033 | 0,5038 |
| 10,58 | 0,1903 | 0,48 | 0,4378 | 0,005 | 0,6503 |
Рис.2 Изотерма адсорбции в координатах линейной формы уравнения М.М.Дубинина.
Как видно из рис.2, экспериментальные точки с хорошим приближением укладываются на прямую линию и, следовательно, уравнение (15) применимо к адсорбции бензола на активированном угле БАУ.
По отрезку, отсекаемому па оси lg a при 

3. По экспериментальным данным сорбции паров воды на активированном угле при Т = 293 К построить кривую капиллярной конденсации. Показать наличие гистерезиса и, используя ветвь десорбции, построить интегральную и дифференциальную кривые распределения пор по радиусам.
аадс ·10 3 ,моль/кг. 3,75 5,3 6;2 8,75 10,4 12, 5 13 ,4
адес·10 3 , моль/кг . . .. 3,75 7,0 7,9 10,0 11,5 13,0 13,4
Vm=18·10 -3 м3/моль, σ= 72,5-10 -3 Дж/м 2 .’
Решение. Строят изотерму капиллярной конденсации в соответствии с условием задачи. Выбирают ряд точек на ветви десорбции (не менее шести—восьми), соответствующих определенным значениям p/pS, и рассчитывают объем пор, заполненных конденсатом, по уравнению V=aVm. Затем для этих же значений по уравнению
рассчитывают максимальный радиус пор, заполненных конденсатом при соответствующих давлениях p/ps. Полученные данные записывают в табл. 5 и строят структурную кривую адсорбента в координатах V=f(r). Из кривой находят ряд значений ΔV/Δr (табл.6) и строят дифференциальную кривую распределения объёма пор по радиусам в координатах ΔV/Δr=f(r)
Таблица.5 Данные для построения интегральной кривой распределения объёма пор по радиусам.
| № точки | P/PS | aдес·10 3 ,моль/кг | V·10 6 ,м 3 /кг | r·10 10 ,м |
| 0,05 0,1 0,2 0,4 0,6 0,8 0,9 0,98 | 0,5 3,7 7,0 7,9 9,0 10,0 10,9 11,5 | 0,9 66,6 126,0 142,0 162,0 180,0 196,0 207,0 | 2,2 4,6 6,6 8,5 11,6 15,5 20,2 26,3 |
Таблица.6 Данные для построения дифференциальной кривой распределения объёма по радиусам.
| ΔV/Δr·10 – 4 ,м 2 /кг | Δr·10 10 ,м | ΔV/Δr·10 – 4 ,м 2 /кг | Δr·10 10 ,м | ΔV/Δr·10 – 4 ,м 2 /кг | Δr·10 10 ,м |
| 1,5 0,5 |
Рис.3 Интегральная(1) и дифференциальная(2) кривые распределения.
Задачи
1. Ниже приведены экспериментальные данные по адсорбции азота на TiO2 (рутиле) при 75 К:
P·10 2 Па……….60,94 116,41 169,84 218,65 275,25
А, моль/кг……. 0,367 0,417 0,467 0,512 0,567
Постройте график соответствующий линейному уравнению БЭТ. Найдите константы 
занимаемая одной молекулой азота S0=0,16 нм 2 .
2.Окись углерода адсорбируется на слюде; данные при 90 К представлены ниже. Определите, какой изотерме – Лэнгмюра или Фрейндлиха – лучше соответствуют эти данные? Каково значение К для адсорбционного равновесия? Взяв общую поверхность равной 6200см 2 , рассчитайте площадь, занимаемую каждой адсорбированной молекулой.
Vа, см 3 ……………..0,130 0,150 0,162 0,166 0,175 0,180
Р, мм. рт. cт.………. 100 200 300 400 500 600.
3.При измерении адсорбции газообразного азота на активном угле при 194.4К были получены следующие данные:
р·10 -3 , Па……………….1,86 6,12 17,96 33,65 68,89
А·10 3 , м 3 /кг…………..…5,06 14,27 23,61 32,56 40,83
Значения А даны для азота при нормальных условиях.
Рассчитайте, постоянные в уравнение Лэнгмюра и удельную поверхность активированного угля, принимая плотность газообразного азота равной
1,25 кг/м 3 , а площадь занимаемую одной молекулой азота на поверхности адсорбента, равной 0,16 нм 2 .
4.При измерении адсорбции азота на активированном угле при 273 К были получены следующие данные:
А,см 3 /г…………..……0,987 3,04 5,08 7,04 10,31
Р, мм. рт. ст…….……3,93 12,98 22,94 34,01 56,23
Построить график в координатах, в которых происходит спрямление уравнения изотермы Лэнгмюра, и определить константы этого уравнения.
5.Определите константы эмпирического уравнения Фрейндлиха, используя следующие данные об адсорбции диоксида углерода на активном угле при 293 К:
Р·10 -3 , Па…………1,00 4,48 10,0 14,4 25,0 45,2
А·10 2 , кг/кг……….3,23 6,67 9,62 11,72 14,5 17,7.
6.Используя уравнение БЭТ, построить изотерму адсорбции бензола по нижеуказанным данным и рассчитайте удельную поверхность адсорбента по изотерме адсорбции бензола (варианты 1-4):
1. P/Ps.………..0,04 0,08 0,16 0,22 0,27 0,36 0,46
А, моль/кг……. 0,348 0,483 0,624 0,724 0,805 0,928 0,13
2. Р/Рs………. 0,05 0,12 0,19 0,26 0,34 0,44 0,50
А, моль/кг ……. 0,31 0,593 0,795 0,99 1,21 1,525 1,77
3. Р/Рs……….…0,03 0,07 0,12 0,17 0,24 0,31 0,38
А, моль/кг……. 0,196 0,301 0,373 0,423 0,488 0,52 0,625
4. Р/Рs…………. 0,02 0,05 0,11 0,19 0,25 0,3 0,36
А, моль/кг……. 0,104 0,196 0,298 0,387 0,443 0,488 0,55
Площадь, занимаемую молекулой бензола, примите равной 0,49 нм 2 .
7.Используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по данным об адсорбции азота:
А•10 3 , м 3 /кг…………..0,71 0,31 0,93 1,09
Площадь занимаемая молекулой азота в плотном монослое, равна 0,16 нм 2 ,
Плотность азота 1,25 кг/м 3 .
8.При обработке данных по адсорбции азота на графитированной саже при 77 К с помощью графика, соответствующего линейному уравнению БЭТ,
найдено, что тангенс угла наклона прямой составляет 1,5•10 3 , а отрезок, отсекаемый на оси ординат, равен 5 единицам (адсорбция выражена в м 3 азота на 1 кг адсорбента при нормальных условиях). Рассчитайте удельную поверхность адсорбента, предполагая, что площадь, занимаемая одной молекулой азота, равна 0,16 нм 2 .
9.Ниже приведены результаты измерения адсорбции газообразного криптона (при 77,5К) на катализаторе:
А·10 3 , м 3 /кг…………1,27 1,5 1,76 1,9 1,98
Р, Па……………..…13,22 23,99 49,13 75,70 91,22.
Значения А для криптона даны при нормальных условиях. Определите константы уравнения БЭТ и удельную поверхность катализатора, принимая, что один атом криптона занимает площадь 0,195нм 2 , Рs=342,6 Па, плотность криптона равна 3,74 кг/м 3
10.используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по изотерме адсорбции азота:
А, моль/кг……..2,16 2,39 2,86 3,02 3,22 3,33
Площадь занимаемая одной молекулой азота в адсорбционном слое 0,16 нм 2 .
11.По изотерме адсорбции азота определить удельную поверхность адсорбента
(Т=77 К, S0=16,2·10 -20 м 2 ). (Варианты 1-5).
1. Р/Рs………. 0,04 0,09 0,16 0,20 0,30
А, моль/кг… .2,20 2,62 2,94 3,11 3,58
2. Р/Рs…………0,029 0,05 0,11 0,14 0,20
А, моль/кг………..2,16 2,39 2,86 3,02 3,33
3. Р/Рs………….0,02 0,04 0,08 0,14 0,16 0,18
А, моль/кг………..1,86 2,31 2,72 3,07 3,12 3,23
Для следующих двух вариантов объем адсорбированного газа приведен к нормальным условиям:
4. Р/Рs…………….…0,05 0,10 0,15 0,20 0,25 0,30
А·10 2 м 3 /кг……………..0,70 1,10 1,17 1,32 1,45 1,55
5. Р/Рs……………….0,029 0,05 0,11 0,14 0,18 0,20
А·10 2 м 3 /кг……..……..0,48 0,54 0,64 0,68 0,72 0,75
12.По изотерме адсорбции бензола определить удельную поверхность
адсорбента. Т=293 К, S0=49•10 -20 м 2 . Объем адсорбированного газа приведен к нормальным условиям (варианты 1-4):
1. Р/Рs…………………….0,05 0,10 0,15 0,20 0,25 0,30
А·10 2 , м 3 /кг………………..0,86 1,20 1,40 1,60 1,80 1,90
2. Р/Рs…………………….0,10 0,15 0,20 0,25 0,30 0,35
А·10 2 , м 3 /кг……….………..1,15 1,37 1,55 1,71 1,86 1,99
3. Р/Рs…………………….0,10 0,15 0,20 0,25 0,30 0,35
А·10 2 , м 3 /кг………………..0,89 1,09 1,27 1,45 1,60 1,78
4. Р/Рs…………………….0,08 0,16 0,25 0,35 0,45 0,52
А·10 2 , м 3 /кг………..… ……1,03 1,37 1,70 1,99 2,44 2,82
13.По изотерме адсорбции бензола определить удельную поверхность
адсорбента. Т=293 К, S0=49·10 -20 м 2 (варианты 1-3).
1. Р/Рs……………..0,05 0,10 0,15 0,20 0,30 0,40
А, моль/кг…. ………0,36 0,51 0,60 0,68 0,82 0,98
2. Р/Рs…………. ….0,06 0,12 0,20 0,30 0,40 0,50
А, моль/кг…. ………..0,08 0,16 0,25 0,35 0,45 0,52
3. Р/Рs…………. ….0,46 0,61 0,76 0,89 1,09 1,26
14.Построить изотерму адсорбции нитролигнина на глине и определить константы уравнения Фрейндлиха по следующим экспериментальным данным:
Концентрация водного раствора нитролигнина
Г·10 3 , кг/кг……………………5,0 12,0 21,0 26,0 35,0 38,0.
15.Пользуясь экспериментальными данными ионного обмена ионов кальция (Г1с1) и натрия (Г2с2) на синтетическом катионите, определить графически константу уравнения Никольского К:



16.Пользуясь константами уравнения Фрейндлиха k=4,17·10 -3 , 1/n=0,4, рассчитать и построить изотерму адсорбции углекислого газа на угле для следующих интервалов давления: 100·10 2 , 200·10 2 , 400·10 2 , 500·10 2 Н/м 2 .
17. Пользуясь константами уравнения Фрейндлиха k=3,2·10 -3 , 1/n=0,6 построить кривую адсорбции углекислого газа на угле в интервале давлений от 5·10 2 до 25·10 2 Н/м 2 .
18. По данным сорбции углекислого газа на угле построить изотерму адсорбции и определить константы изотермы адсорбции Фрейндлиха:
Р·10 -2 , Н/м 2 ……………..5,0 10,0 30,0 50,0 75,0 100,0
Г·10 3 , кг/кг……………..30, 5,5 16,0 23,0 31,0 35,0.
19. При изучении реакций обмена Mg-ионов из чернозема с ионами Ca из внесенных минеральных удобрений получены следующие результаты:
Концентрация ионов в растворе Количество сорбированных катионов
С·10 3 , кмоль/м 3 Г·10 5 ,кмоль/кг
2,41 4,75 8,12 42,88
2,25 5,00 7,70 43,30
2,00 5,10 6,90 44,10
1,84 5,50 6,10 44,90
1,53 5,87 4,54 46,46
1,37 5,99 4,12 46,88
Графическим методом определить константу уравнения Никольского.
20.Оределить константу уравнения Никольского К, используя экспериментальные данные реакций обмена ионов Ca из почвы на ионы Na из раствора натриевой соли.
Концентрация ионов в растворе Na…3,26 6,60 13,80 21,25 38,41 65,19
С·10 3 , кмоль/м 3 Ca.…37,84 36,72 34,62 31,87 26,16 17,10
Количество сорбированных Na….0,28 0,60 1,20 1,89 3,18 7,62
ионов Г·10 5 , кмоль/кг Ca…39,72 39,56 39,40 38,93 38,68 37,40
21.Пользуясь экспериментальными данными реакций обмена ионов ионов Na из раствора натриевой соли на ионы Mg из почвы, определить графически константу уравнения Никольского:
Концентрация ионов в растворе Количество сорбированных ионов
С·10 3 ,кмоль/м 3 на почве Г.10 5 , кмоль/кг
13,82 41,92 1,16 25,40
21,25 38,30 1,89 26,13
38,19 31,90 3,62 27,20
65,0 21,14 8,01 29,32
79,25 14,73 11,66 32,84
22. Используя экспериментальные данные адсорбции анилина из его водного раствора на угле, определить графически константы уравнения Лэнгмюра и построить изотерму адсорбции для следующих с1:
C1·10 4 , кмоль/м 3 ……………………3 5 10 15 20
анилина с·10 4 , кмоль/ м …………1,0 4,0 7,5 12,5 17,5
А·10 9 ,кмоль/м 2 …………….……0,3 0,58 0,70 0,87 0,92
23.По экспериментальным данным построить кривую адсорбции углекислого газа на цеолите при 293º и с помощью графического метода определить константы уравнения Лэнгмюра:
Р·10 -2 , н/м 2 ……………….1,0 5,0 10,0 30,0 75,0 100,0 200,0
А·10 3 , кг/кг………………35,0 86,0 112,0 152,0 174,0 178,0 188,0
24.Используя уравнение Лэнгмюра, вычислить величину адсорбции азота на цеолите при давлении р=2,8·10 2 , если А∞=38,9·10 -3 кг/кг, а k=0,156·10 -2 .
25. Найти площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если предельная адсорбция А∞=6,0·10 -9 кмоль/м
26.По экспериментальны данным адсорбции углекислого газа на активированном угле, найти константы уравнения Лэнгмюра, пользуясь которыми рассчитать и построить изотерму адсорбции:
P·10 -2 , Н/м2……………..9,9 49,7 99,8 200,0 297,0 398,5
Г·10 3 , кг/кг……………..32,0 70,0 91,0 102,0 107,3 108,0.
27.По константам уравнения Лэнгмюра А∞=182·10 -3 и k=0,1·10 -2 рассчитать и построить изотерму адсорбции углекислого газа на активированном угле в пределах следующих равновесных давлений газа: 10·10 2 – 400·10 2 Н/м.
28.Построить кривую адсорбции углекислого газа на активированном угле при 231 º и определить константы эмпирического уравнения Фрейндлиха, пользуясь следующими экспериментальными данными:
Р·10 -2 , Н/м 2 ………………10,0 44,8 100,0 144,0 250,0 452,0
А·10 3 , кг/кг……………….32,3 66,7 96,2 117,2 145,0 177,0.
29. Используя константы эмпирического уравнения Фрейндлиха k=1,6·10 -3 и 1/n=0,48, построить кривую адсорбции углекислого газа на активированном угле при 271 º в интервале давлений от 2·10 2 до 30·10 2 Н/м 2 .
30. Определить постоянные эмпирического уравнения Фрейндлиха, используя следующие данные для адсорбции при 231К углекислого газа на угле из коксовой скорлупы:
Р, Па·10 -3 ……………….1,000 4,480 10,000 14,40 25,0 45,2
А, кг/кг·10 2 ………………3,23 6,67 9,62 11,72 14,5 17,7.
31. Вычислите площадь поверхности катализатора, если для образования монослоя на нем должно адсорбироваться 103 см 3 /г азота (объем приведен к 760 мм рт.ст. и 0ºС). Адсорбция измеряется при температуре 195ºС. Эффективная площадь, занимаемая молекулой азота при этой температуре, равна 16,2 А 2 .
32.Площадь поверхности 1 г активированного угля равна 1000 м 2 . Какое количество аммиака может адсорбироваться на поверхности 45 г угля при 45ºС и 1 атм, если принять в качестве предельного случая полное покрытие поверхности? Диаметр молекулы аммиака равен 3·10 -10 м. Принимается, что молекулы касаются друг друга так, что центры четырех соседних сфер расположены в углах квадрата.
33. Ниже представлены данные по хемосорбции водорода на порошке меди при 25ºС. Подтвердите, что они подчиняются изотерме Ленгмюра. Затем найдите значение К для адсорбционного равновесия и адсорбционный объем, соответствующий полному покрытию.
Р, мм рт ст…………………..0,19 0,97 1,90 4,05 7,5 11,95
Vа, см 3 ……………………….0,042 0,163 0,221 0,321 0,411 0,471.
34. Определите, какая изотерма – Лэнгмюра или Фрейндлиха – лучше соответствует данным для адсорбции метана на 10 г сажи при 0ºС, приведенным ниже:
[spoiler title=”источники:”]
http://www.trotted.narod.ru/collchem/lec-3.htm
http://poisk-ru.ru/s21458t23.html
[/spoiler]
Адсорбция. Виды адсорбции (физическая, химическая, активированная). Уравнение изотермы адсорбции Лэнгмюра.
Важное значение в гетерогенных реакциях играют процессы адсорбции. Адсорбцией называют процесс самопроизвольного увеличения концентрации вещества на границе раздела фаз. Адсорбирующееся вещество носит название адсорбата, адсорбирующее – адсорбента. Процесс, обратный адсорбции, называют десорбцией.
Адсорбционное равновесие определяется двумя процессами: притяжением молекул к поверхности под действием межмолекулярных сил и тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объеме фазы. Количественно адсорбцию характеризуют числом молей или массой вещества, накапливающегося на границе раздела фаз, в расчете на единицу площади поверхности раздела.
Адсорбция является поверхностным процессом, который заключается во взаимодействии молекул или ионов адсорбата (газа или растворенного вещества) с поверхностью адсорбента за счет сил Ван-дер-Ваальса, водородных связей, электростатических сил.
Существует два вида адсорбции: адсорбция на твердой поверхности и адсорбция в поверхностном слое жидкости (адсорбция газа на поверхности жидкости).
Поверхность твердых тел, как и жидкостей обладает избыточной энергией Гиббса. Тенденция к уменьшению избыточной поверхностной энергии Гиббса проявляется у твердых тел в способности удерживать на поверхности молекулы газа или растворенного вещества.
Различают физическую и химическую адсорбцию. Адсорбцию, обусловленную действием сил Ван-дер-Ваальса, называют физической адсорбцией. Физическая адсорбция – обратимый экзотермический процесс. Когда частица адсорбируется на поверхности, ее поступательное движение ограничивается, и поэтому процесс сопровождается уменьшением энтропии. При повышении температуры адсорбция уменьшается, а десорбция увеличивается. Значение энтальпии физической адсорбции невелика и обычно составляет -8…-20кДж ⁄моль.
При физической адсорбции быстро устанавливается равновесии между адсорбированными частицами и частицами в газовой фазе. Распределение молекул адсорбата между поверхностью твердого тела и газовой фазой зависит от давления, температуры, химической природы вещество, площади поверхности. Равновесие распределения оценивают по изотермам адсорбции. Простейшим уравнением для изотермы адсорбции служит уравнение изотермы Ленгмюра.
Вывод уравнения изотермы Ленгмюра основан на следующих допусках:
Рекомендуемые материалы
-поверхность адсорбента однородна;
-взаимодействие между адсорбированными молекулами отсутствует;
-адсорбция протекает лишь до образования монослоя, т.е. каждый центр может присоединить только одну частицу (мономолекулярная адсорбция);
-процесс динамичен, и при заданных условиях устанавливается равновесие между адсорбцией и десорбцией.
Где Ө – доля поверхности, занятая адсорбированным газом; bА =kА ⁄kВ – адсорбционный коэффициент; р – давление.
Химическая адсорбция – процесс адсорбции, который протекает в результате образования химической связи (обычно ковалентной). Энергия связи адсорбент – адсорбат достаточно велика и примерно равна энтальпии образования химических соединений (80….8000кДж ⁄моль). Хемосорбция характеризуется высокой специфичностью (зависит от природы адсорбента и адсорбата).
Принципиальное отличие хемосорбции от физической адсорбции заключается в том, что в результате образования более прочных связей хемосорбированное вещество с трудом удаляется поверхности адсорбента, причем десорбция может сопровождаться химическими превращениями. Например. При адсорбции кислорода на поверхности угля образуется настолько прочная связь, что при десорбции в газовую фазу выделяются оксиды СО и СО2.
Если энергия активации равна нулю, то хемосорбцию называют неактивированной (например, адсорбция многих газов на очень чистых металлических поверхностях). При наличии активационного энергетического барьера хемосорбцию называют активированной (например, на загрязненной примесями поверхности металла).
Хемосорбция играет важную роль при протекании гетерогенных реакций, которые имеют сложный многостадийный механизм, включающий хемосорбционные процессы.