Массовой долей растворённого вещества (wв) называется величина, равная отношению массы растворённого вещества (mв) к массе раствора (m).
Данная величина является безразмерной и чаще всего выражается в долях единицы или в процентах (для этого в представленную выше формулу дополняют умножением на 100%).
В многих бинарных растворах отмечена функциональная зависимость между плотностью раствора и его массовой долей при данной температуре. Данное свойство позволяет найти по значению плотности массовую долю, к примеру, водного раствора серной кислоты.
Справочники, в которых вы можете найти таблицы зависимости плотностей и массовой доли:
- Лазарев А.И., Харламов И.П., Яковлев П.Я., Яковлева Е.Ф. Справочник химика-аналитика. М.: Металлургия, 1976, с 184
- Рабинович В. А., Хавин З. Я. “Краткий химический справочник” Л. 1978
Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Как перевести массовую долю в другой вид концентрации?
1. Молярная концентрация.
Для перевода массовой доли в молярную концентрацию необходимо массовую долю (w, %) умножить на 10, умножить на плотность раствора (p, г/мл) и разделить на молярную массу растворенного вещества:
2. Нормальная концентрация (нормальность).
Для перевода массовой доли в нормальную концентрацию (нормальность) необходимо массовую долю (w, %) умножить на 10, умножить на плотность раствора (p, г/мл) и разделить на эквивалентную массу растворенного вещества:
3. Концентрация, выраженная в граммах растворенного вещества на литр раствора.
Для перевода массовой доли в концентрацию, выраженную в граммах растворенного вещества на литр раствора (г/л) необходимо массовую долю (w, %) умножить на 10 и умножить на плотность раствора (p, г/мл):
Если вам помогла статья, ставьте лайки и подписывайтесь на канал! Будем и дальше создавать полезный материал!
С уважением, Control myLab.
Способы выражения состава.
|
Способ |
Обозначение содержания компонента |
Международные обозначения |
||
|
Название |
Значение |
в |
в |
|
|
Молярная |
|
x |
y |
х, у |
|
Массовая |
|
|
|
w |
|
Относительная молярная |
|
X |
Y |
X, Y |
|
Относительная массовая |
|
|
|
W |
|
Молярная концентрация |
|
Cx |
Cy |
c |
|
Массовая концентрация |
|
|
|
|
|
Объёмная |
|
xV |
y |
φ |
Примечание:
объёмная доля для газов равна молярной
доле и обозначается y;
объёмная доля для жидкостей обозначается
также как и молярная доля х,
но, поскольку для жидкостей это разные
величины, в скобках делается пометка,
например х
= 10% (об.).
Допускается также использование нижнего
индекса хv.
Расчёт плотности и вязкости.
Плотность газа при температуре Т
(К) и давлении р:
![]() ,
,
где![]() .
.
Здесь Т0 = 273 К,р0
= 760 ммHg= 1,013·105Па,Vm
= 22,4 м3/кмоль.
Плотность смеси газов:
![]() .
.
Плотность смеси жидкостей:
![]() ;
;
формула плохо применима к смесям
жидкостей со значительным объёмным
эффектом смешения, таким как вода–этанол.
Плотность суспензий:
![]() .
.
Вязкость газа при температуре Т
(К):
![]() ,
,
где С– постоянная Сатерленда [1,
табл.V].
Вязкость смеси газов:
![]() .
.
Для коксового, генераторного и подобных
им газов:
 ,
,
где Ткр i– критическая температураi-го
компонента, К [1, табл.XI].
Вязкость смеси жидкостей
через молярные доли:
![]() ;
;
через объёмные доли:
![]() .
.
Вязкость суспензий:
при
![]()
![]() ;
;
при
![]()
![]() .
.
Семинар 2.
Задача 1.
Определить объём воды и 96%-го (объёмные
%) раствора этанола необходимые для
получения 1 м340%-го раствора
этанола. Температуру жидкостей принять
равной 20°С.
|
Дано: φн= 96% (об.), φк= 40% (об.),
V40% = t= 20°C. |
Найти: Vв |
Схема аппарата:
|
Решение.
В зависимости от способа приготовление
растворов объёмные доли могут быть
рассчитаны по двум различным формулам:
![]() (1) и
(1) и![]() (2)
(2)
Вторая формула применима к растворам,
приготовленным в лабораторных условиях,
когда определённый объём спирта
помещается в мерный цилиндр, а затем
объём доводится дистиллированной водой
до метки.
В промышленности, где имеют дело с
большими объёмами, применима первая
формула, которую мы и будем использовать
в дальнейших расчётах.
Выведем формулу для пересчёта объёмных
долей в массовые:
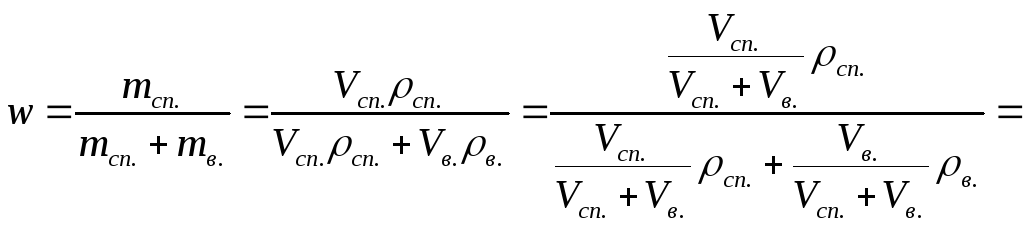
 (3).
(3).
Аналогично могут быть получены формулы
для пересчёта массовых долей в молярные
и молярных долей в массовые, соответственно:
![]() (4),
(4),![]() (5).
(5).
Таблица пересчёта одних концентраций
в другие приведена в [1, с. 283, табл. 6.2], в
начале главы 6 «Основы массопередачи.
Абсорбция».
По формуле (3) производим пересчёт
объёмных долей в массовые для 40%-го и
96%-го растворов:
![]() ,
,![]() .
.
Исходя из ближайших табличных значений
плотностей водных растворов этанола,
найдём плотности наших растворов методом
линейной интерполяции:
|
Плотности |
|
|
Масс. % |
Плотность, |
|
100 |
789 |
|
80 |
843 |
|
60 |
891 |
|
40 |
935 |
|
20 |
969 |
|
0 |
998 |
|
|
|
Из подобия большого и малого
(заштрихованного) треугольников получаем
соотношения:
![]() ;
;![]() .
.
Следовательно, плотности 40 и 96%-ного
растворов соответственно равны:
![]() ,
,![]() .
.
Рассчитаем массу 40%-го раствора этанола:
![]() .
.
Рассчитаем массу этанола, содержащегося
в растворе:
![]() .
.
Рассчитаем массовый расход 96%-го раствора
этанола:
![]() .
.
Рассчитаем массу воды, необходимой для
разбавления 96%-го раствора:
![]() .
.
Рассчитаем объём 96%-го раствора этанола:
![]() .
.
Рассчитаем объём воды, необходимой для
разбавления 96%-го раствора:
![]() .
.
Рассчитаем объёмный эффект смешения:
 .
.
Задача 2.
При синтезе аммиака из водорода и азота
на выходе из реактора получают смесь,
содержащую 12% (об.) аммиака, 22% (об.) азота
и 66% (об.) водорода. Температура смеси
500°С, давление 30 МПа. Определить
плотности компонентов и плотность
смеси.
Надо было указать, при каких условиях необходимо найти плотность смеси газов. Будем считать, что тебе даны нормальные условия.
Рассмотрим пример.
Пусть тебе дана смесь двух газов – кислорода и водорода. Количество вещества смеси газов примем равным 1 моль.
n(смеси) = 1,0 моль
Объемные доли водорода и кислорода в смеси газов φ(О2) и φ(Н2).
На основании закона Авогадро объемные доли в смеси газов равны их мольным долям.
Х(О2) = φ(О2)
Х(Н2) = φ(Н2)
Для простоты расчетов мольные доли переводишь из процентов в доли единицы.
Х(О2) + Х(Н2) = 1
Молярная масса смеси газов
M(смеси) = [X(О2)*M(O2) + X(Н2)*M(H2)]/[X(O2) + X(Н2)] = X(О2)*M(O2) + X(Н2)*M(H2)
На основании закона Авогадро один моль газа занимает при нормальных условиях объем 22,4 литра.
Плотность смеси газов находишь, разделив молярную массу смеси газов на молярный объем.
ρ(смеси) = M(смеси)/Vm
Vm = 22,4 л/моль
Если тебе даны массовые доли газов в смеси, то принимаешь массу смеси равной 1000 г.
m(смеси) = 1000 г
Массовые доли газов для удобства переводишь из процентов в доли единицы. Находишь массу каждого газа, а затем количество вещества каждого газа в смеси.
m(O2) = ω(О2)*m(смеси)
n(O2) = m(O2)/M(O2)
m(H2) = ω(H2)*m(смеси)
n(H2) = m(H2)/M(Н2)
n(смеси) = n(O2) + n(H2)
По закону Авогадро находишь объем, занимаемый смесью при нормальных условиях.
V(смеси) = n(смеси)*Vm
Плотность смеси газов находишь, разделив массу смеси газов на объем смеси.
ρ(смеси) = m(смеси)/V(смеси)
Если условия отличаются от нормальных, то молярный объем находишь по
уравнению Менделеева – Клайперона.
P*Vm = n(смеси)*R*T
n(смеси) = 1 моль
Какая зависимость существует между плотностью раствора и содержанием массовой доли растворённого вещества?
Али А.
29 октября 2018 · 12,7 K
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас активно… · 3 февр 2019
Исходя из формулы массовой доли растворенного вещества ω = mB /m, в случае бинарных растворов, чем больше концентрация вещества, тем больше и плотность раствора.
6,3 K
Комментировать ответ…Комментировать…
Обычно, чем больше плотность, тем больше массовая доля вещества. Такое правило относится, например, к растворению солей в воде и других растворителях.
1,6 K
Комментировать ответ…Комментировать…
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/



