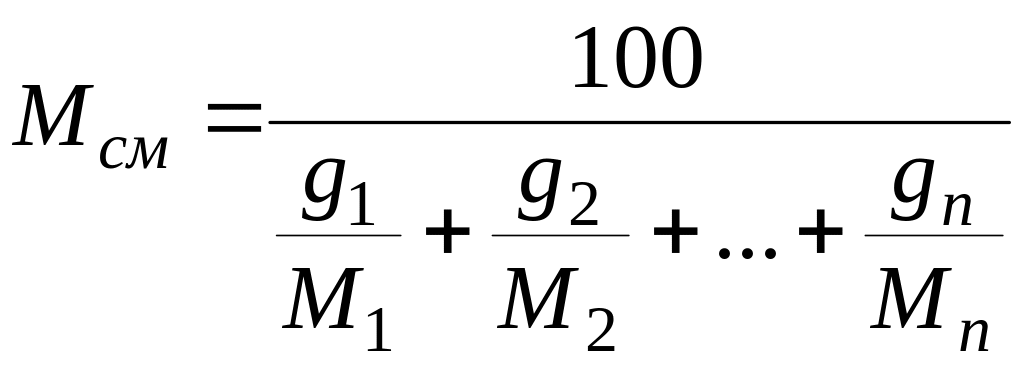Density is referred to as the ratio of the mass per unit of volume of a substance under specific conditions of pressure and temperature. Mathematically, it can be defined as mass divided by volume. It is generally represented by “ρ” or “D”. The density of a substance varies depending on its pressure and temperature. For example, the density of an ideal gas can be doubled as the pressure doubles or by halving its absolute temperature. That means the density of gas always increases as the pressure increases and decreases as the temperature increases. We can determine the molar mass of a substance if we know its density. Generally, the density of a substance is different for different materials. At standard conditions for temperature and pressure, osmium and iridium are the densest known elements.
Density (ρ) = m/V
Where “m” is the mass, and “V” is the volume.
The SI unit of density of a substance is kilogram per cubic meter (kg/m3). Some other units of measurement of density are kilogram per liter (kg/L), gram per milliliter (g/mL), tonne per cubic meter (t/m3), etc.
Density of Gas Formula
The formula to determine the density of a gas is given as follows:
Density of a gas (ρ) = PM/RT
Where,
“P” is the pressure of the gas,
“M” is the molar mass (g/mol),
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gas (K)
Derivation For the Density of Gas formula
The density of a gas is equal to the total mass of the gas to the total volume of the gas. To determine the molar mass of a gas, we have to consider the ideal gas equation.
From the ideal gas equation, we have
PV = nRT …………(1)
where,
“P” is the pressure of the gas,
“V” is the volume of the gas
“n” is the number of moles
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gasWe know that, number of moles (n) = m/M
where,
“m” is the mass of the gas,
“M” is the molecular mass of the gas.Now, substitute n = m/M in equation (1).
Thus, PV = mRT/M
P = mRT/MV ……….(2)
we know that density (ρ) = m/V. So, substitute the value of ρ in equation (2).
Thus, we get
P = ρ RT/M
ρ = PM/RT
Thus, the ideal gas density formula is ρ = PM/RT.
Solved Examples on Gas Density
Example 1: What will be the density of a gas at 37 °C and a pressure of 5 atm and a molar mass of 84 g/mol?
Solution:
Given data:
Molar mass (M) = 84 g/mol
The pressure of the gas (P) =5 atm
The temperature of the gas (T) = 37 °C = 310 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ = MP/RT
ρ = (84 × 5)/ (0.082 × 310)
ρ = 420/25.42 g/L
ρ = 16.522 g/L
Hence, the density of a gas is 16.522 g/L.
Example 2: Determine the density of a gas at 27 °C at a pressure of 7 atm and a molar mass of 54 g/mol. (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Molar mass (M) = 54 g/mol
The pressure of the gas (P) =7 atm
The temperature of the gas (T) = 27 °C = 300 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (54 × 7)/ (0.082 × 300)
ρ= 378/24.6 g/L
ρ= 15.37 g/L
Hence, the density of a gas is 15.37 g/L.
Example 3: Determine the density of carbon monoxide at 40 °C and a pressure of 730 Torr. (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Molar mass of carbon monoxide (M) = 28 g/mol
Pressure (P) =730 Torr = 730/760 atm = 0.9605 atm
Temperature (T) = 40 °C = 313 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (28 × 0.9605)/ (0.082 × 313)
ρ= 26.894/25.666 g/L
ρ= 1.0478 g/L
Hence, the density of carbon monoxide at 40 °C and a pressure of 730 Torr is 1.0478 g/L.
Example 4: If the density of a gas is 9.35 g/L at STP, then determine its density at 30 °C and a pressure of 700 mmHg.
Solution:
Given data:
The density of a gas (ρ1) = 9.35 g/L
We know that at STP pressure is equal to 0.987 atm and temperature is equal to 273.15 K.
So, P1 = 0.987 atm
T1 = 273.15 K
Let the density of the gas at 30 °C and pressure of 700mmHg be ρ2.
P2 = 700mmHg = 700 × 0.00131579 atm = 0.9210 atm
T2 = 30 °C = 303K
From the ideal gas density formula, we have
ρ= MP/RT
As we are calculating the density of the same gas at different conditions, the mass of the gas remains the same.
ρ ∝ P/T
ρ1/ρ2 = (P1/T1)/ (P2/T2)
9.35/ρ2 = (0.987/273.15)/ (0.9210/303)
9.35/ρ2 = (0.987 × 303)/ (0.9210 × 273.15)
9.35/ρ2 = (299.061/251.57)
ρ2 = (9.35 × 251.57)/299.061
ρ2 = 7.865 g/L
Hence, the density of the gas at 30 °C and pressure of 700mmHg is 7.865 g/L.
Example 5: What is the density of nitric oxide (NO) at a temperature of 51 °C and a pressure of 6 bar? (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Density (ρ) = 3.42 g/L
Temperature (T) = 51 + 273 = 324 K
Pressure (P)= 6 bar = 6 × 0.9869 atm = 5.9215 atm
The molar mass of nitric oxide = 30 g/mol
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (30 × 5.9215)/ (0.082 × 324)
ρ= 177.645/26.568 g/L
ρ= 6.686 g/L
Hence, the density of nitric oxide at 51 °C and a pressure of 6 bar is 6.686 g/L.
FAQs on Gas Density
Question 1: Define the density of the gas.
Answer:
Density is referred to as the ratio of the mass per unit of volume of a substance under specific conditions of pressure and temperature. Mathematically, it can be defined as mass divided by volume. It is generally represented by “ρ” or “D”.
Density (ρ) = m/V
Where “m” is the mass, and “V” is the volume.
Question 2: What is the effect of pressure and temperature on the density of gas?
Answer:
The density of a substance varies depending on its pressure and temperature. For example, the density of an ideal gas can be doubled as the pressure doubles or by halving its absolute temperature. That means the density of gas always increases as the pressure increases and decreases as the temperature increases.
Question 3: What is meant by an ideal gas? Write down the ideal gas density formula.
Answer:
The gas that strictly follows Boyle’s law, Charles’ law, and Avogadro’s law is known as an ideal gas. It is a hypothetical gas that is proposed to simplify the calculations. Many real gases behave qualitatively like an ideal gas under various conditions of temperature and pressure, where the gas molecules act as the ideal particles.
Ideal gas density formula
ρ = PM/RT
Where “P” is the pressure of the gas,
“M” is the molar mass (g/mol),
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gas (K)
Question 4: What are units of measurement of density?
Answer:
The SI unit of density of a substance is kilogram per cubic meter (kg/m3). Some other units of measurement of density are kilogram per liter (kg/L), gram per milliliter (g/mL), tonne per cubic meter (t/m3), etc.
| Плотность | |
|---|---|
 |
|
| Размерность | L−3 M |
| Единицы измерения | |
| СИ | кг/м³ |
| СГС | г/см³ |
| Примечания | |
| скалярная величина |
Пло́тность — скалярная физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму или как производная массы по объёму:
.
Данные выражения не эквивалентны, и выбор зависит от того, какая именно плотность рассматривается. Различаются:
Для точечной массы плотность является бесконечной. Математически её можно определить или как меру, или как производную Радона — Никодима по отношению к некоторой опорной мере.
Для обозначения плотности обычно используется греческая буква 
Понятие «плотность» в физике может иметь более широкую трактовку. Существуют поверхностная плотность (отношение массы к площади) и линейная плотность (отношение массы к длине), применяемые соответственно к плоским (двумерным) и вытянутым (одномерным) объектам. Кроме того, говорят не только о плотности массы, но и о плотности других величин, например энергии, электрического заряда. В таких случаях к термину «плотность» добавляются конкретизирующие слова, скажем «линейная плотность заряда». «По умолчанию» под плотностью понимается вышеуказанная (трёхмерная, кг/м³) плотность массы.
Формула нахождения плотности[править | править код]
Плотность (плотность однородного тела или средняя плотность неоднородного) находится по формуле:
где M — масса тела, V — его объём;
формула является просто математической записью определения термина «плотность», данного выше.
При вычислении плотности газов при стандартных условиях эта формула может быть записана и в виде:
где 

Плотность тела в точке записывается как
тогда масса неоднородного тела (тела с плотностью, зависящей от координат) рассчитывается как
Случай сыпучих и пористых тел[править | править код]
В случае сыпучих и пористых тел различают
- истинную плотность, определяемую без учёта пустот;
- насыпную плотность, рассчитываемую как отношение массы вещества ко всему занимаемому им объёму.
Истинную плотность из насыпной (кажущейся) получают с помощью величины коэффициента пористости — доли объёма пустот в занимаемом объёме.
Зависимость плотности от температуры[править | править код]
Как правило, при уменьшении температуры плотность увеличивается, хотя встречаются вещества, чья плотность в определённом диапазоне температур ведёт себя иначе, например, вода, бронза и чугун. Так, плотность воды имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры относительно этого значения.
При изменении агрегатного состояния плотность вещества меняется скачкообразно: плотность растёт при переходе из газообразного состояния в жидкое и при затвердевании жидкости. Вода, кремний, висмут и некоторые другие вещества являются исключениями из данного правила, так как их плотность при затвердевании уменьшается.
Диапазон плотностей в природе[править | править код]
Для различных природных объектов плотность меняется в очень широком диапазоне.
- Самую низкую плотность имеет межгалактическая среда (2·10−31—5·10−31 кг/м³, без учёта тёмной материи)[2].
- Плотность межзвёздной среды приблизительно равна 10−23—10−21 кг/м³.
- Средняя плотность красных гигантов в пределах их фотосфер много меньше, чем у Солнца — из-за того, что их радиус в сотни раз больше при сравнимой массе.
- Плотность газообразного водорода (самого лёгкого газа) при стандартных условиях равна 0,0899 кг/м³.
- Плотность сухого воздуха при стандартных условиях составляет 1,293 кг/м³.
- Один из самых тяжёлых газов, гексафторид вольфрама, примерно в 10 раз тяжелее воздуха (12,9 кг/м³ при +20 °C)
- Жидкий водород при атмосферном давлении и температуре −253 °C имеет плотность 70 кг/м³.
- Плотность жидкого гелия при атмосферном давлении равна 130 кг/м³.
- Усреднённая плотность тела человека от 940—990 кг/м³ при полном вдохе, до 1010—1070 кг/м³ при полном выдохе.
- Плотность пресной воды при 4 °C 1000 кг/м³.
- Средняя плотность Солнца в пределах фотосферы около 1410 кг/м³, примерно в 1,4 раза выше плотности воды.
- Гранит имеет плотность 2600 кг/м³.
- Средняя плотность Земли равна 5520 кг/м³.
- Плотность железа равна 7874 кг/м³.
- Плотность металлического урана 19100 кг/м³.
- Плотность золота 19320 кг/м³.
- Плотность нептуния — самого плотного актиноида — 20200 кг/м³.
- Самые плотные вещества при стандартных условиях — металлы платиновой группы шестого периода (осмий, иридий, платина), а также рений. Имеют плотность 21000—22700 кг/м³.
- Плотность атомных ядер приблизительно 2·1017 кг/м³.
- Теоретически верхняя граница плотности по современным[когда?] физическим представлениям — это планковская плотность 5,1⋅1096 кг/м³.
Плотности астрономических объектов[править | править код]
Средняя плотность небесных тел Солнечной
системы (в г/см³)[3][4][5]
- Средние плотности небесных тел Солнечной системы см. на врезке.
- Межпланетная среда в Солнечной системе достаточно неоднородна и может меняться во времени, её плотность в окрестностях Земли ~10−21÷10−20 кг/м³.
- Плотность межзвёздной среды ~10−23÷10−21 кг/м³.
- Плотность межгалактической среды 2×10−34÷5×10−34 кг/м³.
- Средняя плотность красных гигантов на много порядков меньше чем у Солнца из-за того, что их радиус в сотни раз больше.
- Плотность белых карликов 108÷1012 кг/м³
- Плотность нейтронных звёзд имеет порядок 1017÷1018 кг/м³.
- Средняя (по объёму под горизонтом событий) плотность чёрной дыры зависит от её массы и выражается формулой:
- Средняя плотность падает обратно пропорционально квадрату массы чёрной дыры (ρ~M−2). Так, если чёрная дыра с массой порядка солнечной обладает плотностью около 1019 кг/м³, превышающей ядерную плотность (2×1017 кг/м³), то сверхмассивная чёрная дыра с массой в 109 солнечных масс (существование таких чёрных дыр предполагается в квазарах) обладает средней плотностью около 20 кг/м³, что существенно меньше плотности воды (1000 кг/м³).
Плотности некоторых газов[править | править код]
| Азот | 1,250 | Кислород | 1,429 |
| Аммиак | 0,771 | Криптон | 3,743 |
| Аргон | 1,784 | Ксенон | 5,851 |
| Водород | 0,090 | Метан | 0,717 |
| Водяной пар (100 °C) | 0,598 | Неон | 0,900 |
| Воздух | 1,293 | Радон | 9,81 |
| Гексафторид вольфрама | 12,9 | Углекислый газ | 1,977 |
| Гелий | 0,178 | Хлор | 3,164 |
| Дициан | 2,38 | Этилен | 1,260 |
Для вычисления плотности произвольного идеального газа, находящегося в произвольных условиях, можно использовать формулу, выводящуюся из уравнения состояния идеального газа:[6]
,
где:
Плотности некоторых жидкостей[править | править код]
| Бензин | 710 | Молоко | 1040 |
| Вода (4 °C) | 1000 | Ртуть (0 °C) | 13600 |
| Керосин | 820 | Диэтиловый эфир | 714 |
| Глицерин | 1260 | Этанол | 789 |
| Морская вода | 1030 | Скипидар | 860 |
| Масло оливковое | 920 | Ацетон | 792 |
| Масло моторное | 910 | Серная кислота | 1835 |
| Нефть | 550—1050 | Жидкий водород (−253 °C) | 70 |
Плотность некоторых пород древесины[править | править код]
| Бальса | 0,15 | Пихта сибирская | 0,39 |
| Секвойя вечнозелёная | 0,41 | Ель | 0,45 |
| Ива | 0,46 | Ольха | 0,49 |
| Осина | 0,51 | Сосна | 0,52 |
| Липа | 0,53 | Конский каштан | 0,56 |
| Каштан съедобный | 0,59 | Кипарис | 0,60 |
| Черёмуха | 0,61 | Лещина | 0,63 |
| Грецкий орех | 0,64 | Берёза | 0,65 |
| Вишня | 0,66 | Вяз гладкий | 0,66 |
| Лиственница | 0,66 | Клён полевой | 0,67 |
| Тиковое дерево | 0,67 | Бук | 0,68 |
| Груша | 0,69 | Дуб | 0,69 |
| Свитения (Махагони) | 0,70 | Платан | 0,70 |
| Жостер (крушина) | 0,71 | Тис | 0,75 |
| Ясень | 0,75 | Слива | 0,80 |
| Сирень | 0,80 | Боярышник | 0,80 |
| Пекан (кария) | 0,83 | Сандаловое дерево | 0,90 |
| Самшит | 0,96 | Эбеновое дерево | 1,08 |
| Квебрахо | 1,21 | Бакаут | 1,28 |
| Пробка | 0,20 |
Плотность некоторых металлов[править | править код]
Значения плотности металлов могут изменяться в весьма широких пределах: от наименьшего значения у лития, который легче воды, до наибольшего значения у осмия, который тяжелее золота и платины.
| Осмий | 22610[7] | Родий | 12410[8] | Хром | 7190[9] |
| Иридий | 22560[10] | Палладий | 12020[11] | Германий | 5320[12] |
| Плутоний | 19840[13] | Свинец | 11350[14] | Алюминий | 2700[15] |
| Платина | 19590[16] | Серебро | 10500[17] | Бериллий | 1850[18] |
| Золото | 19300[14] | Никель | 8910[19] | Рубидий | 1530[20] |
| Уран | 19050[21] | Кобальт | 8860[22] | Натрий | 970[23] |
| Тантал | 16650[24] | Медь | 8940[25] | Цезий | 1840[26] |
| Ртуть | 13530[27] | Железо | 7870[28] | Калий | 860[29] |
| Рутений | 12450[30] | Марганец | 7440[31] | Литий | 530[32] |
Измерение плотности[править | править код]
Для измерений плотности используются:
- Пикнометр — прибор для измерения истинной плотности
- Различные виды ареометров — измерители плотности жидкостей.
- Бурик Качинского и бур Зайдельмана — приборы для измерения плотности почвы.
- Вибрационный плотномер — прибор для измерения плотности жидкости и газа под давлением.
- Метод гидростатического взвешивания.
Остеоденситометрия — процедура измерения плотности костной ткани человека.
См. также[править | править код]
Видеоурок: плотность вещества
- Список химических элементов с указанием их плотности
- Удельный вес
- Удельная плотность
- Относительная плотность
- Объёмная плотность
- Конденсация
- Консистенция (лат. consistere — состоять) — состояние вещества, степень мягкости или плотности (твёрдости) чего-либо — полутвердых-полумягких веществ (масел, мыла, красок, строительных растворов и т. д.); наприм., глицерин имеет сиропообразную консистенцию.
- Консистометр — прибор для измерения в условных физических единицах консистенции различных коллоидных и желеобразных веществ, а также суспензий и грубодисперсных сред, к примеру, паст, линиментов, гелей, кремов, мазей.
- Концентрация частиц
- Концентрация растворов
- Плотность заряда
- Уравнение неразрывности
Примечания[править | править код]
- ↑ Подразумевается также, что область стягивается к точке, то есть, не только её объём стремится к нулю (что могло бы быть не только при стягивании области к точке, но, например, к отрезку), но также стремится к нулю и её диаметр (максимальный линейный размер).
- ↑ Агекян Т. А. . Расширение Вселенной. Модель Вселенной // Звёзды, галактики, Метагалактика. 3-е изд. / Под ред. А. Б. Васильева. — М.: Наука, 1982. — 416 с. — С. 249.
- ↑ Planetary Fact Sheet Архивировано 14 марта 2016 года. (англ.)
- ↑ Sun Fact Sheet Архивная копия от 15 июля 2010 на Wayback Machine (англ.)
- ↑ Stern, S. A., et al. The Pluto system: Initial results from its exploration by New Horizons (англ.) // Science : journal. — 2015. — Vol. 350, no. 6258. — P. 249—352. — doi:10.1126/science.aad1815.
- ↑ МЕХАНИКА. МОЛЕКУЛЯРНАЯ ФИЗИКА. Учебно-методическое пособие к лабораторным работам № 1-51, 1-61, 1-71, 1-72. Санкт-Петербургский Государственный Технологический Университет Растительных Полимеров (2014). Дата обращения: 4 января 2019. Архивировано 23 ноября 2018 года.
- ↑ Krebs, 2006, p. 158.
- ↑ Krebs, 2006, p. 136.
- ↑ Krebs, 2006, p. 96.
- ↑ Krebs, 2006, p. 160.
- ↑ Krebs, 2006, p. 138.
- ↑ Krebs, 2006, p. 198.
- ↑ Krebs, 2006, p. 319.
- ↑ 1 2 Krebs, 2006, p. 165.
- ↑ Krebs, 2006, p. 179.
- ↑ Krebs, 2006, p. 163.
- ↑ Krebs, 2006, p. 141.
- ↑ Krebs, 2006, p. 67.
- ↑ Krebs, 2006, p. 108.
- ↑ Krebs, 2006, p. 57.
- ↑ Krebs, 2006, p. 313.
- ↑ Krebs, 2006, p. 105.
- ↑ Krebs, 2006, p. 50.
- ↑ Krebs, 2006, p. 151.
- ↑ Krebs, 2006, p. 111.
- ↑ Krebs, 2006, p. 60.
- ↑ Krebs, 2006, p. 168.
- ↑ Krebs, 2006, p. 101.
- ↑ Krebs, 2006, p. 54.
- ↑ Krebs, 2006, p. 134.
- ↑ Krebs, 2006, p. 98.
- ↑ Krebs, 2006, p. 47.
Литература[править | править код]
- Плотность — статья из Большой советской энциклопедии. — М.: «Советская Энциклопедия», 1975. — Т. 20. — С. 49.
- Плотность — статья из Физической энциклопедии. Т. 3, С. 637.
- Krebs R. E. . The History and Use of Our Earth’s Chemical Elements: A Reference Guide. 2nd edition. — Westport: Greenwood Publishing Group, 2006. — xxv + 422 p. — ISBN 0-313-33438-2.
Ссылки[править | править код]
- Онлайн интерактивная таблица плотности веществ Архивная копия от 29 апреля 2011 на Wayback Machine (рус.)
- Подробная таблица значений плотности распространенных жидкостей Архивная копия от 5 октября 2016 на Wayback Machine (рус.)
- Урок по теме “Плотность вещества” Архивная копия от 30 января 2022 на Wayback Machine
Под плотностью
или объемной массой тела понимают
отношение массы тела в состоянии
покоя к его объему.
Плотность газа в
нормальных физических условиях может
быть определена по его молекулярной
массе
,
кг/м3 (1)
Если плотность
газа задана при нормальном давлении,
то пересчет ее на другое давление р
(при той же температуре) для идеального
газа проводится по формуле
(Ш.2)
.
Часто для
характеристики газа применяют
относительную плотность его по воздуху
при нормальных условиях 0=0:1,293.
|
Коммерческие
расчеты в газовой промышленности
производятся при стандартных
физических условиях: давлении 0,1013 МПа
и температуре 20 °С.
Состав газовой смеси
Газовые смеси (как
и смеси жидкостей и паров) характеризуются
массовыми или молярными концентрациями
компонентов. Объемный состав газовой
смеси примерно совпадает с молярным,
так как объем 1 кмоля идеального газа
при одинаковых физических условиях, по
закону Авогадро, имеет одно и то же
численное значение, в частности при О
°С и 760 мм рт. ст. равен 22,41 м3.
Для характеристики
газовой смеси надо знать ее среднюю
молекулярную массу, среднюю плотность
в кг/м3
или относительную плотность по
воздуху.
Если известен
молярный состав смеси в процентах, то
средняя молекулярная масса
.
(3)
где у1,
у2,…,
уn
— молярные (объемные) доли компонентов,
%;
M1,
М2,
…, Мn
— молекулярные массы компонентов.
Если задан массовый
состав смеси в процентах, то ее средняя
молекулярная масса вычисляется по
формуле
(4)
где g1,
g2,
…, gn
— массовые доли компонентов, %.
Плотность смеси
см
определяют по вычисленному значению
средней молекулярной массы Мсм по
формуле, аналогичной (1):
.
(5)
Относительную
плотность определяют по формуле
(6)
где рcм
и рв
— плотность смеси и воздуха при
температуре О °С и нормальном давлении.
Содержание тяжелых углеводородов в газе
Для полной
характеристики природного газа необходимо
также знать содержание в нем тяжелых
углеводородов. Принято считать, что
в газе три фракции: пропановая, бутановая
и газовый бензин, причем последний, для
подсчета ресурсов, принимается
состоящим из 1/3 бутана и 2/3 пентана (по
массе).
Если дан массовый
или молярный состав газа, то содержание
тяжелых углеводородов определяется по
формуле
Gi
= 10giсм
= 10уii,
(7)
где gi
— массовая доля данного тяжелого
углеводорода в газе, %; cм
— средняя плотность природного газа,
кг/м3;
yi
— молярная доля данного тяжелого
углеводорода в газе, %; i–плотность
данного тяжелого углеводорода, кг/м3.
После определения
содержания в газе каждого отдельного
углеводорода (пропана, бутана, пентана
и высших) делают пересчет на содержание
пропана, бутана, газового бензина. Для
этого прибавляют к пентану требуемое
количество бутана, чтобы получить
газовый бензин
Пример. По данному
массовому составу газа требуется
определить содержание в нем пропана,
бутана и газового бензина (в г/м3).
Массовый состав газа (в %): метан—19,50;
этан—11,80; пропан — 37,95; изобутан — 3,25;
н-бутан—12,05; пентан и высшие — 8,15; азот
—7,30.
Решение. Для
определения средней плотности газа
найдем среднюю молекулярную массу газа
по формуле (4)
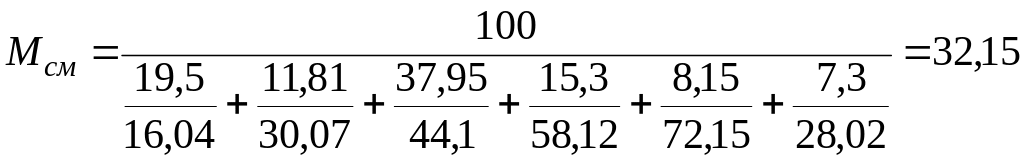
Средняя плотность
газа по формуле (5)
кг/м3
Состав газа
определим по формуле (7)
пропана 1037,951,43
= 542 г/м3
изобутана
103,251,43
= 46,5 г/м3
н-бутана
1012,051,43=172
г/м3
пентана и высших
108,151,43
= 117 г/м3
Итого:
877,5 г/м3
Газового бензина
(пентана две части и н-бутана одна часть)
будет 117 +117/2 = 175,5 г/м3
н-бутана 172 —58,5=
113,5 г/м3
изобутана
46,5 г/м3
пропана 542,0 г/м3
Всего тяжелых
углеводородов 877,5 г/м3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
физика! как из формулы Уравнение состояния идеального газа вывести формулу чтобы найти массу и плотность? формула внутри
Active.
Мастер
(2342),
закрыт
12 лет назад
pV=m/M * RT
Лучший ответ
химик
Мудрец
(14175)
12 лет назад
pV=m/M * RT
m=pVМ/RT
Плотность ро = м/V Следовательно обе части полученного уравнения делим на объем и получаем уравнение для плотность.
ро =pM/(RT)
Остальные ответы
Александр Босов
Ученик
(195)
4 года назад
а как найти значение V
Похожие вопросы
Какая плотность газа?
Плотность газов вычисляется, как отношение молярной массы газа к его молярному объему, который при 0°С и давлении 1 атм. равен 22,4 л/моль. Следует отметить, что самым легким газом является водород — плотность этого газа при нормальных условиях равна 0,0899 кг/м3.
Как вывести формулу плотности?
Плотность равна отношению массы тела к его объёму. В физике плотность обозначают греческой буквой ρ (ро). плотность = масса объём ρ = m V , где m — масса, V — объём. Основной единицей плотности вещества является кг м 3 .
Что такое плотность и чему она равна у природного газа?
Абсолютная плотность газа равна его массе в единице объема, в СИ она выражается в килограммах на кубический метр (кг/м3). Величину, обратную плотности, называют удельным объемом и измеряют в кубических метрах на килограмм (м3/кг).
Как находят плотность одного газа по отношению к другому?
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная. Пример 1. Относительная плотность газа по водороду равна 8.
Какая плотность природного газа кг м3?
Физические свойства Ориентировочные физические характеристики (зависят от состава; приведены при нормальных условиях, если не указано иное): Плотность: от 0,68 до 0,85 кг/м3 (сухой газообразный); 400 кг/м3 (жидкий).
Как определить легкий или тяжелый газ?
7.3.13 Легкий газ — газ, который при температуре окружающей среды 20 ºС и давлении 100 кПа имеет плотность 0,8 или менее по отношению к плотности воздуха. п. 7.3.14. Тяжелый газ — газ, который при тех же условиях, что и в 7.3.13, имеет плотность более 0,8 по отношению к плотности воздуха».
Чему равна плотность стали?
Средняя плотность конструкционной стали при комнатной температуре составляет величину 7700…7900 кг/м3. К примеру, плотность стали 20 имеет величину 7856 кг/м3 при температуре 20°С. Значение плотности стали в общем случае довольно близко к плотности железа поскольку этот металл является основой этого сплава.
Как найти объем по массе и плотности?
Объем (V) физического тела любой формы можно определить, если знать его массу (m) и среднюю плотность материала (p) — эти две величины надо перемножить: V=m∗p.
Какая плотность у водорода?
Его теплопроводность примерно в 7 раз выше теплопроводности воздуха. Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.
Что значит слово плотность?
Пло́тность — скалярная физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму. Для обозначения плотности обычно используется греческая буква ρ (ро) (происхождение обозначения подлежит уточнению), иногда используются также латинские буквы D и d (от лат. densitas — «плотность»).
Что такое плотность вещества как ее определяют?
Плотность — скалярная физическая величина. Определяется как отношение массы тела к занимаемому этим телом объему. Плотность зависит от температуры, агрегатного состояния вещества и внешнего давления.
Как рассчитывается относительная плотность?
Относи́тельной пло́тностью вещества называют отношение плотности исследуемого вещества к плотности эталонного вещества. В качестве эталонной жидкости чаще всего используют дистиллированную воду, плотность которой при +20 °C равна 998,203 кг/м3, а при температуре максимальной плотности (+4 °C) составляет 999,973 кг/м3.
Как определить плотность природного газа?
3.1 Общие положения
- 3.1.1 Плотность газа r вычисляют по формуле
- r = т/V. ( …
- rи = 103 × M × p/(R × T). ( …
- , (3)
- где Аj — масса килограмм-атома j-го элемента, входящего в состав молекулы;
- Значения R, pc, Tc приведены в разделе 4 ГОСТ 30319.0, a M и zc — в таблице 1. …
- Таблица 1.
Сколько кг в 1 м3 природного газа?
Другими словами 1 м3 сжиженного газа весит 2,1186 кг.
Какие газы относятся к легким?
относятся газы с плотностью не более 0,8 по отношению к плотности воздуха. В случае изменения состава сбрасываемого газа, приводящего к увеличению его плотности более 0,8 по отношению к плотности воздуха, сброс газа в атмосферу через сбросную трубу не рекомендуется.
Какой самый тяжелый газ?
Оно происходит от греческого «хаос». Водород — самый легкий, наиболее распространенный и взрывоопасный газ на земле. Атомный вес радона равен 222 атомных единиц массы. Это делает его самым тяжелым из известных газов.
Сколько весит 1 см3 стали?
Для них был рассчитан эталонный удельный вес стали равный 7,85 г/см3. В зависимости от марки конкретного сплава значение может отличаться в большую или меньшую сторону до 10% включительно. В таблице ниже приведена плотность наиболее распространенных марок стали.