Содержание
- Концентрация растворов. Приготовление водных растворов
- Плотность вещества
- Плотность вещества в химии
- Как рассчитать плотность вещества
- Примеры решения задач
- Что такое плотность раствора в химии
- Растворы
- ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ (1 2 3)
Концентрация растворов. Приготовление водных растворов
Для качественной характеристики растворов используют понятия «разбавленный раствор» и «концентрированный раствор». Разбавленный раствор содержит мало растворенного вещества, концентрированный – много растворенного вещества. Между концентрированным и разбавленным растворами нет резкой границы, она условна. Разбавленный раствор может быть насыщенным, если вещество практически не растворяется в воде (например, насыщенные растворы AgCl, BaSO4 и т.д.). В то же время концентрированный раствор (например, сахарозы) может быть ненасыщенным, так как растворимость сахарозы равна 179 г при 0°С в 100 мл воды.
Количественный состав растворов выражается концентрацией. Концентрацией раствора называется количество растворенного вещества в определённом количестве раствора или растворителя.
В химической практике наиболее употребительны следующие способы выражения концентраций.
1. Массовая доля растворённого вещества – это отношение массы растворённого вещества Х к общей массе раствора:
 ,
,
где ω (Х) – массовая доля растворенного вещества Х, выраженная в долях единицы; m(X) – масса растворенного вещества Х, г; m – общая масса раствора, г. Массовую долю можно выражать также в процентах ( % ):
 .
.
Если массовая доля растворенного хлорида натрия в растворе равна 0,03, или 3 %, то это означает, что в 100 г раствора содержится 3 г хлорида натрия и 97 г воды.
Зависимость между объемом (V) и массой раствора (m) выражается формулой
где ρ – плотность раствора, г/мл; V – объем раствора, мл; m – масса, г.
5. Мольная доля – отношение количества моль данного вещества к общему количеству моль всех веществ, имеющихся в растворе. Концентрация, выраженная этим способом, обычно обозначается для растворителя N1, для растворенных веществ – N2, N3 и т.д. В случае раствора одного вещества в другом мольная доля растворенного вещества N2 равна
 ,
,
где n1 и n2 – число молей растворителя и растворенного вещества соответственно.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 л раствора вещества 1 с нормальностью N1 реагирует с V2 л раствора вещества 2с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2.
Так как вещества реагируют в эквивалентных количествах, следовательно,
Таким образом, объёмы растворов реагирующих веществ обратно пропорциональны их нормальностям.
6. Титр Т – масса вещества, содержащегося в 1 мл раствора, г/мл:
 .
.
Титр связан с нормальностью соотношением
 ,
,
где Мэ – молярная масса эквивалента вещества.
Плотность растворов.Плотность раствора – это отношение его массы к объему, выражается в единицах г/см 3 и обозначается буквой r.
Плотность раствора изменяется при изменении его концентрации. Она может быть определена при помощи пикнометра, ареометра, гидростатических весов и др.
Для быстрого определения плотности жидкости служит ареометр. Ареометр представляет собой запаянную стеклянную трубку, нижний конец которой заполнен дробью или ртутью. Внутри верхней части трубки имеется шкала, отградуированная в единицах плотности. Плотность жидкости соответствует тому делению шкалы, до которого погружается ареометр при испытании. От плотности раствора можно перейти к процентному содержанию, если в таблицах не имеется цифры, точно отвечающей сделанному отсчету на шкале ареометра, а есть близкие величины (немного больше и немного меньше). В таком случае процентное содержание растворенного вещества вычисляют методом интерполяции (определение промежуточной величины по двум известным крайним).
Предположим, что имеется раствор серной кислоты с плотностью 1,200. По таблице находим, что для растворов серной кислоты с плотностью 1,174 и 1,205 процентная концентрация соответственно равна 24 и 28 %.
Находим разницу между плотностью нашего раствора и плотностью раствора кислоты с меньшей концентрацией. Она равна 1,200 – 1,174 = 0,026.
Увеличение плотности на 0,031 соответствует увеличению процентного содержания на 4%, а увеличение процентного содержания, соответствующее увеличению плотности на 0,026, находим из пропорции
Прибавляем к процентному содержанию кислоты в растворе с меньшей плотностью 3,35% и получаем искомое процентное содержание
Дата добавления: 2015-09-10 ; просмотров: 10 | Нарушение авторских прав
Источник
Плотность вещества
Плотность вещества в химии
Плотность можно вычислить по формуле:
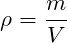
Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Как рассчитать плотность вещества
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO2) = 2 × 22 = 44 г/моль.
Примеры решения задач
| Задание | Вычислите объем воды и массу поваренной соли NaCl, которые потребуются для приготовления 250 мл 0,7 М раствора. Плотность раствора принять равной 1 г/см . Какова массовая доля хлорида натрия в таком растворе? . Какова массовая доля хлорида натрия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,7 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 250 мл этого раствора: |
n(NaCl) = 250 × 0,7 / 1000 = 0,175 моль.
Найдем массу 0,175 моль хлорида натрия:
M(NaCl) = Ar(Na) + Ar(Cl) = 23 + 35,5 = 58,5 г/моль.
m(NaCl) = n(NaCl) × M(NaCl);
m(NaCl) = 0,175 × 58,5 = 10,2375 г.
Вычислим массу воды, необходимую для получения 250 мл 0,7 М раствора поваренной соли:
msolution = V ×r = 250 × 1 = 250 г.
m(H2O) = 250 – 10,2375 = 239,7625 г.
Ответ Масса воды равна 239,7625 г, объем – этому же значению, поскольку плотность воды равна 1 г/см 
| Задание | Вычислите объем воды и массу нитрата калия KNO3, которые потребуются для приготовления 150 мл 0,5 М раствора. Плотность раствора принять равной 1 г/см . Какова массовая доля нитрата калия в таком растворе? . Какова массовая доля нитрата калия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,5 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 150 мл этого раствора: |
n(KNO3) = 150 × 0,5 / 1000 = 0,075 моль.
Найдем массу 0,075 моль нитрата калия:
M(KNO3) = Ar(K) + Ar(N) + 3×Ar(O) = 39 + 14 + 3×16 = 53 + 48 = 154 г/моль.
m(KNO3) = 0,075 ×154 = 11,55 г.
Вычислим массу воды, необходимую для получения 150 мл 0,5 М раствора нитрата калия:
msolution = V ×r = 150 ×1 = 150 г.
m(H2O) = 150 – 11,55 = 138,45 г.
Ответ Масса воды равна 138,45 г, объем – этому же значению, поскольку плотность воды равна 1 г/см 
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Источник
Что такое плотность раствора в химии
Плотность (старое название — удельный вес) раствора есть отношение его массы к объему. Обратная величина — отношение объема раствора к его массе — носит название удельного объема.
Поскольку 1 см 3 = 0,999973 мл (1 мл = 1,000027 см 3 ), различием между плотностями, выраженными в г/см 3 и г/мл, можно пренебречь с точностью ≈ 0,01 %.
В технологических схемах и рецептах XIX–начала XX века часто использовались ныне полностью вышедшие из употребления практические шкалы плотности (ареометрические шкалы Бомé, Картье и др.). Их описание см. в подразделе 3.1.3.
Зависимость плотности раствора от его концентрации достаточно сложна и неоднозначна. Для растворов индивидуальных веществ при фиксированной температуре ее обычно аппроксимируют двухпараметрическим полукубическим уравнением, имеющим некоторое физическое обоснование [1]:
 (3.1.1)
(3.1.1)
(здесь: c — молярная концентрация раствора (моль/л), r w — плотность воды при данной температуре, а A и B — параметры, подбираемые на основе экспериментальных данных). Иногда используют и другие выражения. Определенным недостатком уравнения (3.1.1) и ему подобных является то, что для вычисления плотности раствора с концентрацией, выраженной, например, в масс. %, требуется перевести эту концентрацию в молярную (моль/л), что само по себе требует знания плотности раствора. Один из возможных подходов к решению возникающей проблемы см. в подразделе 3.1.4. Для многокомпонентных растворов каких-либо общих зависимостей плотности от концентрации не существует. При аппроксимации следует иметь в виду, что даже для идеальных растворов плотность является аддитивной величиной только при выражении концентраций в объемных долях, но не в обычно используемых масс. % (мольных долях, молярностях, моляльностях и т. д.). В этих концентрациях аддитивен — для идеальных систем — удельный объем [2, 3].
Для большинства веществ с увеличением температуры плотность уменьшается. Однако вода и многие водные растворы имеют максимум плотности в районе 4 °C. Для аппроксимации плотности на небольшом (5–10 °C) интервале при комнатной температуре может быть использована линейная зависимость
 , (3.1.2)
, (3.1.2)
где T0 — произвольная температура, принятая за точку отсчета, a — температурный коэффициент. Для бóльших интервалов обычно используют квадратное уравнение, которое с учетом зависимости плотности от концентрации (3.1.1) имеет вид:
 (3.1.3)
(3.1.3)
где буквами от A до F обозначены параметры, подбираемые на основе экспериментальных данных. Для значительного числа водных растворов неорганических солей параметры уравнений (3.1.1) и (3.1.3) протабулированы в работе [4].

3.1.1. Плотность водных растворов неорганических соединений и солей органических кислот
Данные о плотностях водных растворов неорганических и органических соединений, олеума, растворов NO2 в безводной азотной кислоте, а также растворов нитрозилсерной кислоты в водных растворах H2SO4 (нитрозы) приведены в виде таблиц 3.1.1–3.1.319 и 3.1.320–3.1.338 в подразделах 3.1.1 и 3.1.2.
Значения плотности выражены: r — в кг/м 3 или г/см 3 ; r ‘ — в г/л или г/мл. В части таблиц приведена относительная плотность  . Концентрации, как правило, заданы в масс. % (для пересчета концентраций в скобках после названия вещества приведены молярные массы по ИЮПАК–1993). Для большинства систем точность данных вполне достаточна для практических приложений. В редких случаях ошибка приводимых значений плотности может достигать 1 %; тем не менее, в ответственных работах нельзя рекомендовать определение концентрации раствора по его плотности. Для удобства пользования таблицы снабжены указателями; химические соединения в указателях расположены в алфавитном порядке названий.
. Концентрации, как правило, заданы в масс. % (для пересчета концентраций в скобках после названия вещества приведены молярные массы по ИЮПАК–1993). Для большинства систем точность данных вполне достаточна для практических приложений. В редких случаях ошибка приводимых значений плотности может достигать 1 %; тем не менее, в ответственных работах нельзя рекомендовать определение концентрации раствора по его плотности. Для удобства пользования таблицы снабжены указателями; химические соединения в указателях расположены в алфавитном порядке названий.
Ваш обозреватель не поддерживает встроенные рамки или он не настроен на их отображение.
Ваш обозреватель не поддерживает встроенные рамки или он не настроен на их отображение.
Серебра(I) перхлорат AgClO4 (207,319)
Источник
Растворы
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
Обратите внимание!
При попадании в воду вещество может:
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси Vр-ра, л:
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом.
Источник
ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ (1 2 3)
Плотностью вещества называют отношение массы тела к его объему:

Следовательно, плотность вещества выражают * в г/см3. Удельным весом у называют отношение веса (силы тяжести) вещества к объему:

Плотность и удельный вес вещества находятся в такой же зависимости между собой, как масса и вес, т. е.

где g — местное значение ускорения силы тяжести при свободном падении. Таким образом, размерность удельного веса ‘(г/см2 • сек2) и плотности (г/см3), а также их числовые значения, выраженные в одной системе единиц, отличаются друг от друга *.
Плотность тела не зависит от его местонахождения на Земле, в то время как удельный вес изменяется в зависимости от того, в каком месте Земли его измерить.
В ряде случаев предпочитают пользоваться так называемой относительной плотностью, представляющей собой отношение плотности данного вещества к плотности другого вещества при определенных условиях. Относительная плотность выражается отвлеченным числом.
Относительную плотность d жидких и твердых веществ принято определять по отношению к плотности дистиллированной воды:
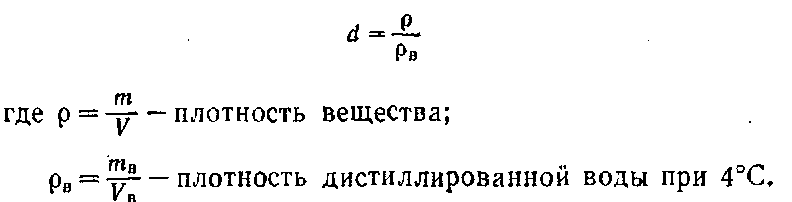
Само собой разумеется, что р и рв должны выражаться одинаковыми единицами.
Относительную плотность d можно также выражать отношением массы взятого вещества к массе дистиллированной воды, взятой в том же объеме, что и вещество, при определенных, постоянных условиях.
Поскольку числовые значения как относительной плотности, так и относительного удельного веса при указанных постоянных условиях являются одинаковыми, пользоваться таблицами относительных удельных весов в справочниках можно так же, как если бы это были таблицы плотности.
Относительная плотность является постоянной величиной для каждого химически однородного вещества и для растворов при данной температуре. Поэтому по
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
* В ряде случаев плотность выражают в г/мл. Различие между числовыми значениями плотности, выраженными в г/см3 и г/мл, очень незначительно. Его следует принимать во внимание лишь при работах особой точности.
Поэтому по величине относительной плотности во многих случаях можно судить о концентрации вещества в растворе.
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
Обычно плотность раствора увеличивается с увеличением концентрации растворенного вещества (если оно само имеет плотность больше, чем растворитель). Но имеются вещества, для которых увеличение плотности с увеличением концентрации идет только до известного предела, после которого при увеличении концентрации происходит уменьшение плотности.
Например, серная кислота имеет наивысшую плотность, равную 1,8415 при концентрации 97,35%. Дальнейшее увеличение концентрации сопровождается уменьшением плотности до 1,8315, что соответствует 99,31%.
Уксусная кислота имеет максимальную плотность при концентрации 77- 79%, а 100%-ная уксусная кислота имеет ту же плотность, что и 41%-ная.
Относительная плотность зависит от температуры, при которой ее определяют. Поэтому всегда указывают температуру, при которой делали определение, и температуру воды (объем взят за единицу). В справочниках это показывают при помощи соответствующих индексов, например eft; приведенное обозначение указывает, что относительная плотность определена при температуре 2O0C и за единицу для сравнения взята плотность воды при температуре 4е С. Встречаются также и другие индексы, обозначающие условия, при которых производилось определение относительной плотности, например Я4 Ul и т. д.
Изменение относительной плотности 90%-ной серной кислоты в зависимости от температуры окружающей среды приводится ниже:

Относительная плотность с повышением температуры уменьшается, с понижением ее —увеличивается.
При определении относительной плотности необходимо отмечать температуру, при которой оно проведено, и полученные величины сравнивать с табличными данны-, ми, определенными при той_же температуре.
Если измерение проведено не при той температуре, которая указана в справочнике, то. вводят поправку, вычисляемую как среднее изменение относительной плотпости на один градус. Например, если в интервале между 15 и 20 0C относительная плотность 90%-ной серной кислоты уменьшается на 1,8198—1,8144 = 0,0054, то в среднем можно принять, что при изменении температуры на 1 0С (выше 15 0C) относительная плотность уменьшается на 0,0054 : 5 = 0,0011.
Таким образом, если определение вести при 18 0C, то относительная плотность указанного раствора должна быть равна:

Однако для введения температурной поправки к относительной плотности удобнее пользоваться приведенной ниже номограммой (рис. 488). Эта номограмма, кроме того, дает возможность но известной относительной плотности, вычисленной при стандартной температуре 20° С, приближенно определять относительную плотность при других температурах, в чем иногда может возникнуть потребность.Относительную плотность жидкостей можно определять при помощи ареометров, пикнометров, специальных весов и т. п.
Определение относительной плотности ареометрами.
Для быстрого определения относительной плотности жидкости применяют так называемые ареометры (рис. 489). Это—стеклянная трубка (рис. 489, а), расширяющаяся внизу и имеющая на конце стеклянный резервуар, заполненный дробью нли специальной массой, (реже — ртутью). В верхней узкой части ареометра имеется шкала с делениями. Чем меньше относительная плотность жидкости, тем глубже погружается в нее ареометр. Поэтому на его шкале вверху нанесено наименьшее значение относительной плотности, которое можно определить данным ареометром, внизу — наибольшее. Например, у ареометров для жидкостей с относительной плотностью меньше единицы внизу стоит 1,000, выше 0,990, еще выше 0,980 и т. д.
Промежутки между цифрами разделены на более мелкие деления, позволяющие определять относительную плотность с точностью до третьего десятичного знака. У наиболее точных ареометров шкала охватывает значения относительной плотности в пределах 0,2—0,4 единицы (например, Для определения плотности от 1,000 до 1,200, от 1,200 до 1,400 и т. д.). Такие ареометры обычно продают в виде наборов, которые дают возможность определять относительную плотность в широком интервале.

Номограмма для введения температурной поправки
Иногда ареометры снабжены термометрами (рис. 489,6), что позволяет одновременно измерять температуру, при которой проводится определение. Для определения относительной плотности при помощи ареометра жидкость наливают в стеклянный цилиндр (рис. 490) емкостью не менее 0,5 л, сходный по форме с мерным, но без носика и делений. Размер цилиндра должен соответствовать размеру ареометра. Наливать жидкость в цилиндр до краев не следует, так как при погружении ареометра жидкость может перелиться через край. Это бывает даже опасно при измерении плотности концентрированных кислот или концентрированных щелочей и пр. Поэтому уровень жидкости в цилиндре должен быть на несколько сантиметров ниже края цилиндра.
Иногда цилиндр для определения плотности имеет вверху желоб, расположенный концентрически, так что если жидкость при погружении ареометра перельется через край, то она не выльется на стол.
Для определения относительной плотности имеются специальные приборы, поддерживающие постоянный уровень жидкости в цилиндре. Схема одного из таких приборов приведена на рис. 491. Это — цилиндр 2, имеющий на определенной высоте отводную трубку 3 для стекания жидкости, вытесняемой ареометром при погружении его в жидкость. Вытесняемая жидкость поступает в трубку 4, имеющую кран 5, через который жидкость может быть слита. Цилиндр можно наполнять исследуемой жидкостью через уравнительную трубку /, имеющую в верхней части цилиндрическое расширение.
Источник
Как определить плотность раствора
Раствор характеризуется объемом, концентрацией, температурой, плотностью и другими параметрами. Плотность раствора меняется в зависимости от массы и концентрации растворенного вещества.

Инструкция
Ключевой формулой для плотности является ρ=m/V, где ρ – плотность, m – масса раствора, V – его объем. Плотность может выражаться, например, в килограммах на литр, или в граммах на миллилитр. В любом случае, она показывает, сколько вещества по массе приходится на единицу объема.
Масса раствора складывается из массы жидкости и массы растворенного в ней вещества: m(раствора)=m(жидкости)+m(растворенного вещества). Масса растворенного вещества и объем раствора могут быть найдены из известного значения концентрации и молярной массы.
Пусть, например, в задаче дана молярная концентрация раствора. Она обозначается химической формулой соединения в квадратных скобках. Так, запись [KOH]=15 моль/л означает, что в одном литре раствора содержится 15 моль вещества гидроксида калия.
Молярная масса KOH составляет 39+16+1=56 г/моль. Молярные массы элементов можно посмотреть в таблице Менделеева, они указываются обычно снизу от наименования элемента. Количество вещества, масса вещества и его молярная масса связаны соотношением ν=m/M, где ν – количество вещества (моль), m – масса (г), M – молярная масса (г/моль).
Растворы, помимо жидкостных, бывают еще и газовыми. В этом случае необходимо понимать, что в равных объемах газа, близкого к идеальному, при одних и тех же условиях содержится одно и то же число молей. К примеру, при нормальных условиях один моль любого газа занимает объем Vm=22,4 л/моль, который назван молярным объемом.
В решении задачи на плотность газового раствора может понадобиться соотношение, устанавливающее связь между количеством вещества и объемом: ν=V/Vm, где ν – количество вещества, V – объем раствора, Vm – молярный объем, постоянная величина для данных условий. Как правило, в подобных задачах обговаривается, что условия являются нормальными (н.у.).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Цель
работы:
рассчитать и приготовить насыщенный
раствор соли.
Получите
задание:
раствор, какого вещества, и в каком
количестве следует приготовить. Исходя
из коэффициента растворимости, рассчитайте
необходимые количества вещества и воды.
Растворяемое вещество шпателем перенесите
на предварительно взвешенное часовое
стекло и отвесьте чуть больше рассчитанной
величины. Навеска вещества определяется
по разности общей массы вещества с
часовым стеклом и массы чистого часового
стекла. Навеску вещества поместите в
стакан емкостью 250 мл и к ней прилейте
необходимый объем воды, отобранный с
помощью цилиндра. Небольшой порцией
воды из отобранного объема смыть остатки
вещества с часового стекла в стакан для
растворения.
По
справочному пособию определите, как
меняется коэффициент растворимости в
зависимости от изменения температуры.
Добейтесь растворения избыточной массы
вещества в заданном объеме раствора
путем изменения внешних условий (как
это сделать в конкретном случае?).
Приведите приготовленный раствор к
стандартным условиям и, в случае
кристаллизации избытка растворенного
вещества, отфильтруйте. Определите
плотность насыщенного раствора по
методике, описанной ниже.
Рассчитайте
молярную концентрацию и молярную
концентрацию эквивалента раствора.
Результаты эксперимента оформите в
виде таблицы.
Таблица
1
|
№№ |
р |
w |
P,% |
С(Х), |
С(1/ZX), |
-
Определение
плотности раствора
Для
определения плотности раствора
используется набор ареометров с разной
градуировочной шкалой. Раствор для
измерения плотности помещается в высокий
сосуд (цилиндр), не до конца заполняя
его. Из набора выбирают ареометр со
шкалой плотностей, наиболее близкий
ожидаемой плотности раствора. Ареометр
своим широким утяжеленным концом
медленно погружается в раствор. При
этом тонкая часть ареометра придерживается
двумя пальцами до тех пор, пока не будет
ощущаться выталкивающая сила (всплывание).
Ареометр отпускается и по нижнему уровню
мениска раствора на шкале ареометра
производится отсчет плотности. В случае,
если ареометр всплывает или уровень
раствора не доходит до шкалы, следует
использовать ареометр со шкалой,
рассчитанной на большую плотность. Если
ареометр тонет в растворе или уровень
жидкости оказывается выше проградуированной
шкалы, воспользуйтесь ареометром,
рассчитанным на меньшую плотность.
При
использовании ареометра следует до и
после применения промыть его в
дистиллированной воде и осушить с
помощью фильтровальной бумаги. Почему
это необходимо сделать?
Плотности
растворов кислот, щелочей, солей в
зависимости от концентраций их растворов
представлены в справочных руководствах.
-
Приготовление
растворов методом разбавления
Получить
у преподавателя 2 задания:
-
Из
приготовленного ранее насыщенного
раствора NaCl
приготовить более разбавленный раствор
соли заданной молярной концентрации
в заданном объеме (100, 50, 200, 250 мл). Для
этого надо рассчитать, какая масса
растворенного вещества требуется для
приготовления заданного объема раствора,
в каком объеме исходного раствора
содержится рассчитанная масса
растворенного вещества. Отобрать
необходимый (рассчитанный) объем
раствора с помощью пипетки и перенести
в мерную колбу. Довести объем до метки
добавлением дистиллированной воды.
Правильность приготовления раствора
проверить по плотности (См. справочник
Ю.Ю.Лурье).
Опыт
1. Приготовление раствора щелочи с
заданной массовой долей по навеске из
кристаллической щелочи
-
Получить
задание у преподавателя. Приготовить
из кристаллического гидроксида натрия
или калия и воды определенное количество
(в мл) раствора заданной преподавателем
концентрации. -
Рассчитать
необходимое для приготовления данного
раствора количество вещества (KOH или
NaOH) и растворителя – воды. -
Отвесить
рассчитанное количество гидроксида
калия или натрия в предварительно
взвешенном стакане на технических
весах. (Осторожно!
Беречь глаза! Не касаться руками гранул
щелочи! Вещество отбирать только чистым
шпателем!) -
Мерным
цилиндром отмерить необходимое
количество воды, вылить воду в стакан
и растворить в ней щелочь, осторожно
перемешивая раствор стеклянной палочкой.
Охладить раствор до температуры
окружающей среды. -
Определить
плотность полученного раствора. Для
этого в приготовленный сухой (или
ополоснутый данным раствором) цилиндр
налить раствор, опустить в него ареометр
так, чтобы он не касался стенок цилиндра,
не тонул и не всплывал. Отметить то
деление шкалы, которое совпадает с
нижнем краем мениска жидкости в цилиндре,
произвести отсчет по шкале сверху вниз.
Ареометр промыть дистиллированной
водой, осторожно вытереть и сдать
лаборанту, раствор вылить в приготовленную
склянку. Сравнить полученную величину
плотности раствора щелочи с табличной
и определить массовую долю приготовленного
раствора по таблице, исходя из
экспериментальной величины плотности
полученного раствора щелочи.
Если
табличные данные плотности точно не
совпадают с показаниями ареометра, то
концентрацию определяют методом
интерполяции. В узком интервале
зависимость плотности от концентрации
можно считать линейной. Допустим, что
при помощи ареометра найдено, что
плотность раствора равна 1,247. В таблице
же указаны плотности 1,241 и 1,263, которым
соответствуют концентрации 22% и 24%.
Следовательно, изменению концентрации
на 2% соответствует изменение плотности
на величину 1,263-1,241 = 0,022. Наш раствор
отличается по плотности от 1,241 на величину
равную 0,006 (1,247-1,241). Составляем пропорцию:
0,022
– 2%
0,006
–Х% Х = 0,3%
Следовательно,
исходный раствор содержал 22 + 0,3 = 22,3%
-
Полученные
данные занести в таблицу 2.
Таблица
2
|
Наименование |
Кол-во |
Плотность |
w% |
Количество |
Молярная |
Опыт
2 Определение молярной концентрации
эквивалента приготовленного раствора
щелочи
-
Определить
точную концентрацию раствора щелочи,
приготовленного в предыдущем опыте
путем титрования его раствором кислоты
с точно известной концентрацией.
Операция титрования выполняется
следующим образом. Раствором кислоты
с точно известной концентрацией
ополоснуть бюретку. Для заполнения
бюретки раствором необходимо использовать
воронку. Затем заполнить бюретку
раствором кислоты так, чтобы мениск
раствора совпадал с нулевым делением
бюретки. Носик бюретки должен быть
полностью заполнен жидкостью (не должно
быть пузырьков воздуха). Тщательно
вымытую пипетку на 5 мл ополоснуть
анализируемым раствором щелочи,
приготовленным в первом опыте. Затем
этой пипеткой отобрать 5 мл раствора
щелочи в коническую колбу для титрования
(последние капли из пипетки удалить,
коснувшись кончиком пипетки стенки
колбы, но
не выдувать!).
Прибавить в колбу 2-3 капли индикатора
метилового оранжевого. Какую окраску
приобретет раствор? Колбу с раствором
поставить на лист белой бумаги и
расположить под бюреткой так, чтобы
конец ее был погружен в колбу приблизительно
на 1 см. Рядом поставить колбу с раствором
сравнения (в дистиллированную воду
прилить 2-3 капли индикатора). В колбу с
раствором щелочи левой рукой по капле
прибавлять раствор кислоты из бюретки,
постоянно перемешивая правой рукой
жидкость вращением колбы. Колбу из-под
бюретки не выносить. Конец реакции
определить по мгновенному изменению
окраски раствора щелочи. В результате
этого опыта устанавливают с точностью
до 1 мл количество кислоты, необходимое
для нейтрализации щелочи. Титрование
повторяют не менее 3 раз. Результат
первого опыта считается как ориентировочный
и при расчете не учитывается. При
последующих титрованиях сначала быстро
прибавляют из бюретки в колбу необходимое
для нейтрализации количество кислоты
за исключением последнего миллилитра,
который добавляют в раствор по каплям
до тех пор, пока от прибавления одной
капли не произойдет изменение окраски
раствора.
Окраску
раствора в точке эквивалентности
сравнивать с окраской раствора сравнения.
Объем
раствора кислоты, затраченный на
нейтрализацию, отсчитывать оп нижнему
мениску с точностью до 0,05 мл. Из полученных
данных, которые не должны различаться
между собой более чем на 0,1 мл, найти
среднюю величину.
-
Рассчитать
молярную концентрацию эквивалента,
массовую долю приготовленного раствора
щелочи. Данные занести в таблицу 3.
Таблица
3
|
Число |
Объем |
C(1/Z*X |
V |
Израсходовано |
Концентрация |
-
Сравнить
концентрацию раствора щелочи, рассчитанных
в опыте 1 и опыте 2. Объяснить полученные
результаты. -
Контрольные
вопросы.
-
При
взаимодействии с водой некоторого
металла при нагревании образовался
двухвалентный оксид этого металла
массой 16,2 г и водород массой 0,4 г.
Определите, какой металл был взят для
реакции с водой -
Раствор
с массовой долей серной кислоты 44 %
имеет плотность 1,34 г/мл. Рассчитайте
количество вещества Н2SO4,
которое содержится в 1 л такого раствора. -
Определите
массу оксида серы (VI), который надо
растворить в 4 кг воды, чтобы получить
раствор с массовой долей серной кислоты
4,9 %. -
Определите
массу раствора с массовой долей серной
кислоты 5 %, который потребуется для
реакции с 4 г оксида меди (II). -
Для
полного растворения оксида магния
массой 3,6 г потребовался раствор соляной
кислоты массой 65,7 г. Вычислите массовую
долю НСl в растворе кислоты. -
Оксид
кальция массой 2,8 г растворили в 200 г
хлороводородной кислоты. Рассчитайте
массовую долю хлорида кальция в
полученном растворе. -
К
раствору нитрата свинца (II) массой 250 г
прилили избыток раствора сульфида
калия. Образовался осадок массой 47,8 г.
Определите массовую долю нитрата свинца
(II) в исходном растворе. -
Рассчитайте
массовые доли серы и оксида серы (VI) в
серной кислоте и олеуме, предположив,
что он имеет состав Н2SO4*SO3. -
К
50 мл раствора с массовой долей Н2SO4
12 % (плотность 1,08 г/мл) добавили избыток
раствора хлорида бария. Определите
массу образовавшегося осадка. -
Действием
избытка серной кислоты на хлорид калия
массой 14,9 г получили хлороводород,
который поглотили 80 г раствора с массовой
долей гидроксида натрия 15 %. Определите,
будет ли полученный раствор щелочным
или кислым.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
$begingroup$
Is there a way to calculate the density of a saturated salt solution from the solubility limits or does it have to be experimentally determined?
First instinct, is to add the mass of the salt to mass of the water e.g. a solubility of $pu{80 g}$ of salt in $pu{100 mL}$ would have a solution density of $pu{180 g/100 mL = 1.8 g/mL}$. However, it seems the salt should affect the volume of the solution. What additional information is needed or does this quantity just have to be empirically determined?
![]()
asked Jan 24, 2018 at 18:32
$endgroup$
2
$begingroup$
Often, solubility is given as mass per volume of solution (not solute). Nevertheless, unless you have the mass percentage (w) too, you are not able to calculate the density of the solution.
answered Jan 24, 2018 at 20:25
GreenSmurfGreenSmurf
3461 silver badge11 bronze badges
$endgroup$
$begingroup$
This is something you can calculate, provided you know the partial molar volumes of all the substances in your solution. But someone must have measured those at some point, and tabulated it for your conditions (or close enough that you can interpolate). You can probably estimate it closely enough, depending on your needs.
The experiment would be as simple as taking a known volume aliquot of your saturated solution and weighing it.
answered Nov 21, 2018 at 10:33
![]()
Buck Thorn♦Buck Thorn
20.3k5 gold badges35 silver badges82 bronze badges
$endgroup$
$begingroup$
Your proposed method (adding the masses, but using the volume of the solvent) can work under certain circumstances; it is often a good first approximation for the times when it is not a good assumption.
For low solubility salts, you can safely assume that the volume of the solution is the same as the volume of the solvent. “Low” here is somewhat open for debate. As a general rule, I feel safer with this assumption for each order of magnitude below 1 molar / molal. So, I consider this method valid to one (or fewer) sigfigs for solutions near 1.0 molar; 0.1 M makes me feel “2 sig figs safe”, etc. (Again, these are just guidelines, don’t get hung up on specific numbers.) With a salt that can only dissolve fewer than 10 grams into 100g of water, this method is usually fine to 2 or 3 sig figs. A salt that dissolves less than 1.0g into 100g of water is now getting into the territory of measurement errors of accurately measuring the volume of the solution (in most high school or even some college labs).
Seawater runs about 3% salt to water by mass. Estimating it’s density at 1.03 g/mL is pretty valid. In the example in the OP of 80g of salt in 100mL of water (giving a value of 1.8 g/mL) is a good first order approximation, but I would take that value with… a grain of salt.
answered Nov 21, 2018 at 13:27
VanVan
3111 silver badge6 bronze badges
$endgroup$
XXXVII конкурс исследовательских работ учащихся
в области естественных и гуманитарных наук
Верещагинский район
Муниципальное автономное образовательное учреждение
«Средняя общеобразовательная школа № 1»
Естественный блок
Направление: химия
ЗАВИСИМОСТЬ ПЛОТНОСТИ РАСТВОРОВ
СОЛЕЙ ОТ КОНЦЕНТРАЦИИ ПРИ 20⁰C
|
фамилия, имя, отчество участника (полностью) |
Носкова Елена |
|
полное наименование образовательной организации (согласно Уставу) |
Муниципальное автономное образовательное учреждение «Средняя общеобразовательная школа № 1» |
|
класс (курс) участника |
9 |
|
контактный телефон участника |
|
|
фамилия, имя, отчество научного руководителя (полностью) |
к.х.н. Носков Михаил Николаевич |
|
место работы руководителя |
МАОУ «СОШ № 1» |
|
должность руководителя |
Учитель химии |
|
контактный телефон руководителя |
8 952 330 93 19 |
Пермь – 2017
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………………………………………3
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ………………………….….………4
2.1. Характеристика использованных веществ и оборудования….……..4
2.2. Определение массы воды в зависимости от температуры…………..6
2.3. Определение зависимости плотности растворов от
концентрации хромата калия………………………………………….6
2.4. Определение зависимости плотности растворов от концентрации
сульфата меди…………………………………………………………7
2.5. Определение зависимости плотности растворов от концентрации
хлорид бария…………………………………………………………..9
2.6. Определение зависимости плотности растворов от концентрации
нитрата аммония……………………………………………………..10
2.7. Определение зависимости плотности растворов от концентрации
хлорида натрия……………………………………………………….12
2.8. Определение зависимости плотности растворов от концентрации
сульфита натрия……………………………………..……………….12
ВЫВОДЫ…………………………………………………………………..15
СПИСОК ЛИТЕРАТУРЫ………………………………………………….16
ВВЕДЕНИЕ
Проблема: Такое физическо-химическое свойство растворов, как плотность зависит от природы вещества. А каков характер зависимости плотности растворов от концентрации.
Тема: Зависимость плотности растворов солей от концентрации при 20⁰С
Актуальность: Применение растворов в быту и в промышленности имеет широкое распространение. Для применения растворов необходимы физические характеристики, одним из которых является плотность раствора. Исследованию физико-химических свойств растворов уделяется значительное количество времени и средств. При этом экспериментальное исследование и теоретический прогноз составов и свойств растворов остаются наиболее актуальными задачами физико-химического анализа. Кроме того, прогнозирование области существования растворов с известными составами, их структуры и физико-химических свойств позволяет значительно облегчить экспериментальное исследование многокомпонентных систем.
Цель: Узнать зависимость плотностей растворов от концентраций различных солей.
Гипотеза: При увеличении концентрации растворов солей плотность увеличивается.
Задачи:
1) Подготовить реактивы к работе.
2) Приготовить растворы солей с различной концентрацией.
3) Для каждого раствора определить плотность.
4) Изобразить функциональную зависимость плотности растворов от концентраций.
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Характеристика использованных веществ и оборудования
Хромат калия K2CrO4. Неорганическое соединение, соль металла калия и хромовой кислоты, жёлтые кристаллы, растворимые в воде, окрашивает раствор в желтый цвет. Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam. При 668°С переходит в гексагональную красную фазу.
Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле.
Сульфат меди CuSO4. Неорганическое соединение, медная соль серной кислоты. Нелетучее, не имеет запаха. Безводное вещество бесцветное, непрозрачное, очень гигроскопичное. Кристаллогидраты — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду). Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купоро́с. Токсичность медного купороса для теплокровных животных относительно невысокая.
Хлорид бария BaCl2. Бинарное неорганическое вещество, относящееся к классу солей. Химическая формула — BaCl2. Хлорид бария при стандартных условиях представляет собой бесцветные ромбические кристаллы. Мало растворим в спирте, не растворим в эфире. Из водных растворов кристаллизуется дигидрат хлорида бария бесцветные кристаллы с моноклинной решёткой. Токсичен, ПДК 0,5 мг/м³.
Нитрат аммония NH4NO3 Химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении — 235 °C. Молекулярная масса 80,04 а. е. м. Скорость детонации 2570 м/с.
Хлорид натрия NaCl. Натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Сульфит натрия Na2SO3. Бесцветные кристаллы, соль натрия и сернистой кислоты, растворяется в воде, образует кристаллогидраты. Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3·7H2O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
В работе использованы реактивы следующих марок:
Хлорид натрия — марки «хч»
Хромат калия K2CrO4 — марки «хч»
Сульфат меди CuSO4 — марки «хч»
Хлорид бария BaCl2 — марки «хч»
Нитрат аммония NH4NO3 — марки «хч»
Сульфит натрия Na2SO3— марки «хч»
Дистиллированная вода, nD25=1.3325.
Использованное оборудование
Взвешивание компонентов проводилось на весах «Ингредиент EHA501», (100г); дозатор Sartorius Proline 1-5 ml; мерные колбы 50 мл, 100 мл, 250 мл; ареометр 1.0 – 1.6.
2.2. Определение массы воды в зависимости от температуры
Для определения концентрации соли необходимо определение массы воды. Для приготовления растворов использовался точный объём воды. Для определения массы воды пользовались таблицей плотности воды от температуры (рисунок 1). Чтобы определить массу воды объём умножали на плотность при соответствующей температуре.
Таблица 1
Плотность воды при различной температуре.

2.3. Определение зависимости плотности растворов от концентрации хромата калия.
Для определения зависимости плотности растворов от концентрации готовили насыщенный раствор хромата калия. Для этого отмеряли 400 мл дистиллированной воды с температурой 17⁰С и добавляли хромат калия массой 202,15 г. Полученную смесь перемешивали до растворения. Полученный насыщенный раствор доводили до 20⁰С. И с помощью ареометра измерили плотность раствора. Для получения раствора 2 с меньшей концентрацией, к раствору 1 прибавляли 100 мл воды. Полученный раствор 2 перемешивали и доводили до 20⁰С. С помощью ареометра измерили плотность раствора. Для получения раствора 3 отливали 50 мл раствора 2 и добавляли 100 мл воды и проводили измерения. Для получения раствора 4 отливали 100 мл раствора 3 и добавляли 50 мл воды и проводили измерения. Для получения раствора 5 отливали 100 мл раствора 4 и добавляли 100 мл воды. Для получения раствора 6 отливали 100 мл раствора 5 и добавляли 100 мл воды. Для получения раствора 7 отливали 150 мл раствора 6 и добавляли 100 мл воды. Для получения раствора 8 добавляли 250 мл воды. Для получения раствора 9 отливали 250 мл раствора 8 и добавляли 250 мл воды. Полученный раствор доводили до 20⁰С и с помощью ареометра измеряли плотность. По полученным данным вычисляли массовую концентрацию растворов. Полученные данные занесены в таблицу 2.
Таблица 2
Плотности растворов хромата калия при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
K2CrO4 |
H2O |
||
|
Раствор 1 |
33,60 |
66,40 |
1,315 |
|
Раствор 2 |
28,81 |
71,19 |
1,262 |
|
Раствор 3 |
24,91 |
75,09 |
1,222 |
|
Раствор 4 |
23,04 |
76,96 |
1,205 |
|
Раствор 5 |
19,47 |
80,53 |
1,169 |
|
Раствор 6 |
16,38 |
83,62 |
1,140 |
|
Раствор 7 |
13,44 |
86,56 |
1,111 |
|
Раствор 8 |
9,28 |
90,72 |
1,075 |
|
Раствор 9 |
6,34 |
93,66 |
1,051 |
Полученные данные функциональной зависимости плотности растворов от концентрации хромата калия были изображены на рисунке 1.Данная зависимость имеет незначительное отклонение от прямой линии.
2.4. Определение зависимости плотности растворов от
концентрации сульфата меди
Для определения зависимости плотности растворов от концентрации готовили насыщенный раствор сульфата меди. Для этого отмеряли 250 мл дистиллированной воды с температурой 16⁰С и добавляли сульфат меди массой 45,08 г. Полученную смесь перемешивали до растворения. Полученный насыщенный раствор доводили до 20⁰С и с помощью ареометра измерили плотность раствора. Для получения раствора 2 с меньшей концентрацией отливали 50 мл раствора 1 и прибавляли 50 мл воды. Полученный раствор 2 перемешивали и доводили до 20⁰С. С помощью ареометра измерили плотность раствора. Для получения раствора 3 добавляли 50 мл воды и проводили измерения. Для получения раствора 4 отливали 50 мл раствора 3 и добавляли 50 мл воды и проводили измерения. Для получения раствора 5 отливали 50 мл раствора 4 и добавляли 50 мл воды. Для получения раствора 6 отливали 50 мл раствора 5 и добавляли 50 мл воды. Для получения раствора 7 отливали 50 мл раствора 6 и добавляли 50 мл воды. Для получения раствора 8 отливали 50 мл раствора 7 и добавляли 50 мл воды. Полученный раствор доводили до 20⁰С и с помощью ареометра измеряли плотность. По полученным данным вычисляли массовую концентрацию растворов. Полученные данные занесены в таблицу 3.
Таблица 3
Плотности растворов сульфата меди при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
CuSO4 |
H2O |
||
|
Раствор 1 |
15,29 |
84,71 |
1,100 |
|
Раствор 2 |
12,65 |
87,35 |
1,080 |
|
Раствор 3 |
9,49 |
90,51 |
1,065 |
|
Раствор 4 |
8,25 |
91,75 |
1,058 |
|
Раствор 5 |
6,36 |
93,64 |
1,045 |
|
Раствор 6 |
5,04 |
94,96 |
1,039 |
|
Раствор 7 |
4,09 |
95,91 |
1,030 |
|
Раствор 8 |
3,37 |
96,63 |
1,022 |
Полученные данные плотности растворов от концентрации сульфата меди были изображены на рисунке 2, и функциональной зависимости имеет прямолинейное значение.
|
|
|
|
Рис. 1. Зависимость плотности растворов от концентрации хромата калия |
Рис. 2. Зависимость плотности растворов от концентрации сульфата меди |
2.5. Определение зависимости плотности растворов от концентрации хлорид бария
Для определения зависимости плотности растворов от концентрации готовили насыщенный раствор хлорид бария. Для этого отмеряли 250 мл дистиллированной воды с температурой 16⁰С и добавляли хлорид бария массой 76 г. Полученную смесь перемешивали до растворения. Полученный насыщенный раствор доводили до 20⁰С и с помощью ареометра измерили плотность раствора. Для получения раствора 2 с меньшей концентрацией отливали 50 мл раствора 1 и прибавляли 50 мл воды. Полученный раствор 2 перемешивали и доводили до 20⁰С. С помощью ареометра измерили плотность раствора. Для получения раствора 3 добавляли 50 мл воды и проводили измерения. Для получения раствора 4 отливали 50 мл раствора 3 и добавляли 50 мл воды и проводили измерения. Для получения раствора 5 отливали 50 мл раствора 4 и добавляли 50 мл воды. Для получения раствора 6 отливали 50 мл раствора 5 и добавляли 50 мл воды. Для получения раствора 7 отливали 50 мл раствора 6 и добавляли 50 мл воды. Для получения раствора 8 отливали 50 мл раствора 7 и добавляли 50 мл воды и проводили измерения. Для получения раствора 9 добавляли 100 мл воды. Полученный раствор доводили до 20⁰С и с помощью ареометра измеряли плотность. По полученным данным вычисляли массовую концентрацию растворов. Полученные данные занесены в таблицу 4.
Таблица 4
Плотности растворов хлорида бария при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
BaCl2 |
H2O |
||
|
Раствор 1 |
23,33 |
76,67 |
1,20 |
|
Раствор 2 |
19,64 |
80,36 |
1,17 |
|
Раствор 3 |
15,06 |
84,94 |
1,14 |
|
Раствор 4 |
13,20 |
86,80 |
1,12 |
|
Раствор 5 |
10,30 |
89,70 |
1,10 |
|
Раствор 6 |
8,23 |
91,77 |
1,09 |
|
Раствор 7 |
6,71 |
93,29 |
1,07 |
|
Раствор 8 |
5,56 |
94,44 |
1,06 |
|
Раствор 9 |
4,42 |
95,58 |
1,04 |
Полученные данные плотности растворов от концентрации хлорида бария были изображены на рисунке 3, и функциональной зависимости имеет прямолинейное значение.
2.6. Определение зависимости плотности растворов от концентрации нитрата аммония
Для определения зависимости плотности растворов от концентрации готовили насыщенный раствор нитрата аммония. Для этого отмеряли 100 мл дистиллированной воды с температурой 18⁰С и добавляли нитрат аммония массой 200 г. Полученную смесь перемешивали до растворения. Полученный насыщенный раствор доводили до 20⁰С и с помощью ареометра измерили плотность раствора. Для получения раствора 2 с меньшей концентрацией отливали 50 мл раствора 1 и прибавляли 50 мл воды. Полученный раствор 2 перемешивали и доводили до 20⁰С. С помощью ареометра измерили плотность раствора. Для получения раствора 3 добавляли 50 мл воды и проводили измерения. Для получения раствора 4 отливали 50 мл раствора 3 и добавляли 50 мл воды и проводили измерения. Для получения раствора 5 отливали 50 мл раствора 4 и добавляли 50 мл воды. Для получения раствора 6 отливали 50 мл раствора 5 и добавляли 50 мл воды. Для получения раствора 7 отливали 50 мл раствора 6 и добавляли 50 мл воды. Для получения раствора 8 отливали 50 мл раствора 7 и добавляли 50 мл воды и проводили измерения. Для получения раствора 9 добавляли 200 мл воды. Полученный раствор доводили до 20⁰С и с помощью ареометра измеряли плотность. По полученным данным вычисляли массовую концентрацию растворов. Полученные данные занесены в таблицу 5.
Таблица 5
Плотности растворов нитрата аммония при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
NH4NO3 |
H2O |
||
|
Раствор 1 |
66,70 |
33,30 |
1,310 |
|
Раствор 2 |
59,03 |
40,97 |
1,271 |
|
Раствор 3 |
50,66 |
49,34 |
1,241 |
|
Раствор 4 |
45,54 |
54,46 |
1,215 |
|
Раствор 5 |
38,40 |
61,60 |
1,140 |
|
Раствор 6 |
32,49 |
67,51 |
1,150 |
|
Раствор 7 |
27,62 |
72,38 |
1,131 |
|
Раствор 8 |
23,53 |
76,47 |
1,115 |
|
Раствор 9 |
16,79 |
83,21 |
1,075 |
|
|
|
|
Рис. 3. Зависимость плотности растворов от концентрации хлорида бария |
Рис. 4. Зависимость плотности растворов от концентрации нитрат аммония |
Полученные данные плотности растворов от концентрации нитрата аммония были изображены на рисунке 4, и функциональной зависимости имеет прямолинейное значение.
2.7. Определение зависимости плотности растворов от концентрации хлорида натрия
Для анализа функциональной зависимости хлорида натрия были использованы ранее полученные данные зависимости плотности растворов от концентрации для хлорида натрия другого автора. Автором было получено 7 растворов, у которых определена плотность. Полученные данные автором занесены в таблицу 6.
Таблица 6
Плотности растворов хлорида натрия при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
NaCl |
H2O |
||
|
Раствор 1 |
23,11 |
76,89 |
1,175 |
|
Раствор 2 |
20,03 |
79,97 |
1,150 |
|
Раствор 3 |
17,31 |
82,69 |
1,125 |
|
Раствор 4 |
14,91 |
85,09 |
1,110 |
|
Раствор 5 |
12,82 |
87,18 |
1,095 |
|
Раствор 6 |
10,43 |
89,57 |
1,080 |
|
Раствор 7 |
7,59 |
92,41 |
1,060 |
Полученные данные плотности растворов от концентрации хлорида натрия были изображены на рисунке 6, и функциональной зависимости имеет прямолинейное значение.
2.8. Определение зависимости плотности растворов от концентрации сульфита натрия
Для анализа функциональной зависимости сульфита натрия были использованы ранее полученные данные зависимости плотности растворов от концентрации для сульфита натрия другого автора. Автором было получено 9 растворов, у которых определена плотность. Полученные данные автором занесены в таблицу 7.
Таблица 7
Плотности растворов сульфита натрия при 20⁰С
|
Растворы |
Массовая концентрация |
ρ, г/см3 |
|
|
Na2SO3 |
H2O |
||
|
Раствор 1 |
17,76 |
82,24 |
1,172 |
|
Раствор 2 |
14,73 |
85,27 |
1,141 |
|
Раствор 3 |
12,15 |
87,85 |
1,120 |
|
Раствор 4 |
10,34 |
89,66 |
1,102 |
|
Раствор 5 |
8,78 |
91,22 |
1,089 |
|
Раствор 6 |
6,99 |
93,01 |
1,070 |
|
Раствор 7 |
5,54 |
94,46 |
1,055 |
|
Раствор 8 |
4,59 |
95,41 |
1,045 |
|
Раствор 9 |
2,37 |
97,63 |
1,031 |
|
|
|
|
Рис. 5. Зависимость плотности растворов от концентрации сульфита натрия |
Рис. 6. Зависимость плотности растворов от концентрации хлорида натрия |
Полученные данные плотности растворов от концентрации сульфита натрия были изображены на рисунке 5, и функциональной зависимости имеет прямолинейное значение.
|
|
|
Рис. 7. Зависимости плотности растворов от концентрации солей |
На рисунке 7 изображены совместные зависимости плотности растворов от концентрации. Практически все имеют линейное изменение. Из предложенных солей, плотности растворы только хромата калия имеют нелинейную зависимость от концентрации.
ВЫВОДЫ
1) В ходе исследования были приготовлены реактивы к работе, которые использовались для приготовления растворов.
2) Были приготовлены растворы солей с различными концентрациями (даны в таблицах выше), а также определены плотности растворов.
3) В завершении практической работы мы изобразили на графиках функциональную зависимость плотности растворов от концентрации и увидели, как зависит плотность раствора от концентрации.
СПИСОК ЛИТЕРАТУРЫ
1. Веб сайт https://ru.wikipedia.org/wiki/
2. Мазунин С.А. Физико-химический анализ в химии и химической технологии: учеб. пособ., Перм. гос. нац. исслед. ун-т. Пермь, 2014. С. 492.
3. Носков М.Н. Фазовые равновесия в многокомпонентных водных системах, содержащих ионы K+, NH4+, H2PO4–, HPO42-, SO42-, Cl– и карбамид. Дис. канд. хим. н. Пермь 2016г. С. 307.
4. Справочник по растворимости солевых систем. Л.,1953,Т.1, 671с.
5. Киргинцев А. Н., Трушникова Л. Н., Лаврентьева В. Г. Растворимость неорганических веществ в воде. Справочник. Изд-во «Химия», 1972. 248 с.







